西葫芦PRSV-W 病毒病抗病种质鉴定及抗性遗传分析
2021-01-28王凯玥张沙沙张国裕田佳星李海真王建书耿丽华
王凯玥 张沙沙 张国裕 田佳星 张 帆 李海真 王建书 耿丽华
(1北京市农林科学院蔬菜研究中心/农业农村部华北地区园艺作物生物学与种质创制重点实验室/农业农村部都市农业(北方)重点实验室,北京 100097;2河北工程大学园林与生态工程学院,河北 邯郸 056038)
西葫芦(Cucurbita pepoL.)是我国普遍栽培的瓜类蔬菜,其栽培面积及产量均居世界第一[1]。西葫芦产量高,易于管理,可为种植农户带来较好的经济效益。但西葫芦生产长期受病毒病的危害,其中番木瓜环斑病毒西瓜株系(papaya ringspot virus-watermelonstrain,PRSV-W) 常单独侵染,或与黄瓜花叶病毒(cucumber mosaic virus,CMV)、小西葫芦黄化花叶病毒(zucchini yellow mosaic virus,ZYMV)、西瓜花叶病毒(watermelon mosaic virus,WMV)等复合侵染西葫芦等葫芦科作物,田间发病普遍[2-4]。西葫芦植株感染PRSV-W 后会出现花叶、泡斑、蕨叶、植株矮化、果实畸形等症状,可造成30%~60%的产量损失,甚至绝产,严重影响西葫芦产量与果实的商品性[5-7]。PRSV-W病通过农事操作中的机械摩擦或蚜虫刺吸等途径快速传播,迄今尚无高效的防治药剂,栽培抗病品种是减少危害最经济有效的措施[6,8]。
目前,PRSV-W 抗病种质的评价鉴定、抗性性状遗传分析及抗病基因连锁分子标记的研究多集中于黄瓜[9-11]、西瓜[12-13]及甜瓜[14-15]等葫芦科作物上。有关中国南瓜PRSV-W 抗性的研究也相对较多[16-18],但有关西葫芦PRSV-W 抗性鉴定方法、抗病种质的筛查及抗性性状遗传分析的研究鲜有报道[19-21]。特别是国内对现存西葫芦品种及种质资源的PRSV-W 抗性及抗病性状遗传特性研究不足,极大限制了西葫芦抗病种质资源的挖掘利用及抗病育种研究。因此,本研究在前期初步探索的基础上[22],进一步完善西葫芦PRSV-W 苗期接种鉴定方法,对收集的148 份西葫芦品种及高代自交系进行抗性评价筛查,并通过对六世代群体的抗性研究揭示PRSV-W 抗病性状的遗传规律,旨在为抗病育种提供抗病种质及技术支持,为进一步分离鉴定抗病基因奠定基础。
1 材料与方法
1.1 试验材料
供试西葫芦品种及育种材料(86 份主栽品种,62 份高代自交系)均由北京市农林科学院蔬菜研究中心南瓜课题组收集保存,具体见表1。用于抗病性状遗传规律分析的六世代群体包括母本P1(BV21)、父本P2(BV37)和F1(BV21×BV37)各30 株,F2群体192 株,BC1P1(F1×BV21) 150 株,BC1P2(F1×BV37) 150 株。

表1 本试验用148 份西葫芦品种Table 1 148 squash varieties in this study
1.2 PRSV-W 苗期接种方法
供试种子先经40℃干燥处理2 h,再65℃高温处理2 h,浸种4 h 后于30℃LRH250 恒温培养箱(上海一恒科学仪器有限公司)催芽(湿度70%)24 h,然后播种于灭菌营养钵中,置于防虫网室内培养(25 ~30℃)。待子叶展平,撒少量600 目金刚砂于子叶上,用质量浓度为0.5 mg·mL-1的病毒接种液(0.02 mol·L-1磷酸缓冲液研磨携带PRSV-W 病毒的叶片组织)摩擦接种。接种15~25 d 后,观察植株第1 ~第4片真叶的发病情况,记录并进行抗病分级,然后取叶片保存于-70℃,备用。148 份不同品种西葫芦及高代自交系,每份种植7 株,设3 次重复,其中2 株作为空白对照;六世代群体进行单株接种鉴定,选择母本BV21、父本BV37 及F1各5 株作为空白对照。
西葫芦对PRSV-W 病的抗性划分为0 ~4 级(图1)。其中,0 级:植株无任何症状;1 级:少数叶片局部轻微花叶,形态正常;2 级:多数叶片花叶,形态正常,个别叶片畸形;3 级:多数叶片严重花叶、泡斑,新叶畸形;4 级:几乎所有叶片严重花叶、畸形。按照公式计算植株病情指数(disease index,DI):
DI=100×Σ(各级病株数×各级代表值)/(调查总株数×最高级代表值)。
DI ≤5 为高度抗病(high resistant,HR);5 <DI≤25 为抗病(resistant,R);25 <DI ≤70 为感病(susceptible,S),DI>70 为高度感病(high susceptible,HS)。
1.3 DAS-ELISA 及RT-PCR 检测
使用DAS-ELISA 试剂盒(美国Agdia 公司)进行叶片 PRSV-W 病毒酶联免疫 ( enzyme-linked immunosorbent assay,ELISA)检测,具体方法参照试剂盒使用说明。反转录PCR(reverse transcription PCR,RT-PCR)分析参照刘勇等[4]的方法。引物:PRSVdF:GACCTACAAGCGTGACTTTAC;PRSVdR:CACCCATG CCATGCATCTTTC。RNA 提取方法参照EasyPure®Plant RNA Kit 试剂盒(北京全式金生物技术有限公司)说明书进行。
1.4 数据统计分析
采用SPSS 13.0 软件进行试验数据分析及卡方检验。
2 结果与分析
2.1 西葫芦PRSV-W 抗病种质筛查鉴定
PRSV-W 病毒病接种鉴定结果显示,在收集的148份西葫芦材料中,22 份表现为高度抗病(HR),11 份表现为抗病(R),抗病总占比为22.3%;12 份表现为感病(S),103 份表现为高度感病(HS),感病总占比为77.7%(表2、图1)。ELISA 与RT-PCR 的检测结果辅助验证了表型鉴定结果,但均存在漏检出材料,其中,ELISA 漏检出感病材料5 份,RT-PCR 漏检出3 份。此外,万盛娇子与BV23 这2 份种质材料虽然表现抗病,但RT-PCR 也检测出叶片中存在病毒粒子(表2)。上述结果表明,RT-PCR 检测结果较ELISA 更为灵敏、可靠。

表2(续)

表3 西葫芦各世代群体植株PRSV-W 抗性表现Table 3 PRSV-W resistance performance of plants in different generation of Zucchini
2.2 西葫芦PRSV-W 抗病性状遗传分析
抗病种质材料中,高代自交系BV21 表现为非常高的抗性,接种PRSV-W 病毒后未见明显病症,由图3可知,与对照未接种植株无明显差异;感病自交系BV37 则表现为严重感病,新生叶片出现花叶泡斑、严重畸形(图3)。以2 份材料配制六世代群体(P1、P2、F1、F2、BC1P1和BC1P2),进行PRSV-W 抗性遗传分析,结果显示,F2群体中137 株抗病,55 株感病,符合显性单基因控制性状的分离比例3 ∶1(χ2=1.36,P=0.24);回交群体中,与抗性亲本BV21 回交,其后代均表现为抗病,与感病亲本BV37 回交,其后代的抗、感单株分离比符合1 ∶1(χ2=1.71,P=0.19)(表3)。综上表明,BV21 的PRSV-W 抗性受1 对显性抗病基因控制。

图1 西葫芦PRSV-W 病苗期鉴定抗性分级Fig.1 Identification and resistance classification of PRSV-W disease in Summer squash
3 讨论
3.1 西葫芦PRSV-W 抗病种质的评价鉴定
准确、高效简便的PRSV-W 抗性鉴定方法及抗病种质资源的筛查是西葫芦抗病育种的重要组成部分。Barbosa 等[6]利用性状观察结合ELISA 检测,筛查获得8 份中等抗性的南瓜种质材料;Nogueira 等[19]利用两次病毒子叶摩擦接种法对16 份西葫芦杂交种及8份自交系进行了PRSV-W 抗性接种鉴定,获得了1 份抗病杂交种材料。本研究经过对收集的西葫芦种质资源进行广泛的PRSV-W 接种试验,建立了简便高效的苗期抗性鉴定技术,并利用ELISA 及RT-PCR 技术验证了抗性性状分级的科学性,同时对国内主要西葫芦栽培品种进行了统一的抗性筛查评价,获得22 份高抗
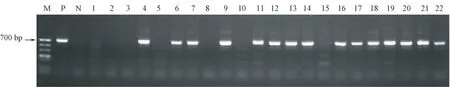
图2 部分西葫芦育种材料PRSV-W 病毒病的RT-PCR 分析Fig.2 RT-PCR analysis of PRSV-W virus disease of part of Zucchini breeding material

图3 西葫芦PRSV-W 病毒病抗、感亲本材料Fig.3 Symptom expressions on the resistant and susceptible parent lines of squash to PRSV-W infection
种质资源,这对我国西葫芦生产中的品种选择及PRSV-W 抗病育种具有较高的利用价值。
3.2 西葫芦PRSV-W 病毒病的抗性遗传规律
不同葫芦科作物对PRSV-W 抗性的遗传规律不同,甚至同一作物不同种质材料间的抗性控制基因也存在差异。黄瓜对PRSV-W 的抗性既存在显性控制基因也有隐性控制基因[9-11,23-24];西瓜则受1 个隐性[13]或2 个具有加性且不完全显性效应的抗病基因控制[12,25-26];甜瓜及葫芦则表现为单显性抗病基因[14,26-27]。Brown 等[16]研究认为中国南瓜野生近缘种Nigerian Local 携带1 个隐性抗病基因prv,是中国南瓜及西葫芦栽培种中PRSV-W 抗性基因的来源,不过McPhail-Medina 等[17]和Seda-Martinez[18]则认为该材料的抗性至少受1 个显性抗性基因及1 个显性上位抑制基因控制。de Oliveira 等[5]研究表明,中国南瓜的PRSV-W 抗性受1 个不完全显性抗病基因控制。南瓜(C.ecuadorensis)中PRSV 抗性受单显性基因控制[28],而印度南瓜的PRSV-W 抗性可能受2 ~3 个基因控制[29]。西葫芦Whitaker 中的PRSV-W 抗性可能受1个主效基因及多个微效基因的调控[20]。本研究认为西葫芦BV21 的抗性受单显性抗病基因控制,以上研究结果之间的差异可能取决于抗性材料的选择,以及抗、感群体划分标准的不同。
4 结论
本研究建立并完善了西葫芦PRSV-W 病的苗期人工接种鉴定方法,并对高代自交系育种材料及国内目前主栽西葫芦品种进行了系统的抗性评价筛查,获得了22 份高抗PRSV-W 种质材料,同时揭示了西葫芦自交系BV21 的PRSV-W 抗性受单显性基因控制。本研究为西葫芦PRSV-W 抗病育种提供了种质材料及技术支持,也对生产中抗病品种的选择及进一步分离鉴定抗病基因具有重要意义。
