大肠杆菌对藏羊子宫内膜上皮细胞相关炎性因子表达的影响
2021-01-28张兴云潘阳阳胡学权韩金辉余四九徐庚全王立斌
张兴云 王 萌 潘阳阳 胡学权 韩金辉 余四九 徐庚全 王立斌
(甘肃农业大学动物医学院/甘肃省牛羊胚胎工程技术研究中心,甘肃 兰州 730070)
藏羊是中国绵羊三大品系(蒙古系、藏羊系和哈萨克绵羊系)之一[1-2],是青藏高原牧民重要的生产和生活资料。但在粗放式的养殖模式下,受大肠杆菌(Escnerichia coli) 和 金 黄 色 葡 萄 球 菌(Staphylococcus aureus)等细菌的感染[3-6],藏羊子宫内膜炎的发病率水平较高,给当地经济发展和人民的生活带来了很大的影响[7]。因此研究藏羊子宫内膜炎发病过程中相关炎性因子的表达规律,对该病的防治具有重要意义。
机体发生炎症反应时,细胞因子可作为免疫递质诱导炎症因子的调节并介导细胞应答过程[8]。白细胞介素1β(interleukin-1β,IL-1β)作为白细胞系1(interleukin-1,IL-1)的主要分泌形式,在炎症和自身免疫性疾病的发生和发展过程中发挥着重要的作用,其细胞因子表达水平和机体发生炎症反应的程度相关,机体的受损程度通常由其表达量的高低反映[9-11]。白细胞介素6(interleukin-6,IL-6)是炎症早期产生的促炎细胞因子,组织损伤、剧烈疼痛、应激和炎症的发生等均可使IL-6 的表达水平升高[12]。白细胞介素8(interleukin-8,IL-8)属于趋化因子CXC 基因家族的白细胞趋化因子[13-14],其能趋化嗜中性粒细胞向感染部位募集,在机体抵抗炎症中起着重要的作用[15-16]。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)由激活的单核巨噬细胞分泌,它和细胞膜上的特异性的受体结合后发挥促进细胞生长、分化、凋亡及诱发炎症等重要作用[17-18]。
目前治疗子宫内膜炎主要通过抗生素的治疗,但大量抗生素的使用导致细菌产生耐药性,因此如何更有效地防治子宫内膜炎已迫在眉睫。
本研究通过组织块贴壁法和酶消化法分离培养藏羊子宫内膜上皮细胞(endometrial epithelial cells,EECs),探索简便且高效的培养条件,为研究藏羊子宫内膜生殖生理机制提供体外细胞模型;并用不同感染复数(multiplicity of infection,MOI)E.coli感染后,采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)及酶联免疫(enyzme linked immunosorbent assay,ELISA)在基因和蛋白水平上检测IL-1β、IL-6、IL-8 和TNF-α等炎性因子在藏羊EECs 上的表达,旨在为揭示子宫内膜炎的发病机理提供参考资料。
1 材料与方法
1.1 仪器设备
细胞培养箱(Forma3110,Thermo Fisher 公司,美国);荧光倒置相差显微镜(CK41,Olympus,日本);酶标仪(I Mark,Bio-Rad,美 国);qRT-PCR 仪(Light Cycler 96,罗氏,德国)。
1.2 主要试剂
基础培养液(dulbecco′s modified eagle medium,DMEM/F12)(12400-016)、胎牛血清(foetal bovine serum,FBS)(10099-141)、表皮生长因子(epidermal growth factor,EGF)、青霉素和链霉素(15140122)均购自于Gibco 公司(美国);胰蛋白酶(T4799)、冻存液二甲基亚砜(dimethylsulfoxide,DMSO)购自Sigma 公司(美国);细胞角蛋白18(cytokeratin 18,CK18)抗体、波形蛋白(vimentin)抗体购自Bioss 公司(北京);标准菌株E.coli(ATCC25922)来自甘肃农业大学动物医学院;IL-1β、IL-6、IL-8 和TNF-α酶联免疫分析试剂盒(上海晶抗)。
1.3 样品采集与处理
空怀期健康藏羊子宫取自青海省西宁市某屠宰场,动物屠宰后30 min 内采集样品,迅速放入含青霉素和链霉素的生理盐水中,4℃条件下,3 h 内带回实验室。
1.4 藏羊EECs 体外分离培养及鉴定
参考并优化马欣等[19]绵羊子宫内膜上皮细胞的纯化培养方法,将样品冲洗后,剪下子宫角后2/3 段,用含青霉素和链霉素的生理盐水冲洗3 次,剪去子宫阜,将子宫内膜与肌肉组织分离,将子宫内膜剪成1 mm3大小的组织块备用。
1.4.1 组织块贴壁法 将组织块以2 ~3 块·cm-2的密度接种到直径3 cm 的培养皿中,每皿加入1 mL 完全培养基DMEM(20%FBS、50 ng·mL-1EGF),5%CO2,37℃培养6 h,待组织块贴壁后,再加入1 mL 原代培养基继续培养,每2 d 换一次培养基,直至细胞铺满整个培养皿。
1.4.2 酶消化法 将组织块用0.2%的胶原酶Ⅰ于37℃水浴震荡消化;待其变为糊状时,轻轻吹打,将所得混悬液依次过100、200、400 目细胞筛至3 cm 培养皿中,1 000 r·min-1离心5 min,弃上清,分别置于添加50 ng·mL-1EGF 和未添加EGF 的完全培养基DMEM(20%FBS)进行培养。
1.4.3 细胞的纯化及传代 将上皮细胞用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后,加入1 mL 0.25%胰蛋白酶[含乙二胺四乙酸(thylene amine ttraacetic cid,EDTA)],37℃消化0.5~1 min,弃去纤维细胞,再加入1 mL 0.25%胰蛋白酶(含EDTA),37℃消化2~3 min,镜下观察大部分梭形细胞变圆漂浮,此时加完全培养基终止消化,1 000 r·min-1离心5 min,弃上清,加培养基继续培养。
1.4.4 细胞鉴定 采用细胞免疫荧光方法检测波形蛋白和角蛋白-18 在待测细胞上的表达,将细胞密度调整至1×104个·mL-1接种于24 孔板培养,待细胞长至80%左右时,弃培养液,PBS 清洗2 ~3 遍;每孔加1 mL 4%多聚甲醛,固定30 min;PBS 振荡清洗,每孔加250 μL 0.5%TritonX-100,通透20 min;PBS 振荡清洗,每孔加入250 μL 封闭液1 h,弃废液,每孔加250 μL 已稀释(1 ∶100)的一抗,4℃孵育样品过夜;回收一抗,用PBS 振荡清洗,每孔加250 μL 已稀释(1 ∶400)的二抗(山羊抗兔IgG),37℃避光孵育1 h;PBS 振荡清洗,每孔加250 μL 4,6-联脒-2-苯基吲哚(DAPI)染核,避光孵育3 min,PBS 清洗后用荧光显微镜观察。免疫荧光方法鉴定细胞时,试验组一抗为波形蛋白、角蛋白-18,阴性对照组为PBS。
1.4.5 细胞生长曲线 将细胞密度调整至5×103个·mL-1接种到24 孔板,5%CO2、37℃培养,每2 d 换一次培养液;以接种细胞开始记为0 d,每隔24 h 取3孔细胞计数并取平均值,连续计数7 d;以时间为横坐标,以单位(mL)细胞数为纵坐标绘制细胞生长曲线。
1.4.6 细胞的冻存及复苏 细胞冻存时,调整细胞密度并根据所需加入冻存液,转入冻存管并封口。先将冻存管放在4℃冰箱30 min,然后转移至-20℃冰箱放置20 min,再转入-80℃冰箱过夜。细胞复苏时,取出冻存细胞并讯速置于37℃恒温水浴锅中,加3 ~5 mL 15%FBS 培养液,1 000 r·min-1离心5 min,弃上清,调整密度后,5%CO2、37℃培养。
1.5 E.coli 培养及细胞感染试验
1.5.1E.coli的培养E.coli采用划线法接种至固体培养基,37℃恒温培养16~24 h;待菌株形成单个菌落,挑取单个菌落接种至1 mL LB(luria-bertani)液体培养基,置于恒温振荡器,37℃震荡培养24 h,得到菌悬液;通过活菌计数法对其计数后置于4℃备用。
1.5.2E.coli感染试验 将细胞调整密度后接种在6 孔板,5%CO2、37℃培养至对数生长期,PBS 清洗后取3 孔计数并取平均值;设置不同的MOI 进行E.coli感染试验,即设空白对照(正常培养的细胞,CK)、1 ∶1、5 ∶1、10 ∶1、20 ∶1、50 ∶1共6 组试验模型(MOI 为细菌数∶细胞数),每孔各加2 mL 基础培养液,并按所设MOI加入相应体积E.coli;37℃感染培养3 h,观察并拍照。
1.6 细胞总RNA 提取及反转录
提取感染细胞总RNA,并反转录成cDNA;反应体系(20 μL):6 μL ddH2O,2 μL 5×gDNA digester Buffer,1 μL gDNA digester,1 μL 模板RNA,42℃孵育2 min,再加10 μL 2×Honor® ⅡSuperMix plus。反应条件:25℃5 min,42℃30 min,85℃5 min,4℃保存。
1.7 引物设计
在GenBank 数据库中检索羊IL-1β、IL-6、IL-8、TNF-α和β-actin基因序列,用Primer Premier 6.0 软件设计引物,由上海生工基因公司合成,引物序列见表1。

表1 试验所用引物Table 1 Primers used in the test
1.8 qRT-PCR 检测IL-1β、IL-6、IL-8 和TNF-α的基因表达
通过qRT-PCR 检测IL-1β、IL-6、IL-8 和TNF-α的基因表达,β-actin为内参基因,反应体系(20 μL):TB Green Premix Ex Taq II 10 μL,上下游引物各0.8 μL,ddH2O 6.4 μL,cDNA 模板2 μL。反应条件:95℃预变性5 min;95℃变性5 s,60℃退火30 s,72℃延伸30 s,40 个循环,每个样品设4 个重复组,试验重复3次。通过2-ΔΔCt方法计算上述基因的相对表达量。使用SPSS 25 软件对数据进行分析。
1.9 ELISA 检测IL-1β、IL-6、IL-8 和TNF-α 的蛋白表达
E.coli感染藏羊EECs 3 h 后将6 孔板上清液保存至1.5 mL 无菌离心管中,并通过ELISA 测定细胞上清液中IL-1β、IL-6、IL-8 和TNF-α的蛋白表达。
2 结果与分析
2.1 细胞体外分离培养及鉴定
2.1.1 组织块贴壁法 组织块培养到第7 天时周围已有细胞长出,主要有2 种细胞,分别是纤维细胞和上皮样细胞(图1-A);再经过1 ~2 d 的培养,细胞逐渐融合在一起,单层铺满组织周围(图1-B),此时PBS清洗后可将细胞用0.25%胰蛋白酶进行纯化,去除大部分纤维细胞以及部分上皮样组织块;继续培养1 ~2 d 后细胞长到培养皿面积的80%以上(图1-C),根据细胞生长情况重复纯化过程,可将纤维细胞及上皮样组织块逐步去除干净,可得到纯度较高的藏羊EECs(图1-D)。
2.1.2 酶消化法 经过12 h 培养后无EGF 组上皮样细胞贴壁较少,而EGF 组上皮样细胞已大量贴壁,两组上皮样细胞均簇拥在一起(图2-A、图3-A),同时发现少量成纤维细胞;此时给两组细胞更换培养液培养24 h,细胞即可铺满培养瓶底部(图2-B、图3-B),但EGF 组细胞明显更密集;PBS 清洗后可将两组细胞用0.25%胰蛋白酶利用差速消化法进行纯化,此时将完全培养基浓度由20%FBS 降至15%FBS,其余条件不变,培养48 h 后(第2 代),无EGF 组细胞形态规则较乱(图2-C),而EGF 组细胞形态规则且长势良好(图3-C);根据细胞生长情况重复两组细胞纯化培养过程,可将EGF 组成纤维细胞逐步去除干净,得到纯度较高的藏羊EECs(图3-D、E),并可传至6 代以上(图3-G),无EGF 组细胞则从第3 代开始细胞长势及活性快速下降,纯度也开始降低,细胞体积变大,细胞量减少(图2-D)。
2.1.3 EECs 的鉴定 细胞免疫荧光方法检测显示,PBS(阴性对照)、波形蛋白在上皮细胞质上不表达,呈阴性(图4-A2、A3、B2、B3),角蛋白-18 在上皮细胞中特异性表达,细胞质被染成红色,呈阳性(图4-C2),鉴定显示,仅有极少成纤维细胞出现,藏羊EECs 纯度达98%以上。
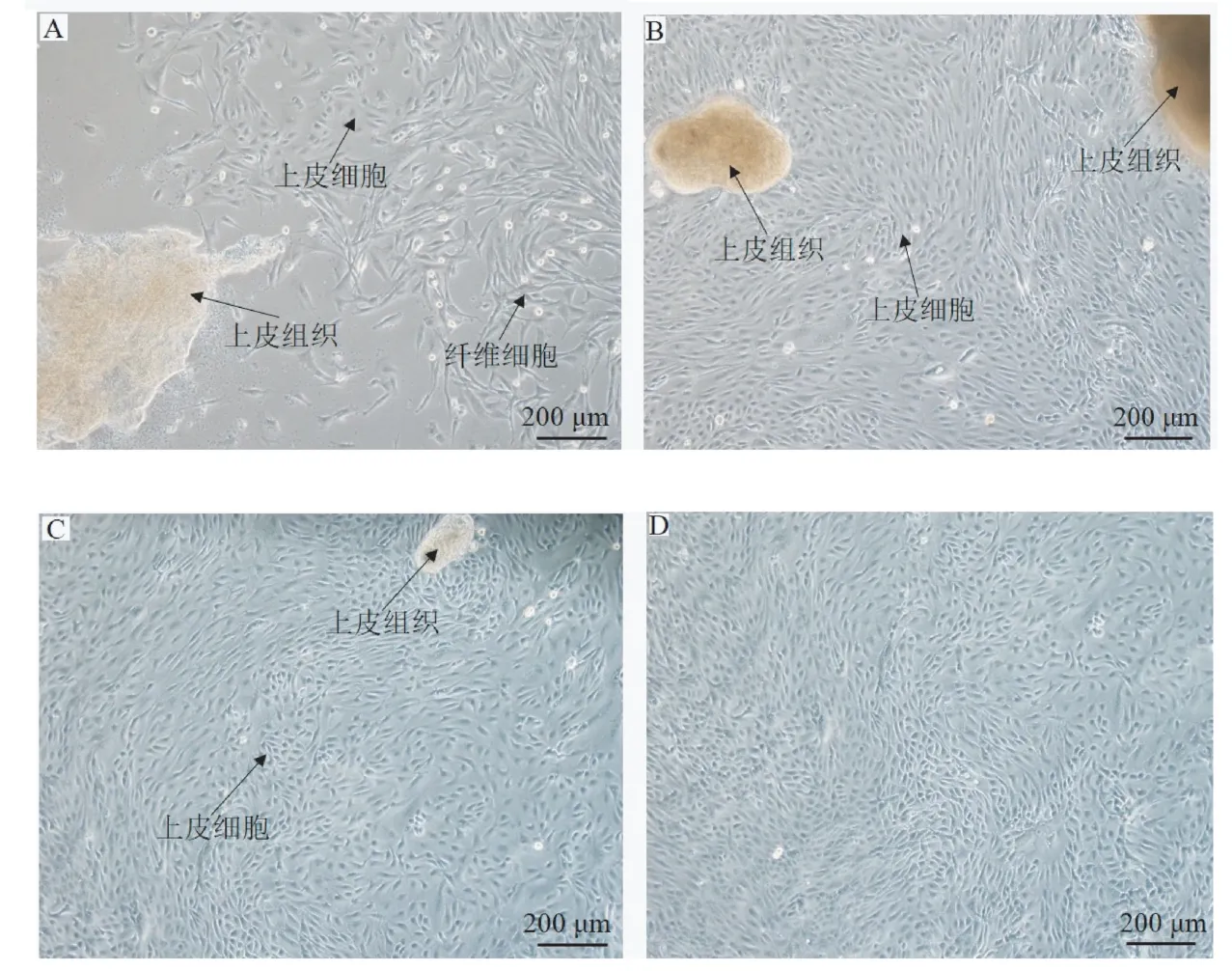
图1 组织块贴壁法获得的藏羊EECsFig.1 Tibetan sheep EECs cultured by tissue explants adherent method
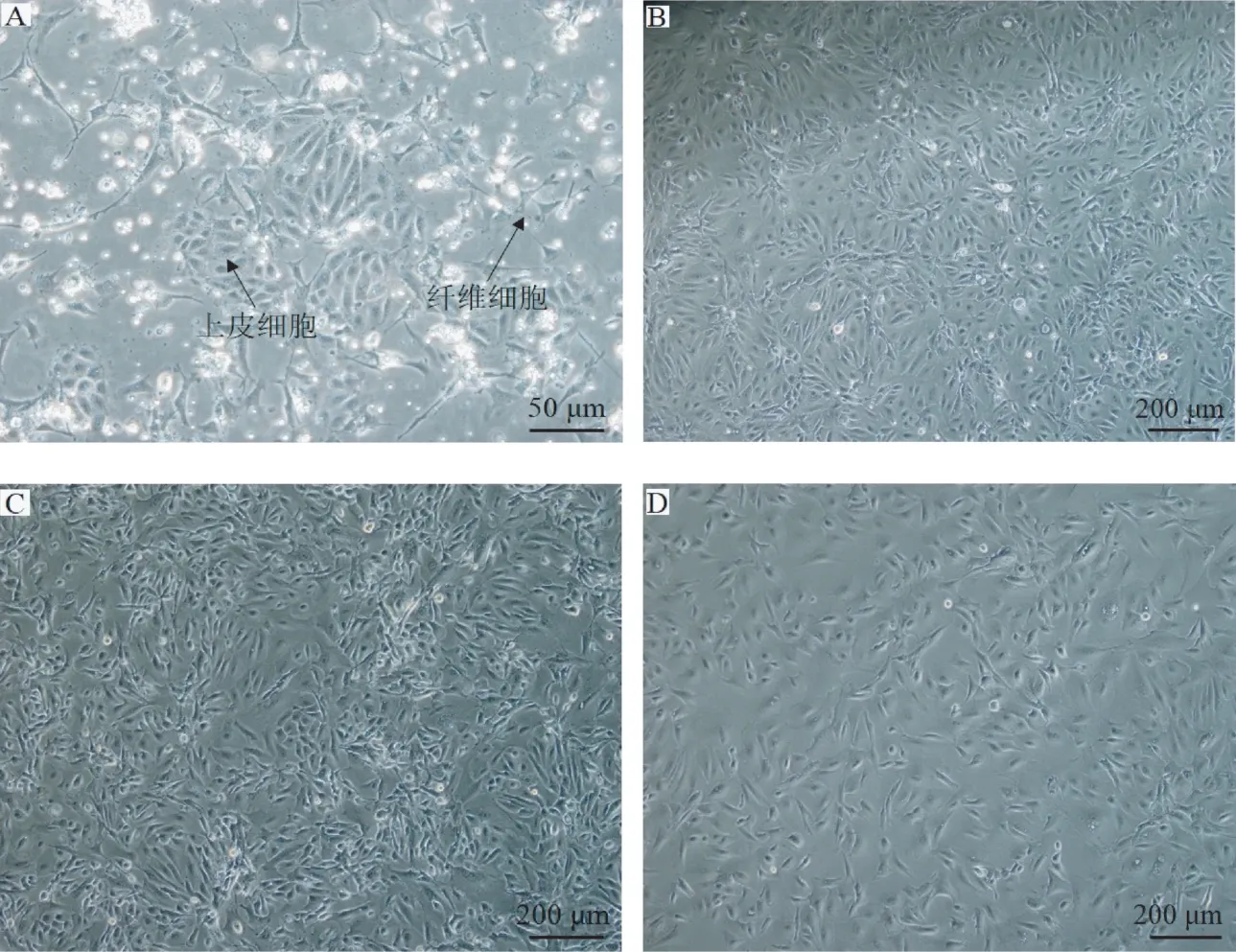
图2 酶消化法获得的藏羊EECs(无EGF)Fig.2 Tibetan sheep EECs cultured by enzymatic digestion (without EGF)

图3 酶消化法获得的藏羊EECs(含EGF)Fig.3 Tibetan sheep EECs cultured by enzymatic digestion (with EGF)
2.1.4 细胞的生长曲线 接种细胞后,第1 天时细胞微量增殖,速度较慢,处于停滞期;第2 天时,细胞增殖较明显;第3 天开始细胞增殖极为旺盛,处于对数生长期;第5 天时,细胞增殖达到最高值,细胞不再增殖,随后进入平台期。根据所得曲线,藏羊EECs 的生长曲线似“S”形(图5)。
2.2 E.coli 感染藏羊EECs
经活菌计数测得E.coli浓度为7×108CFU·mL-1,细胞计数法得到6 孔板单孔平均细胞数为3.6×105个;显微镜观察发现,空白组细胞状态良好;当MOI 为1 ∶1时,仅有少量E.coli附着在细胞表面,出现空泡样,细胞正常生长(图6-A、B);当MOI 为5 ∶1和10 ∶1时,细胞开始脱落且能明显看到E.coli附着在细胞表面,此时大部分细胞也可正常生长(图6-C、D);当MOI 为20 ∶1和50 ∶1时,细胞上附着有大量E.coli,并出现大量细胞碎片,只有少量细胞能正常生长(图6-E、F)。
2.3 qRT-PCR 检测IL-1β、IL-6、IL-8 和TNF-α的基因表达情况
由图7、8 可知,E.coli感染藏羊EECs 3 h 后,与CK 相比,当MOI 为1 ∶1时,IL-1β、IL-6 和IL-8 基因的相对表达量升高,但不显著,TNF-α基因的相对表达量达到最高且差异显著;随着MOI 增加,除TNF-α基因外,其余各基因的相对表达量均逐渐增加,当MOI为20 ∶1时,IL-8 基因的相对表达量达到最高;当MOI为50 ∶1时,IL-1β、IL-6 基因的相对表达量达到最高,而TNF-α基因的相对表达量较CK 升高不显著。

图4 藏羊EECs 免疫荧光鉴定Fig.4 Immunofluorescence identification of Tibetan sheep EECs
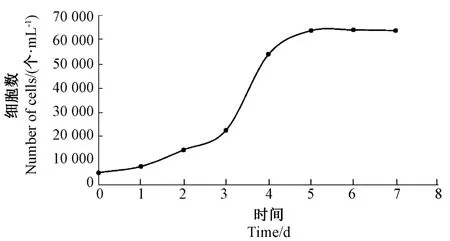
图5 藏羊EECs 生长曲线Fig.5 Growth curve of Tibetan sheep EECs
2.4 ELISA 检测IL-1β、IL-6、IL-8 和TNF-α 的蛋白表达情况
由图9、10 可知,IL-1β、IL-6、IL-8 和TNF-α在蛋白合成过程中与其基因的相对表达量趋势一致,即E.coli感染藏羊EECs 3 h 后,当MOI 为1 ∶1 时,IL-1β、IL-6 和IL-8 的蛋白含量与CK 相比较变化不明显,但TNF-α的蛋白含量达到最高;随着MOI 增加,除TNF-α外,其余各基因的蛋白含量逐步增加,当MOI 为20 ∶1时,IL-8 的蛋白含量达到最高;当MOI 为50 ∶1时,IL-1β、IL-6 的蛋白含量达到最高,而TNF-α基因的蛋白含量变化不显著。
3 讨论
3.1 藏羊EECs 体外分离培养

图6 不同MOI 下藏羊EECs 的形态变化Fig.6 Morphological changes of Tibetan sheep EECs at different MOI
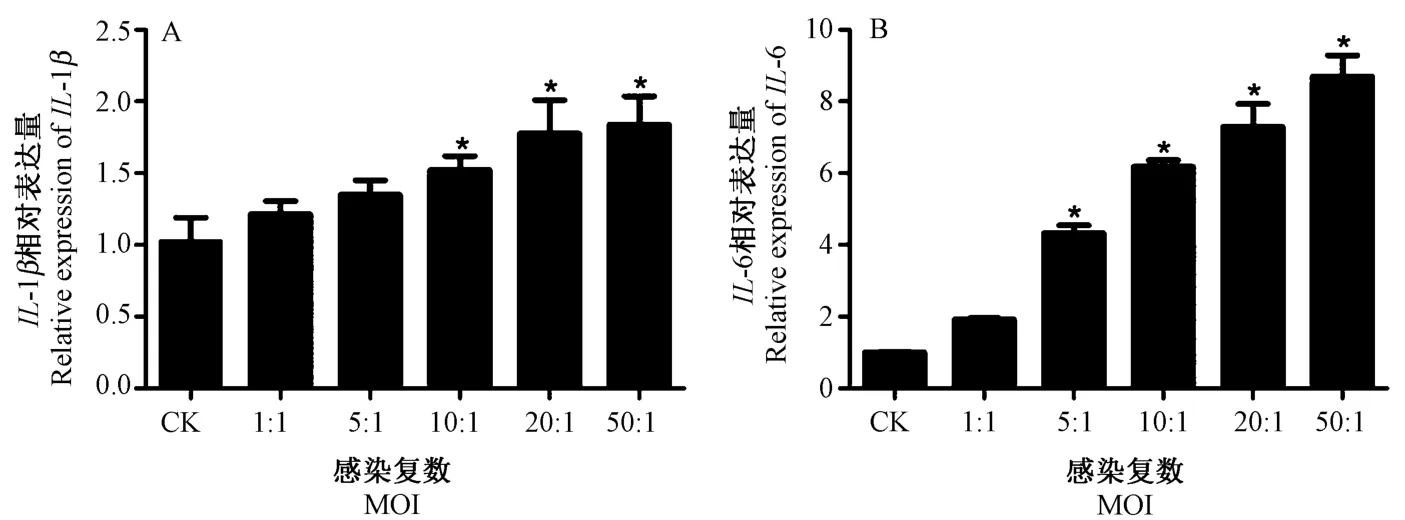
图7 E.coli 感染藏羊EECs 后IL-1β、IL-6 基因的相对表达Fig.7 Relative expression of IL-1β and IL-6 gene in Tibetan sheep EECs infected with E.coli

图8 E.coli 感染藏羊EECs 后IL-8、TNF-α 基因的相对表达Fig.8 Relative dxpression of IL-8 and TNF-α gene in Tibetan sheep EECs infected with E.coli
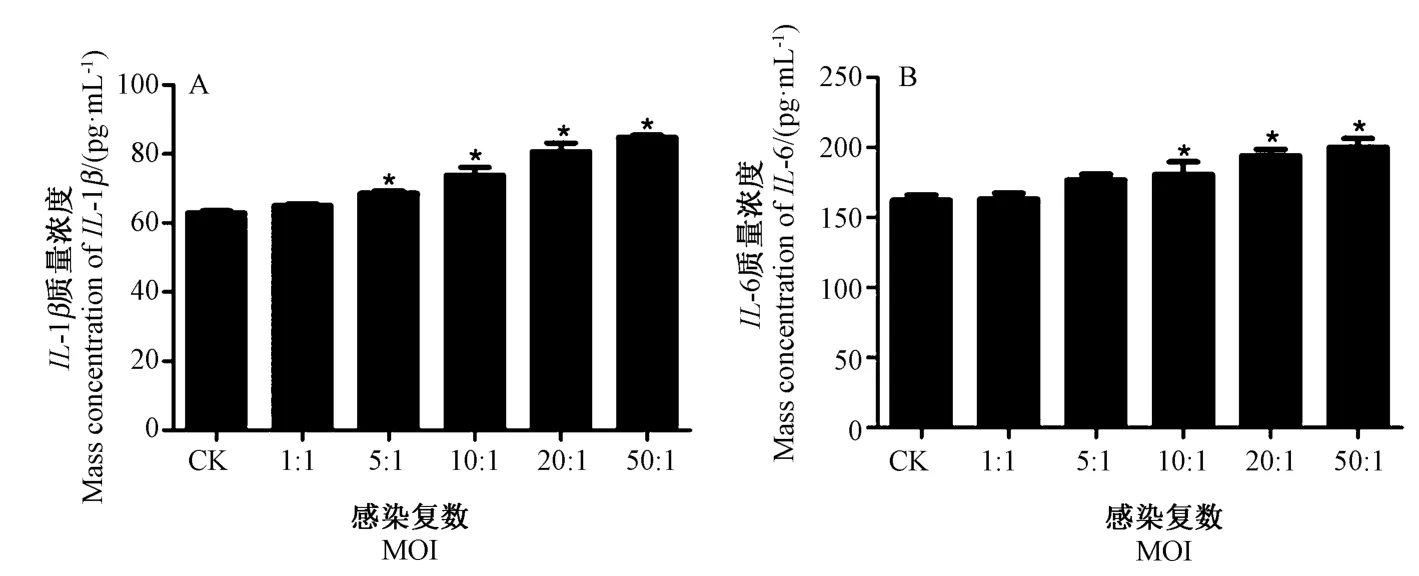
图9 E.coli 感染藏羊EECs 后IL-1β、IL-6 的蛋白表达Fig.9 Protein expression of IL-1β and IL-6 in Tibetan sheep EECs infected with E.coli
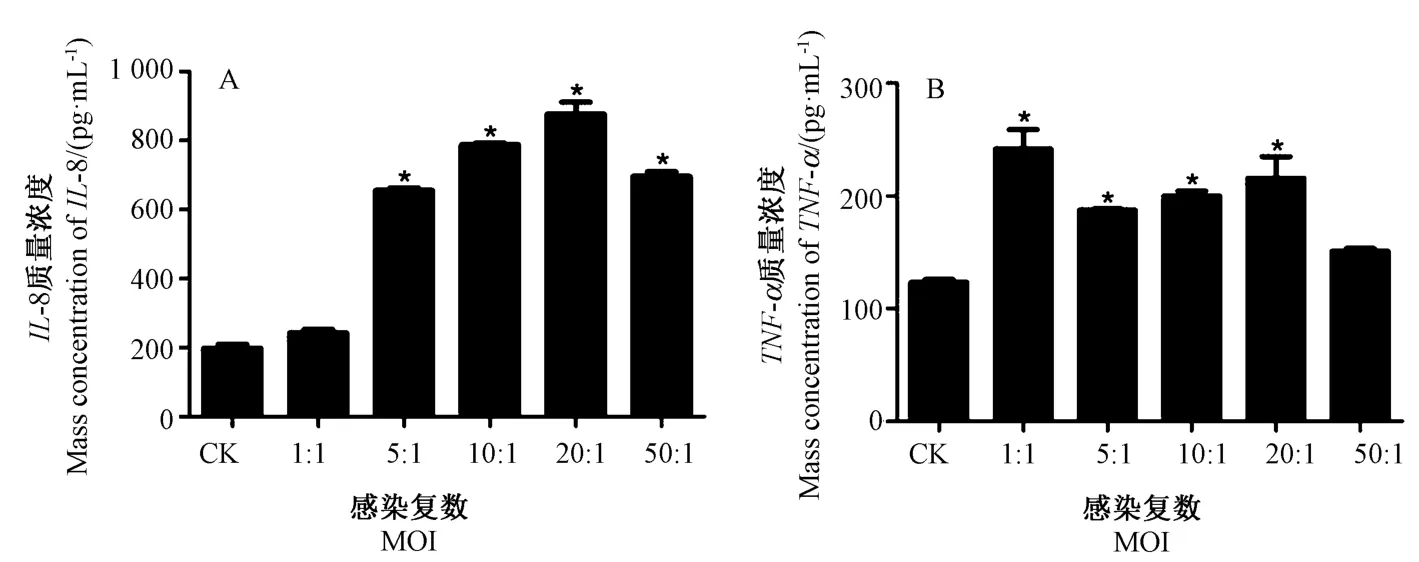
图10 E.coli 感染藏羊EECs 后IL-8、TNF-α 的蛋白表达Fig.10 Protein expression of IL-8 and TNF-α in Tibetan sheep EECs infected with E.coli
研究表明,EGF 对细胞生长的影响具有物种差异性和剂量依赖性[20-23],低剂量EGF 可促进增殖,而高剂量EGF 可诱导细胞周期停滞和凋亡[24]。本试验通过组织块贴壁及酶消化2 种方法对藏羊EECs 进行体外培养,并在酶消化法培养过程中设置了加入低剂量(50 ng·mL-1)的EGF 组和无EGF 组。何志全等[25]、陈利平等[26]在组织块贴壁法培养过程中用刀刮取子宫内膜上皮组织使其呈糊状后再进行培养,但是用刀刮取过程对上皮组织造成巨大损伤,致使细胞活力降低且不易存活。赵诚悦等[27]发现组织块贴壁法获得的细胞基质细胞占据主导优势,但无法对细胞进行纯化。马欣等[19]成功通过组织块贴壁法获得较高纯度的绵羊子宫内膜上皮细胞,但此方法获得的细胞需经过5~7 次的纯化,该细胞在经过3~4 次传代后细胞出现形态变化,如体积变大、内部出现空泡,活性降低,表现为不易消化、贴壁情况不佳以及生长缓慢等。本试验采用改良的组织块培养法,在培养液中加入50 ng·mL-1EGF,可显著促进上皮细胞的优势生长,用0.25%胰蛋白酶进行2 ~3 次消化去除基质细胞可得到较高纯度的EECs,从第4 代细胞开始细胞体积变大,活性逐渐下降,这可能与胰蛋白酶的长时间作用有关。王伟[28]用0.25%胶原酶Ⅰ在37℃水浴消化奶牛子宫上皮组织3 ~4 h,得到纯度98%的EECs;马欣等[19]用0.1%胶原酶Ⅰ在37℃消化绵羊子宫上皮组织6 h,得到纯度70%的EECs。本试验采用0.2%胶原酶Ⅰ37℃震荡水浴消化6 h,依次过100、200、400 目细胞筛后可得到所需的EECs;同时用完全培养基反冲400 目细胞过滤筛后可得到纯度较高的EECs。为验证不同条件下上皮细胞的生长情况,本试验设置了无EGF 组和EGF 组,从原代细胞开始,EGF 组表现出更好的生长状态,细胞用0.25%胰蛋白酶利用差速消化法进行纯化,只需30 s 即可去除成纤维细胞、90 ~120 s 可使所有细胞变圆漂浮,培养时贴壁情况也较好,可在3~4 次将成纤维细胞以及其他杂细胞快速去除干净,经鉴定可获得纯度98%以上的EECs;而无EGF 组细胞则从第3 代开始细胞长势及活性快速下降,纯度也开始降低,细胞体积逐渐变大,细胞量逐步减少。EGF 组获得的细胞可传至6 代以上,可用于后续试验,这也为构建藏羊子宫内膜体外模型奠定了基础。
3.2 IL-1β、IL-6、IL-8 和TNF-α 的表达
研究发现,发生子宫内膜炎时,病原微生物入侵子宫腔,对子宫内膜的上皮屏障造成破坏,子宫内膜的组织结构发生相应变化,同时能够引起子宫组织对炎症细胞因子表达的变化[29]。IL-1β[10]、IL-6[12,30]、IL-8[15,31-33]、TNF-α[20]等作为炎性因子,在炎症反应中有着极其重要的作用,炎性因子表达水平的升高或降低与机体发生炎症反应的程度存在相互协同的关系,其表达量的高低决定了机体受损的程度。Loyi 等[34]研究发现,患子宫内膜炎的奶牛子宫组织中TNF-α、IL-1β、IL-6 的表达集体上调。Ghasemi 等[35]研究发现,在确诊为子宫内膜炎的奶牛子宫组织中IL-6 的表达上调约30 倍,TNF-α的表达上调约20 倍。王伟[28]在体外通过不同浓度E.coli以及S.aureus感染奶牛子宫内膜上皮细胞并建立奶牛子宫内膜炎病理模型后发现,TNF-α、IL-1β、IL-6、IL-8 的表达量也呈现上升趋势。郑强强[29]研究发现,在山羊子宫内注入E.coli后,TNF-α、IL-1β、IL-6 的表达量迅速上升,且对山羊子宫形成急性感染。在本试验中,经E.coli感染藏羊EECs 3 h 后,也能成功建立体外子宫内膜炎病例模型,随着MOI 的逐渐增加,细胞结构逐步遭到破坏,直至细胞大量死亡脱落。IL-1β、IL-6、IL-8 和TNF-α基因的mRNA 表达量与蛋白的表达量趋势基本一致,与上述研究结果相似,但当MOI 为1 ∶1时,TNF-α表达量显著提高,而MOI 为50 ∶1时却提高不显著,与其他因子的表达量不一致,有待进一步研究。接种E.coli不仅能够引起藏羊EECs 的局部感染以及形态变化,同时也能够引起藏羊EECs 对炎症细胞因子在基因和蛋白水平上表达的变化。因此,上述各炎症因子可作为识别藏羊子宫内膜炎病理程度的重要指标。
4 结论
本研究发现在培养液中加入50 ng·mL-1EGF 后成功用组织块贴壁法及酶消化法分离培养出藏羊EECs,且只有添加EGF 的酶消化法培养的藏羊EECs可正常传代,通过波形蛋白及角蛋白-18 免疫荧光鉴定,藏羊EECs 纯度达到98%以上,这为研究藏羊子宫内膜生殖生理机制提供了体外细胞模型。不同MOIE.coli感染下藏羊EECs 结构逐渐遭到破坏,MOI 越大,细胞坏死越严重。同时IL-1β、IL-6、IL-8 和TNF-α基因和蛋白表达量均较空白对照组明显升高。本研究结果为识别藏羊子宫内膜炎病理程度提供了参考指标。
