杏山梨醇脱氢酶基因克隆及其在果实发育过程中的表达与酶活性分析
2021-01-28聂佩显王来平韩雪平薛晓敏
聂佩显 王来平 韩雪平 路 超 薛晓敏
(山东省果树研究所,山东 泰安 271000)
山梨醇不仅是蔷薇科果树叶片光合作用的主要产物,而且还是韧皮部碳水化合物的主要运输物质[1-2],与植物的生长、果实品质与产量等密切相关[3],在响应生物胁迫和非生物胁迫过程中具有重要作用[4]。山梨醇在蔷薇科植物源叶中生成,经韧皮部运输卸载至库器官[1]。尽管韧皮部运输的山梨醇所占比例很高,但是多数蔷薇科植物的果实并不积累山梨醇[4-5]。很大一部分山梨醇通过韧皮部卸载进入果实后,在山梨醇脱氢酶(sorbitol dehydrogenase,SDH)和山梨醇氧化酶(sorbitol oxidase,SOX)的催化下转化为果糖和葡萄糖[3]。其中SDH 已被证明是蔷薇科植物果实转化山梨醇的最主要酶[5]。SDH 主要有两种:一种是依赖NAD+的山梨醇脱氢酶(NAD+-dependent sorbitol dehydrogenase,NAD+-SDH),其主要作用是催化山梨醇与果糖的相互转化;另一种是依赖NADP+的山梨醇脱氢酶(NADP+-dependent sorbitol dehydrogenase,NADP+-SDH),其主要作用是催化山梨醇与葡萄糖的相互转化[3]。NAD+-SDH 在催化山梨醇和果糖相互转化时,伴随着酶活性增强,果实中碳水化合物含量逐渐积累,并促进果实发育[3]。因此,NAD+-SDH 在调控“库”强过程中起着关键作用[5]。此外,基于拟南芥突变体的研究发现,SDH 能够调节植物体内多元醇的水平,进而影响植物对干旱胁迫的响应[6]。因此,研究SDH基因表达和酶活性变化的调控机制具有重要的意义。
Yamada 等[7]首先从苹果果实中克隆得到NAD+-SDH基因,通过原核表达研究证明该基因编码的蛋白具有NAD+-SDH 活性。目前已有在苹果[8]、梨[9]、桃[10]及枇杷[11]等蔷薇科植物中克隆该基因的报道。杏(Prunus armeniacaL.)作为蔷薇科李属的重要经济树种,起源于中国[12],现研究多集中在种质资源创新利用[13-15]、经济性状分析[16]、抗寒生理[17-19]等方面,鲜见有关杏NAD+-SDH 的相关研究。本研究选用同源克隆的方法从金太阳杏中分离得到NAD+-SDH基因,并结合生物信息学方法,初步分析其基因序列特征及编码蛋白结构特征,并研究其在杏果实发育过程中的表达特性及酶活性变化,旨在为进一步验证和解析杏NAD+-SDH基因的功能提供理论依据。
1 材料与方法
1.1 试验材料
供试材料金太阳杏取自山东省果树研究所苗圃(山东省泰安市,北纬36°11′,东经117°6′,海拔153 m)。选取生长相对一致的3 株8年生成年树,每棵树在4 个方位随机采取。果实自盛花后7 d 开始取样,每隔2 周取一次,直至商品成熟期,即在花后7、21、35、49 和56 d 采样,每次采样20 个果实,取果肉液氮速冻,-80℃保存备用。
1.2 RNA 提取和反转录cDNA
利用HiPure Plant RNA Maxi Kit (美基生物Magen,广州)试剂盒提取供试材料总RNA。cDNA 第一链的合成按5X All-In-One RT MasterMix(艾可莘生物科技有限公司,北京)反转录试剂盒说明书步骤进行,反转录得到的cDNA 于-20℃保存备用。
1.3 NAD+-SDH 基因的克隆
根据NCBI 登记的苹果、梨、桃等蔷薇科果树的NAD+-SDH基因序列,设计全长引物。
NAD+-SDH-F(5′-CACGGGGGACTCTAGAATGGGC AAGGGAGGGATGT-3′);
NAD+-SDH-R(5′-GACCACCCGGGGATCCCAAATT AAACATGACTTTTATGGCA-3′)。
以杏果实cDNA 为模板进行PCR 扩增。反应体系50 μL:模板1 μL,上下游引物(10 μmol·L-1)各1.5 μL,dNTP(2.5 mmol·L-1)4 μL,酶(2.5 U·μL-1)0.5 μL,5×buffer 10 μL,ddH2O 补足至50 μL。PCR 反应条件:94℃预变性2 min;98℃变性10 s,55℃退火5 s,72℃延伸100 s,35 个循环;72℃延伸5 min。利用1%琼脂糖凝胶电泳对扩增产物进行检测,使用美基生物公司(广州)凝胶回收试剂盒回收目的基因,回收目的产物连接到克隆载体pTOPO-Blunt 上,转化大肠杆菌DH52 感受态细胞,挑选阳性克隆,提取质粒进行测序(上海生工生物工程有限公司北京测序部)。
1.4 生物信息学分析
使用DNAMAN 软件对该基因编码蛋白进行氨基酸序列的分析,并将氨基酸序列提交NCBI,利用BLAST 进行序列比对,分析与其他物种的相似性及其功能保守结构域,利用MEGA-X 邻近法构建进化树,将自展循环次数(No.of Bootstrap Replications)设为1 000; 将目的氨基酸序列提交ExPASy 网站(https:/ /web.expasy.org/protparam)进行在线分析预测该蛋白的理化性质;在SOPMA 和Phyre2 网站对目的蛋白的二级结构和三级结构进行在线分析[20]。
1.5 NAD+-SDH 基因在杏果实发育过程中的表达分析
分别提取金太阳杏果实5 个发育时期的总RNA,反转录合成cDNA 备用。根据从金太阳杏中扩增的NAD+-SDH的开放阅读框架(open read frame,ORF)序列设计特异性实时荧光定量PCR(quantitative realtime PCR,RT-qPCR)引物,如下所示:
PaNAD+-SDH-F(5′-ACATTGTTCTTAGTGGTGGGT C-3′);
PaNAD+-SDH-R(5′-GCTCACATCTACTCCACCTTT C-3′)。
以Actin作为内参基因[21],如下所示:
ACTIN-F(5′-ACATTGTTCTTAGTGGTGGGTC-3′);
ACTIN-R(5′-AGATTCGTCATACTCTGCCTTT-3′)。
RT-qPCR 采用Trans Start Top Green qPCR Super Mix 荧光定量试剂盒(全式金生物技术有限公司,北京),使用20 μL 体系于7500 型PCR 仪(Applied Biosystems,美国)检测NAD+-SDH基因表达水平。反应程序:94℃预变性30 s;94℃变性5 s,58℃退火15 s,35 个循环。每样品重复3 次,采用2-ΔΔCt的方法分析相对表达量。
1.6 SDH 酶活性测定
NAD+-SDH 酶液的提取及活性测定参考梁东等[22]的方法,所有操作均在4℃下进行。
1.7 数据统计与分析
数据采用Microsoft Office Excel 2010 和SPSS 18.0软件进行统计分析。
2 结果与分析
2.1 PaNAD+-SDH 基因的克隆及序列分析
以金太阳杏果实cDNA 为模板,通过PCR 扩增,电泳后得到一条约1 100 bp 的单一条带(图1),与预期长度一致。测序结果显示,该扩增片段包含一个长度为1 104 bp 的ORF,编码367 个氨基酸(图2)。比对结果显示,该基因碱基序列与蔷薇科李属梅、桃和李的NAD+-SDH基因cDNA 序列相似性达98%以上,表明该基因为杏的NAD+-SDH基因,命名为PaSDH。
2.2 PaSDH 编码蛋白理化性质与结构的预测分析
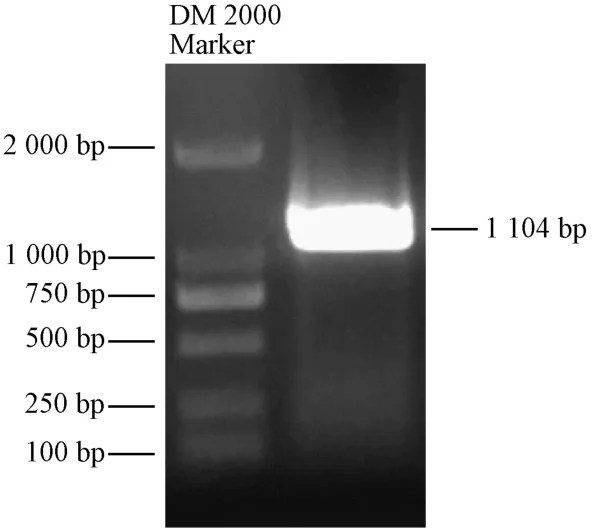
图1 NAD+-SDH 基因ORF 扩增Fig.1 The ORF amplification of NAD+-SDH gene
使用在线工具ExPASy 分析显示该基因编码蛋白的相对分子量为39.19 kDa,理论等电点为6.46,不稳定系数为25.34,属于稳定蛋白,其总平均亲水性为0.108,属于疏水性蛋白。InterProScan 分析表明,PaSDH 蛋白具有含锌乙醇脱氢酶特征,在序列中具有催化锌结合位点、结构锌结合位点和NAD 结合位点等功能位点(图2)。Signal IP3.0 预测PaSDH 蛋白氨基酸序列没有信号肽。利用SOPMA 对PaSDH 蛋白进行二级结构分析,其含有30.52%的α-螺旋、6.54%的β-转角、23.16%的延伸链和39.78%的无规则卷曲(图3)。利用Phyre2 对其三级结构预测,以c1pl6A 山梨醇脱氢酶的三维结构为模板,对349 个残基(95%的序列)建模,置信度为100%,结果如图4 所示。

图2 NAD+-SDH 基因的核苷酸序列及其编码氨基酸序列Fig.2 The nucleotide acid sequence and amino acid sequence of NAD+-SDH gene
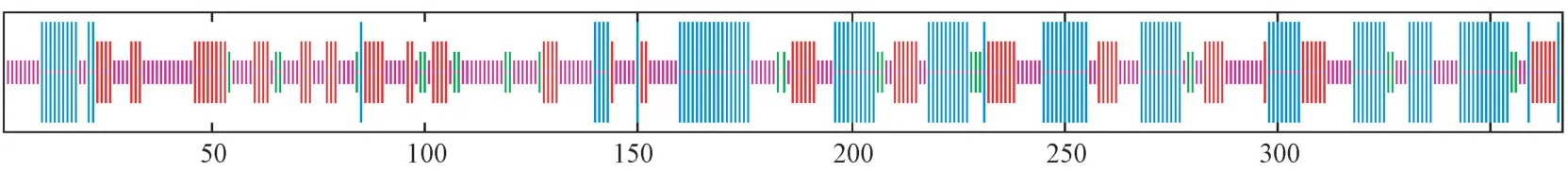
图3 PaSDH 基因编码蛋白的二级结构Fig.3 The secondary structure prediction of PaSDH gene encoding protein
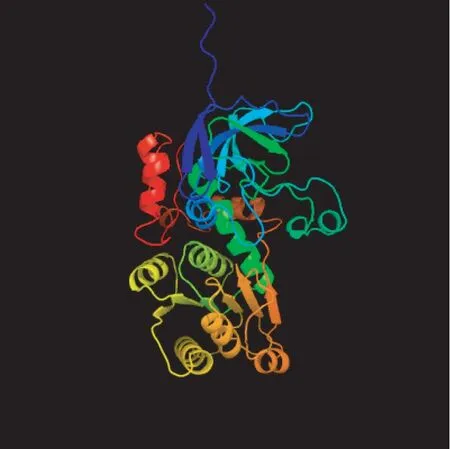
图4 PaSDH 基因编码蛋白的三级结构预测Fig.4 Tertiary structure prediction of the PaSDH
2.3 PaSDH 氨基酸多序列比对及系统进化树构建
将PaSDH 氨基酸序列与GeneBank 中登录的蔷薇科植物NAD+-SDH 氨基酸序列进行同源性比较,采用MEGA-X 软件中的邻接法构建进化树(图5)。从系统进化关系来看,杏PaSDH 氨基酸序列与蔷薇科李属植物梅(Prunus mume,XP _008234305.1)、桃(Prunus persica,XP _ 007218159.1)、 李(Prunus salicina,ACL18054.1 )、 甜 樱 桃 (Prunus avium,XP _021826929.1)、酸樱桃(Prunus cerasus,AAK71492.1)和日本樱花(Prunus yedoensis,PQM34387.1)的NAD+-SDH 氨基酸序列相似性较高,分别为99.46%、98.91%、98.64%、97.82%、96.20%和94.55%,首先聚为一类。
2.4 杏果实发育过程中的SDH 酶活性变化和PaSDH 基因的表达分析
分别在杏果实花后7、21、35、49 和56 d 测定SDH酶活性(图6),结果表明,在杏果实发育过程中,SDH酶活性呈现“高-低-高-低”的变化趋势,花后7 d,果实中SDH 酶活性最高,花后21 d,SDH 酶活性显著降低,在花后35 d,SDH 酶活性出现第二个小高峰,但明显低于花后7 d,之后SDH 酶活逐渐降低。
利用RT-qPCR 对PaSDH在杏果实花后7、21、35、49 和56 d 的相对表达量进行分析。结果表明,花后7 d,PaSDH表达量最高,之后随着果实的发育成熟,PaSH相对表达量逐渐降低,至花后56 d 时,PaSDH相对表达量最低。
3 讨论
NAD+-SDH 酶催化山梨醇和果糖之间的相互转化,其对果糖的米氏常数Km 值高于对山梨醇的Km值,表明该酶更利于向形成果糖的方向起催化作用,是蔷薇科植物中山梨醇代谢的关键酶[5]。植物通过山梨醇脱氢酶活性的变化调节山梨醇含量以抵御非生物胁迫(干旱胁迫、盐胁迫)[23]。本研究成功克隆了杏PaSDH基因的全长cDNA,该基因编码区长为1 104 bp,可编码367 个氨基酸。生物信息学分析发现PaSDH 蛋白具有含锌醇脱氢酶特征性氨基酸序列、结构锌结合位点和催化锌结合位点(图2),表明PaSDH编码的蛋白属于含锌乙醇脱氢酶家族。这与前人在苹果[24]和草莓[25]中的研究结果相似。本研究中,NAD+-SDH 进化分析表明,PaSDH编码氨基酸与梅NAD+-SDH 的氨基酸序列相似性最高,为99.46%,其与蔷薇科李属桃、李、甜樱桃、酸樱桃和日本樱花的SDH 氨基酸序列相似性较高,达到98.91%~94.55%,说明在蔷薇科植物中NAD+-SDH 的氨基酸序列是高度保守的。苹果和梨中NAD+-SDH基因以基因家族的形式存在,在苹果中已经分离得到超过10 个编码NAD+-SDH基因的全长cDNA[7-8,26],在梨中也克隆得到10 个编码NAD+-SDH基因片段[9,27]。本研究得到1个编码NAD+-SDH基因的全长cDNA,随着最新杏基因组的公布[12],还将对杏NAD+-SDH 家族其他成员进行深入探究。

图5 杏与其他蔷薇科植物NAD+-SDH 氨基酸序列的系统进化树Fig.5 Phylogenetic tree of NAD+-SDH from apricot and other Rosaceae species
通过RT-qPCR 研究杏果实发育过程中NAD+-SDH基因的表达,并检测了酶活性的变化模式。本研究发现在花后7 d 杏果实中NAD+-SDH 的酶活性及PaSDH基因的相对表达量最高。因此,认为可能在杏坐果和果实早期的发育阶段,PaSDH起着重要作用,这与梁东等[22]在苹果上的研究结果一致。前人在多种蔷薇科植物中对SDH 酶活性、蛋白与转录之间的关系进行了研究。Yamada 等[10,28]发现在苹果和桃果实生长过程中NAD+-SDH基因相对表达量和蛋白含量变化趋势与酶活性变化很相似,Li 等[29]发现枇杷果实中NAD+-SDH 活性、蛋白含量与转录量的积累密切相关,Kim等[30]在李果实中也发现相同现象。以上研究结果均说明NAD+-SDH基因转录水平的调控可能是调节其酶活性的关键步骤。与之不同的是,梨叶片中的NAD+-SDH 酶活性在幼叶中较高,而在成熟叶中较低,基因表达量与酶活性变化呈相反趋势[31];在苹果叶片和果实以及梨茎尖和花器官中,SDH 酶活性变化与基因表达模式也存在不一致的情况,说明SDH基因表达可能存在转录后调控机制。此外,这种不一致的情况也可能是基因家族成员共同作用的结果[32]。本研究中,随着杏果实的生长,NAD+-SDH 酶活性与基因相对表达量总体呈现下降趋势,这与杏果实成熟过程中果糖含量逐渐下降的变化趋势一致[16]。但在花后35 d,酶活性出现小幅度升高,此时基因的相对表达量却依然呈下降趋势,同样观察到酶活性与基因的转录水平的变化趋势并不完全一致的现象,很可能也是由PaSDH 酶活性变化与SDH 基因家族成员的表达模式不一致造成的,说明在杏果实发育早期NAD+-SDH 酶活性有可能受PaSDH基因转录的调控。此外,酶活性与基因转录水平变化趋势不完全一致说明可能还存在其他层次的调控机制。
4 结论
本研究克隆的杏PaSDH基因cDNA 全长1 104 bp,编码367 个氨基酸,蛋白质分子量为39.19 kDa。PaSDH基因相对表达水平和PaSDH 酶活性在杏果实发育早期最高,在果实成熟过程中呈总体下降趋势。但在花后35 d 存在酶活性和基因表达水平变化不一致的现象,说明可能存在SDH基因家族成员表达不一致的模式,或是存在除转录水平调控外的其他层次的调控机制。本研究为解析杏SDH基因表达模式及调控机制奠定了分子生物学基础。
