杜梨精氨酸脱羧酶基因PbADC的克隆与表达分析
2021-01-28郭巧会陈国栋孙小川王纪忠黄小三
靳 丛 郭巧会 陈国栋 孙小川 孙 敏 周 瑾 王纪忠 黄小三
(1淮阴工学院,江苏 淮安 223003; 2 南京农业大学园艺学院,江苏 南京 210095)
多胺(polyamines,PAs)是一类具有强生物活性的小分子量脂肪族含氮碱,广泛存在于生物体中。高等植物中常见的多胺有腐胺(putrescine,Put)、亚精胺(spermidine,Spd)和精胺(spermine,Spm),它们在植物生长发育和胁迫应答过程中发挥重要作用[1]。而植物体内PAs 含量变化与其合成途径中关键酶所编码基因的转录水平变化密切相关[2-3]。精氨酸脱羧酶(arginine decarboxylase,ADC)是植物在胁迫条件下形成多胺的第一个限速酶,可催化精氨酸生成Put,且此途径是高等真核生物中植物所特有的,因此ADC 所编码基因的结构和功能受到广泛关注[4-5]。据报道,ADC基因属于磷酸吡哆醛依赖性酶(pyridoxal 5’-phosphate decarboxylase,PLPDE)基因家族成员,具有家族典型的N 端Org_Arg_deC_N 结构域和底物识别信号,且保守的磷酸吡哆醛(pyridoxal 5’-phosphate,PLP)结合位点可催化精氨酸脱羧,从而参与PAs 生物合成途径[6]。
目前,已有多种植物ADC基因被克隆与表达分析,发现该基因在多个组织中表达,并响应不同非生物胁迫。据报道,水稻(Oryza sativa)OsADC1 和OsADC2在根、茎、叶和花序中均有表达,且受盐、干旱和低温胁迫诱导[7];桃树(Prunus perica)PpADC主要在茎、叶、花和果实中表达,并响应脱水、盐、低温和重金属胁迫[8]。从颠茄(Atropa belladonna)中分离的AbADC1和AbADC2 分别在须根和主根中表达量较高,呈现出较明显的组织表达特异性,且AbADC2 响应低温胁迫[9];金柑(Fortunella crassifolia)中的FcADC在转录因子FcWRKY70 的调控下通过调节Put 含量的升高,增强了转基因烟草和柠檬的抗旱性[10];枳(Poncirus trifoliata)PtADC基因通过清除活性氧和促进根系生长响应干旱胁迫[11];在莲藕(Lotus tenuis) 中过表达OatADC提高了盐胁迫下ADC基因的转录水平,并通过促进脯氨酸的合成及平衡Na+/K+增强了耐盐性[12]。这些研究结果表明,ADC基因在植物抵御非生物胁迫过程中发挥着重要作用。
杜梨(Pyrus betulifolia)广泛分布于我国北方地区,具有较强耐低温、高温、干旱和盐碱的能力,且与栽培品种嫁接亲和力强,成为应用最广的梨砧木,是进行梨抗逆育种和基因克隆的理想材料[13-15]。本试验以杜梨为研究材料,通过反转录 PCR ( reverse transcription PCR,RT-PCR)技术克隆杜梨PbADC基因全长,利用生物信息学软件进行核苷酸和氨基酸的序列分析,结合荧光定量PCR 等方法研究PbADC基因的组织表达和对非生物胁迫的响应模式,旨在为深入探讨PbADC基因功能和抗逆机理奠定基础。
1 材料与方法
1.1 试验材料
选取长势健康、一致的60 d 杜梨幼苗,分别对其进行低温、脱水、盐和过氧化氢的非生物胁迫处理,每个处理至少60 株幼苗,叶片随机取样。
1.2 胁迫处理试验
低温处理,将幼苗置于4℃的人工气候室,并在0、6、12、24 和48 h 进行采样。脱水处理,将幼苗从土中不伤根取出,并在清洗干净根部后,放入装有蒸馏水的烧杯中,置于温度25℃,光周期16 h 光照/8 h 黑暗交替的培养箱中培养36 h,将预培养的幼苗放在滤纸上进行脱水处理,分别在0、0.5、1、3 和6 h 进行采样。盐和过氧化氢处理,分别将上述预培养的幼苗置入200 mmol·L-1氯化钠(NaCl)溶液和2% H2O2溶液中,采样时间点为处理后0、6、12、24 和48 h。每个处理所采样品迅速进行液氮速冻,-80℃保存备用。
1.3 PbADC 基因及启动子克隆
从梨基因组数据库(http:/ /peargenome.njau.edu.cn/)获得精氨酸脱羧酶基因ADC的基因序列,命名为PbADC,并选择PbADC基因转录起始位点上游2 000 bp 左右启动子片段,利用Primer 5.0 设计基因克隆引物PbADC-F(A T G C C G G C C C T G G C T T G T TG)和PbADC-R(AGCACAGCAATAAGACCACTGT)及启动子克隆引物PbADC-Pro-F(TCACATAACGTAAAG TGATAAATGG)和PbADC-Pro-R(AAGGGATTAGG GTTGGGC)。分别以杜梨叶片cDNA 和DNA 为模板扩增基因和启动子全长,PCR 反应程序均为:98℃预变性30 s;98℃变性10 s,66℃退火30 s,72℃延伸2 min,35 个循环;最后72℃延伸10 min。经1.2%琼脂糖凝胶电泳后分别产生单一条带的特异PCR 产物,胶回收后将回收产物与pMD 18-T(大连TaKaRa 生物工程公司)进行连接反应,连接产物转化大肠杆菌DH5α感受态细胞(南京擎科生物科技有限公司),在含有100 mg·L-1的LB/Amp 固体培养基上进行筛选,挑选阳性克隆测序。
1.4 序列分析
利用软件ProtParam 分析PbADC 蛋白的相对分子量和等电点,用软件Softberry 分析亚细胞定位[16];利用软件Plantcare 分析启动子顺式作用元件,软件Signal P 预测蛋白信号肽[17];分别应用软件SOPMA和SWISS-MODEL 预测PbADC 蛋白二级和三级结构[18];利用软件NetPhos 3.1 Server 和DictyOGlyc 1.1 Server 分析蛋白质修饰方式[19];利用NCBI 数据库中的BLAST 检索PbADC 蛋白的同源序列,并使用软件MEGA 6.0 的最大似然法(maximum likelihood,ML)进行进化树的构建;利用软件MEGA 6.0 和Genedoc 进行多序列比对分析;利用软件Pfam 进行蛋白功能结构域分析[20]。
1.5 PbADC 基因表达特性分析
基于完成测序的PbADC基因序列,设计特异性表达引物PbADC-QF(GTATGCCTCCGCAGTTGTC)和PbADC-QR(GGTTCAGGTAATCGGCACG)进行基因组织表达及在多种非生物胁迫下的表达模式分析,内参基因引物为PbTublin-F(TGGGCTTTGCTCCTCTT AC)和PbTublin-R(CCTTCGTGCTCATCTTACC)[21]。利用LightCycler 480 荧光定量PCR 仪(Roche,美国)进行PbADC基因表达特性分析,反应程序为:95℃预变性5 min;94℃变性10 s,60℃退火30 s,72℃延伸30 s,45 个循环;最后72℃延伸3 min。每个样品的检测平行重复3 次,采用2-ΔΔCt法[22]进行定量数据计算。
1.6 数据分析
所有数据利用Microsoft Office Excel 2016 和SPSS 18.0 软件进行统计分析,并采用Duncan 法进行差异显著性分析(P<0.05);应用Origin 9.0 软件对数据进行整理并作图。
2 结果与分析
2.1 PbADC 基因的克隆与序列分析
以杜梨叶片cDNA 为模板,利用特异性克隆引物扩增出目的片段,测序结果证明该片段与目的基因保持一致。PbADC开放性阅读框(open reading frame,ORF)全长为2 190 bp,编码730 个氨基酸(图1)。

图1 杜梨PbADC 基因核苷酸序列及其编码的氨酸酸序列Fig.1 cDNA and predicted protein sequence of PbADC gene form Pyrus betulifolia
PbADC启动子顺式作用元件的预测结果显示,除具备启动子核心启动元件TATA-box 和CAAT-motif外,还存在多种非生物胁迫响应相关顺式作用元件,主要有厌氧响应元件(cis-acting regulatory element essential for the anaerobic induction,ARE),盐响应元件(MYB binding site in drought-inducibility,MBS),低温响应元件(cir-acting element involved in low-tempreture responsiveness,LTR),干旱响应元件(inducer,injury and pathogen responses combined with WRKY trascription factors,W-box) 和 胁 迫 响 应 元 件(stress response element,STRE)等[23],暗示PbADC可能在植物防御非生物胁迫过程中发挥一定作用。
2.2 PbADC 蛋白序列与生物活性分析
预测PbADC 蛋白质分子量约为78.53 kDa,理论等电点为5.23,不稳定指数为42.64,亲水性系数为-0.044,表明其是不稳定亲水性蛋白;信号肽分析结果表明,PbADC 不存在信号肽序列,属于非分泌型蛋白;亚细胞定位的预测结果表明,PbADC 主要定位于细胞质中。蛋白二级结构预测结果显示,PbADC 蛋白含有44.38%的α-螺旋,14.79%的延伸链,6.44%的β-转角和34.38%的无规卷曲。利用SWISS-MODEL 软件中的ADC 蛋白模板(PDB ID:3nzq.1.A)对PbADC 进行蛋白三级结构分析(图2),所构建模型与模板的序列覆盖率达84%,氨基酸序列覆盖范围为53~684 位。
磷酸化和糖基化是常见的蛋白修饰方式,可能会影响蛋白的结构与功能。PbADC 蛋白磷酸化分析结果显示,该蛋白有66 个磷酸化位点超过可能性临界值,其中丝氨酸、苏氨酸和酪氨酸磷酸化位点数量分别为44、12 和10 个,并在氨基酸序列范围350 ~430 和610~720 部分出现较为密集的磷酸化位点分布(图3)。糖基化预测分析PbADC 蛋白不存在糖基化位点。
2.3 PbADC 的氨酸酸序列同源性和进化树分析
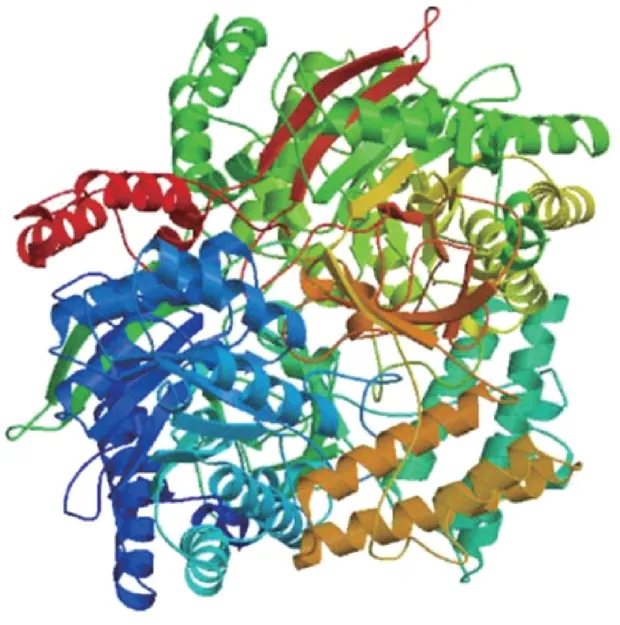
图2 PbADC 蛋白的三级结构预测Fig.2 The predicted three-dimensional structure of PbADC protein

图3 PbADC 蛋白氨酸酸序列翻译后磷酸化修饰位点预测Fig.3 Prediction of phosphorylation site in amino acid sequence of PbADC protein
将PbADC与拟南芥(Arabidopsis thaliana,AAB09723)AtADC、枳(Poncirus trifoliata,AEE99192)PtADC、石榴(Punica granatum,XP _ 031390051)PgADC、枣(Ziziphus jujuba,XP_015892431)ZjADC、甜樱桃(Prunus avium,XP_021806331) PaADC、桃(Prunus persica,BAG68575) PpADC 和苹果(Malus domestica,BAD74163)MdADC 进行序列同源性分析,结果显示氨基酸序列相似性分别为68.70%、72.46%、77.15%、77.93%、89.73%、90.14%和92.47%,表明PbADC 的氨基酸序列与这7 个物种具有较高同源性,包含完整的Orn_Arg_deC_N(PF02784)结构域,并在第329~第345 残基发现精氨酸脱羧酶基因家族典型的底物识别信号结构域,同时拥有保守的氨基端的赖氨酸(K)和羧基端的半胱氨酸(C)这两个重要的酶活位点,且赖氨酸(K)残基可能是PLP 的磷酸基结合位点(图4)。
系统进化分析显示,杜梨PbADC 与同为蔷薇科的苹果MdADC、甜樱桃PaADC 和桃PpADC 聚为一类,亲缘关系最近;与枣ZjADC、川桑MnADC 和杨梅MrADC 的亲缘关系较近;与番木瓜CpADC、山茶CsADC 和拟南芥AtADC 等的亲缘关系较远(图5)。
2.4 PbADC 基因的组织表达和非生物胁迫诱导表达分析
利用荧光定量PCR 技术对PbADC基因在杜梨根、茎和叶中的表达情况进行检测(图6),结果表明,该基因在茎、根和叶中均有表达,其中在叶中表达量最高,根次之,茎中最低,呈现显著的组织表达特异性。
由图7 可知,PbADC基因的转录水平受低温(4℃)、脱水、盐胁迫(200 mmol·L-1NaCl)和过氧化氢(2% H2O2)诱导。低温处理过程中,PbADC的相对表达量持续升高,处理48 h 时相对表达量增加至CK 的12 倍;在脱水处理1 h 内,PbADC的相对表达水平持续升高,之后相对表达水平开始下降;盐胁迫与H2O2处理的基因表达结果相似,都是在处理后12 h 时,PbADC的相对表达量最高,之后逐渐下降,但处理48 h 时的相对表达量仍高于CK。
3 讨论
PAs 作为一种新型植物生长调节剂或“第二信使”,参与植物衰老、成花、胚胎形成、果实成熟与逆境响应等生理代谢活动[24]。ADC 是PAs 生物合成途径中的关键限速酶,通常在胁迫条件下调节PAs 的含量变化。尽管已有多个ADC基因被分离,但不同物种中ADC基因的组织表达模式和非生物胁迫下的响应水平存在差异,鉴定不同植物的ADC基因将为研究该基因功能和应用奠定基础。
本研究克隆了杜梨PbADC基因,ORF 全长2 190 bp,编码730 个氨基酸,含有66 个磷酸化位点,高于茶树CsADC 蛋白中的磷酸化位点数目,表明PbADC 可能在磷酸化蛋白调控过程中发挥更丰富的作用[25]。在PbADC启动子序列中预测到的LTR 和STRE 等多种胁迫响应相关的顺式作用元件也存在于响应低温胁迫的AtADC1 启动子中[26],表明PbADC可能参与低温响应;金柑转录因子FcWRKY70 通过特异性结合FcADC启动子上的顺式作用元件W-box,提高了ADC基因在脱水胁迫下的表达水平[10];顺式作用元件主要参与基因的表达调控,PbADC启动子中含有上述顺式作用元件,表明其与这些同源基因可能响应相似的非生物胁迫。
本研究中,蛋白序列分析显示PbADC 含有家族保守的2-磷酸吡哆醛结合位点、PLP 磷酸基结合位点和底物识别信号,与进行比对的多个ADC 同源蛋白一致,这些是鉴定磷酸吡哆醛依赖性酶(pyridoxal 5′-phosphate decarboxylase,PLPDE)家族Ⅲ型PLPDE 亚家族成员的关键结构域,也是ADC基因行使功能的主要基序[27]。杜梨为蔷薇科植物,本研究中系统进化分析显示,PbADC 与蔷薇科的苹果MdADC、甜樱桃PaADC 和桃PpADC 处于同一进化分支上,与枣ZjADC、川桑MnADC 和杨梅MrADC 等果树的亲缘关系也较近,表明ADC基因在进化过程中保守性较高。

图5 PbADC 与部分物种ADC 蛋白的系统进化树Fig.5 Phylogenetic tree of PbADC and ADC proteins from other species
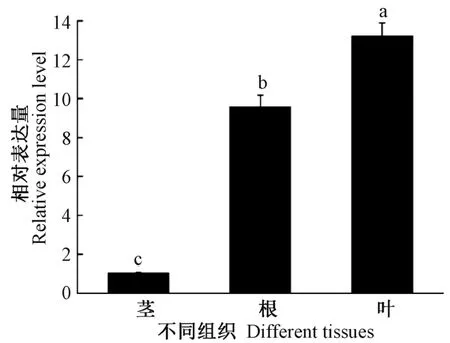
图6 不同组织中PbADC 基因的表达水平Fig.6 Expression levels of PbADC gene in different tissues
ADC基因分布于植物的多个组织中,不同植物的同源基因呈现明显的组织表达特异性。本研究中的杜梨PbADC基因在叶、根和茎中都有表达,其中,在叶中的相对表达量最高,茎中的相对表达量最低。同样在棉花中,GhADC1 基因在叶、茎和根部等组织中都有表达,而叶中基因的相对表达量最高[27];芒果MiADC基因也被检测到在根、茎、叶和花等组织中有表达,但在茎中的表达量高于叶中的表达量[28];而橡胶树HbADC1 基因在叶、雌花、雄花和树皮等组织中都进行高量表达[29]。这种同源基因间表现出不同的组织表达差异可能与其参与的主要生理功能相关,也可能与PAs 的区域化分布及物种特异性有联系。研究表明,多种植物ADC基因的转录水平受非生物胁迫诱导,调控腐胺含量变化,影响植物抗逆能力。ADC 蛋白通过与枳ICE1 相互作用调节PAs 水平提高抗寒性[30];过表达AtADC2 的拟南芥具有较高的Put 含量,降低了体内H2O2的水平,增强了耐盐性[31];橡胶树HbADC1 以不同表达模式响应低温、干旱、高盐和H2O2胁迫[29];苹果MdADC的转录水平与Put 含量呈正相关,且受低温、脱水和盐胁迫的诱导[32]; 枳转录抑制因子PtrNAC72 反向调控PtADC的表达,抑制了Put 的合成,提高了PtrNAC72 过表达株系对干旱胁迫的敏感性[33]。本研究中,杜梨PbADC参与了对低温、脱水、盐和H2O2的应答,表明该基因可能在杜梨响应非生物胁迫过程中发挥重要作用。但杜梨PbADC基因抵御非生物胁迫的分子机制及不同条件下如何调控PAs的代谢,还有待进一步深入研究。
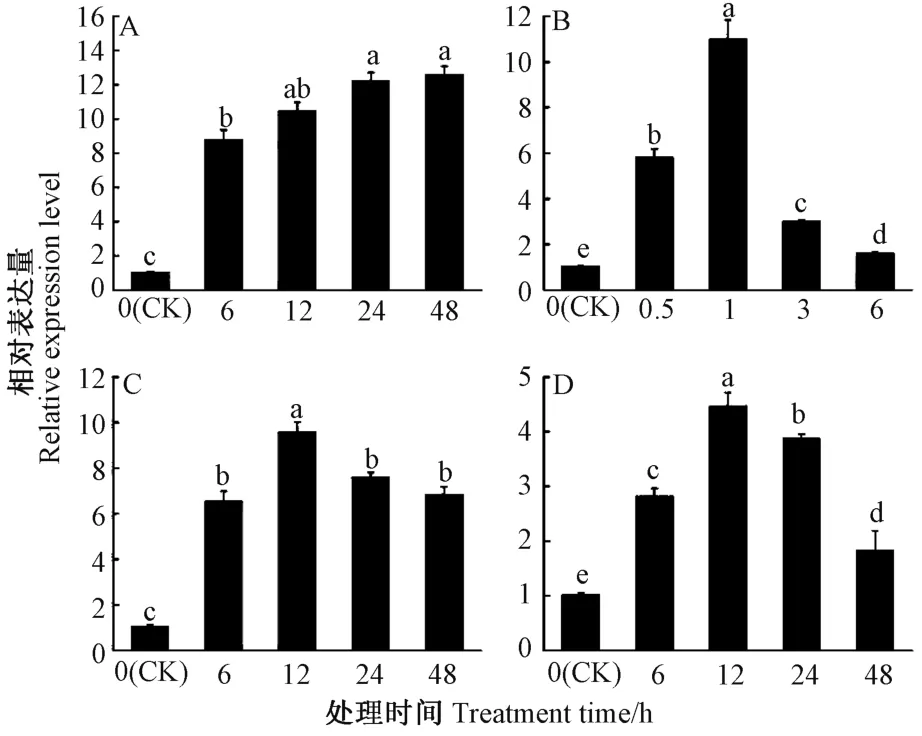
图7 不同非生物胁迫诱导下杜梨PbADC 的相对表达模式Fig.7 Relative expression pattern of the PbADC gene under different abiotic stresses in Pyrus betulifolia
4 结论
本研究从杜梨中克隆得到精氨酸脱羧酶基因PbADC,序列分析证明该蛋白属于磷酸吡哆醛依赖性酶(PLPDE)家族Ⅲ型PLPDE 亚家族成员,与蔷薇科的苹果、甜樱桃和桃中的ADC 蛋白聚为一类,在杜梨叶中的表达水平最高,根次之,茎中的相对表达量最低,呈现显著的组织表达特异性,受低温、脱水、盐和H2O2等逆境胁迫诱导,说明可能参与杜梨抵御非生物胁迫的过程。本研究结果为探讨PbADC的基因功能和作用机制奠定了基础,也为梨抗逆育种提供了思路和方向。
