内生湿热证人群的肠道菌群特点研究
2021-01-28张心怡金黑鹰张春霞叶晓瑞刘建磊
王 灿,张心怡,金黑鹰,张春霞,王 俊,叶晓瑞,杨 阳,刘建磊
(南京中医药大学第二附属医院(江苏省第二中医院),江苏 南京 210017)
湿热证是指由湿热病邪引起的诸多病证的总称,在代谢综合征[1]、炎症性肠病[2]、肠道肿瘤[3]等疾病中均可见,正如《格致余论生气通天论病因章句辩》云:“六气之中,湿热为病十居八九。”饮食不节和南方多湿热的气候特点是内生湿热证的主要病因,如《素问奇病论》曰:“肥者令人内热,甘者令人中满。”《素问异法方宜论》曰:“南方者,天地所长养,阳之所盛处也,其地下,水土弱,雾露之所聚也……”尤其现代饮食结构改变、高脂高热量饮食增多,内生湿热证的发病率不断上升,又因其病变范围广、病势缠绵难愈、反复发作,一直是历代医家的研究热点。研究发现脂代谢异常、肥胖、便秘等疾病的发生发展与肠道菌群紊乱密切相关[6-7],通过调整肠道菌群防治疾病已成为新的医疗手段。故本课题组拟通过16S rDNA高通量测序技术检测内生湿热证人群与健康人群的肠道菌群,分析内生湿热证患者菌群组成及结构的变化,从肠道菌群的角度探讨内生湿热证的发病机制,为防治内生湿热证提供新的途径。
1 资料与方法
1.1一般资料 选取2019年4—9月在江苏省第二中医院门诊就诊及住院的证属内生湿热的24例患者作为湿热组,其中男9例,女15例;年龄(37.3±11.7)岁;高血脂症16例,单纯寻常型痤疮2例,单纯慢性功能性便秘4例,克罗恩病2例,寻常型痤疮合并高血脂症3例,慢性功能性便秘合并高血脂症3例。另外选择同期查体健康的8~14岁男童20例作为对照组,均接受血尿粪常规、生化、传染病检查及筛查肠道致病菌,并尽可能排除影响肠道菌群的因素。本研究符合医学伦理要求并通过医院伦理委员会审核批准(20180801),所有入选者均对研究知情同意。
1.2诊断标准 参照《9种基本中医体质类型的分类及其诊断表述依据》[8]中湿热体质的相关内容及《中医诊断学》中内生湿热证的相关表现拟定:①形体特征为偏胖;②常见表现为面垢油光,易生痤疮,口苦口干或口中黏腻,身重困倦,大便燥结或黏滞不爽,小便短赤,男易阴囊潮湿,女易带下量多色黄,舌苔黄腻,脉滑数;③心理倾向为急躁易怒;④对潮湿及高温环境反应敏感。
1.316S rDNA测序方法 参照文献[9]方法进行测序:收集研究对象检查当日的大便,低温(0 ℃)运送至美格基因进行粪便DNA的提取及16Sr DNA检测。16S rDNA扩增选择区域为V3~V4区,扩增引物为341F:CCTACGGGNGGCWGCAG,805R:GACTACHVGGGTATCTAATCC。所有样本均使用 Illumina MiSeq 平台进行测序,测序得到的原始数据以双端(PE300) FASTQ格式保存。在0.97相似度下利用QIIME2(2019.04)软件进行OTUs(Operational Taxonomic Units)聚类和物种注释,将获得的代表性序列与GreenGene138数据库对比,物种丰度组成图分别根据物种分类单元的界、门、纲、目、科、属水平对每个样本进行计数。使用QIIME2软件(2019.04)、STAMP软件(2.1.3)、Lefse(http://huttenhower.sph.harvard.edu/galaxy/)对测序结果进行Alpha多样性、Beta多样性、肠道菌群构成差异性分析等一系列的综合性分析及处理。
1.4统计学方法 采用SPSS 23.0软件进行数据统计分析。计量资料符合正态分布采用均数±标准差表示,组间比较采用两独立样本t检验;不符合正态分布采用中位数(上四分位数,下四分位数)表示,组间比较采用Kruskal Wallis检验。P<0.05为差异有统计学意义。
2 结 果
2.1Alpha多样性 湿热组的Shannon指数、Evenness指数均明显低于对照组(P=0.028,0.024)。见图1和图2。
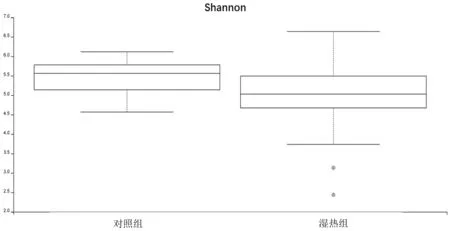
图1 2组Shannon指数比较
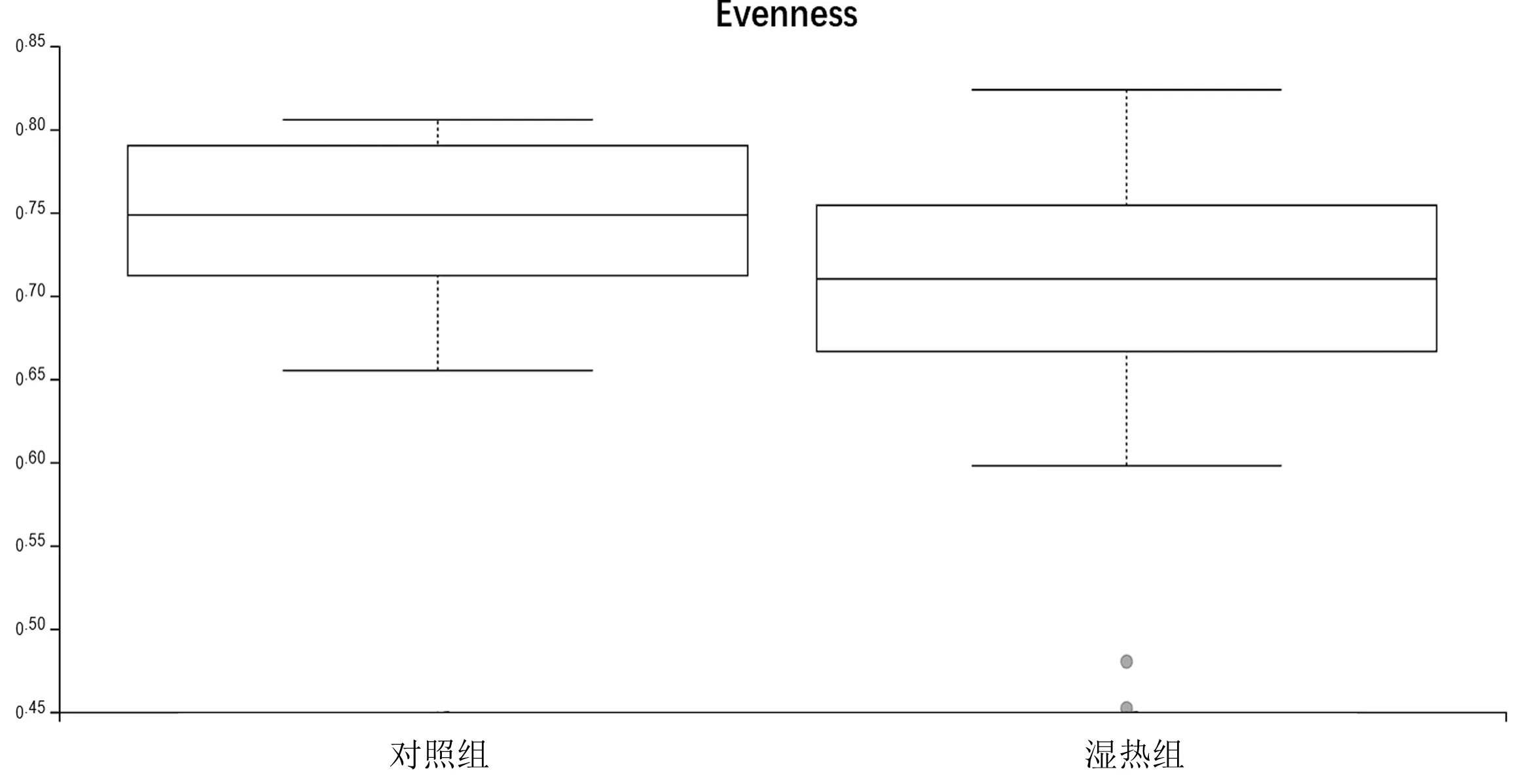
图2 2组Evenness指数比较
2.2Beta多样性 基于Bray-Curtis算法和Jaccard算法的主成分分析图可见,2组样本点明显分开,2组的肠道菌群结构相差较大,比较差异有统计学意义(P=0.001,0.001)。见图3和图4。
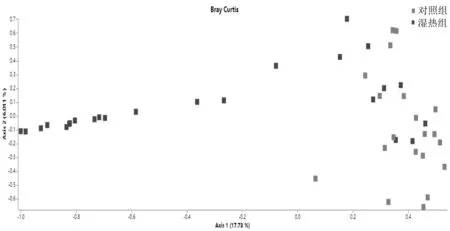
图3 基于Bray-Curtis构建的PCoA图

图4 基于Jaccard构建的PCoA图
2.3肠道菌群构成及差异性分析
2.3.1门分类水平 2组肠道菌门细菌丰度及菌群结构均无明显改变,见图5;前6类优势菌门为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、疣微菌门(Verrucomicrobia),见图6。湿热组拟杆菌门、放线菌门、梭杆菌门、厚壁菌门、变形菌门的相对丰度与对照组比较差异均无统计学意义(P均>0.05),拟杆菌门/厚壁菌门相对丰度比值呈下降趋势,疣微菌门的相对丰度明显低于对照组(P=0.000 5),见表1。
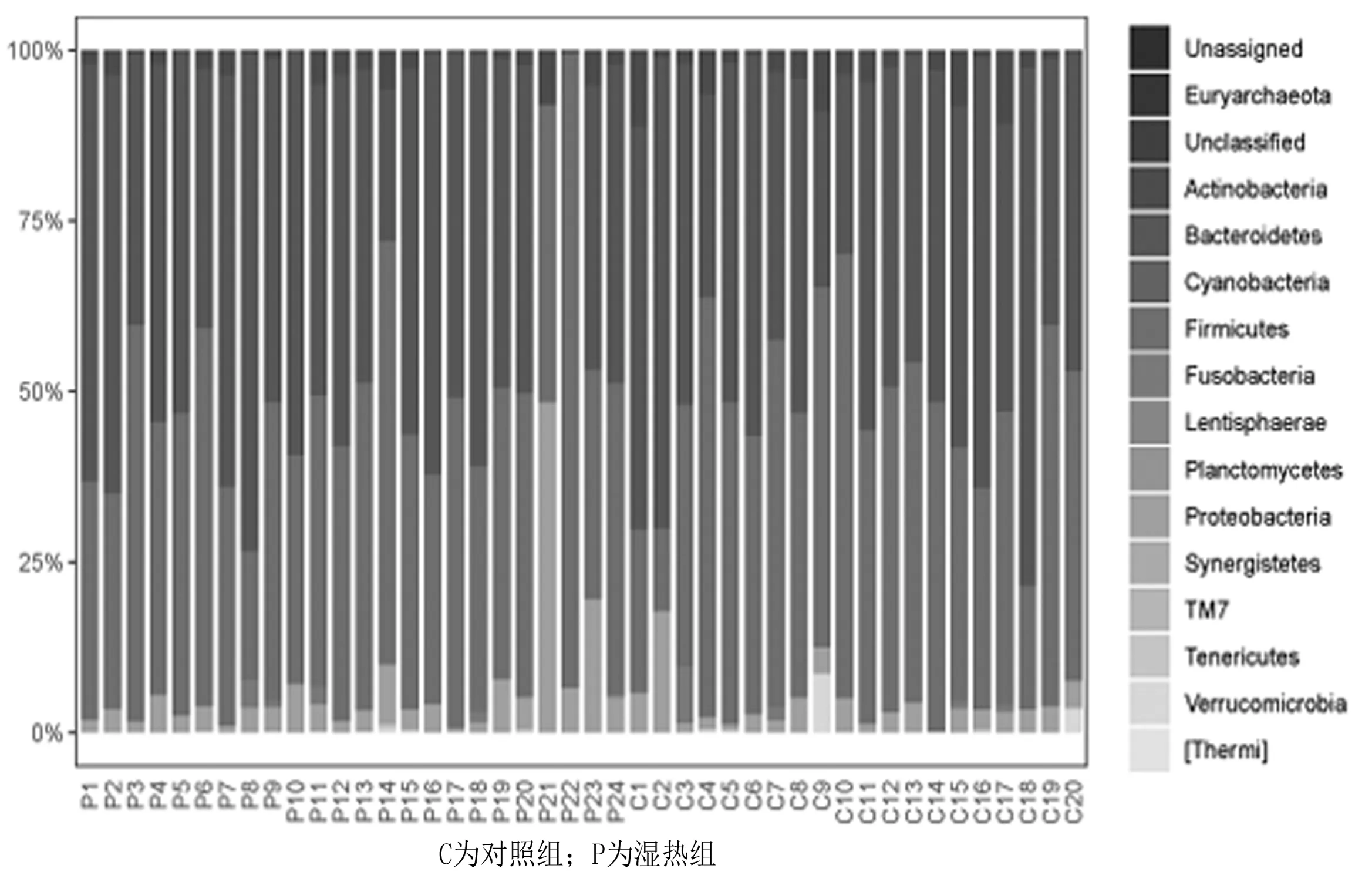
图5 2组细菌门分类水平的肠道菌群组成图
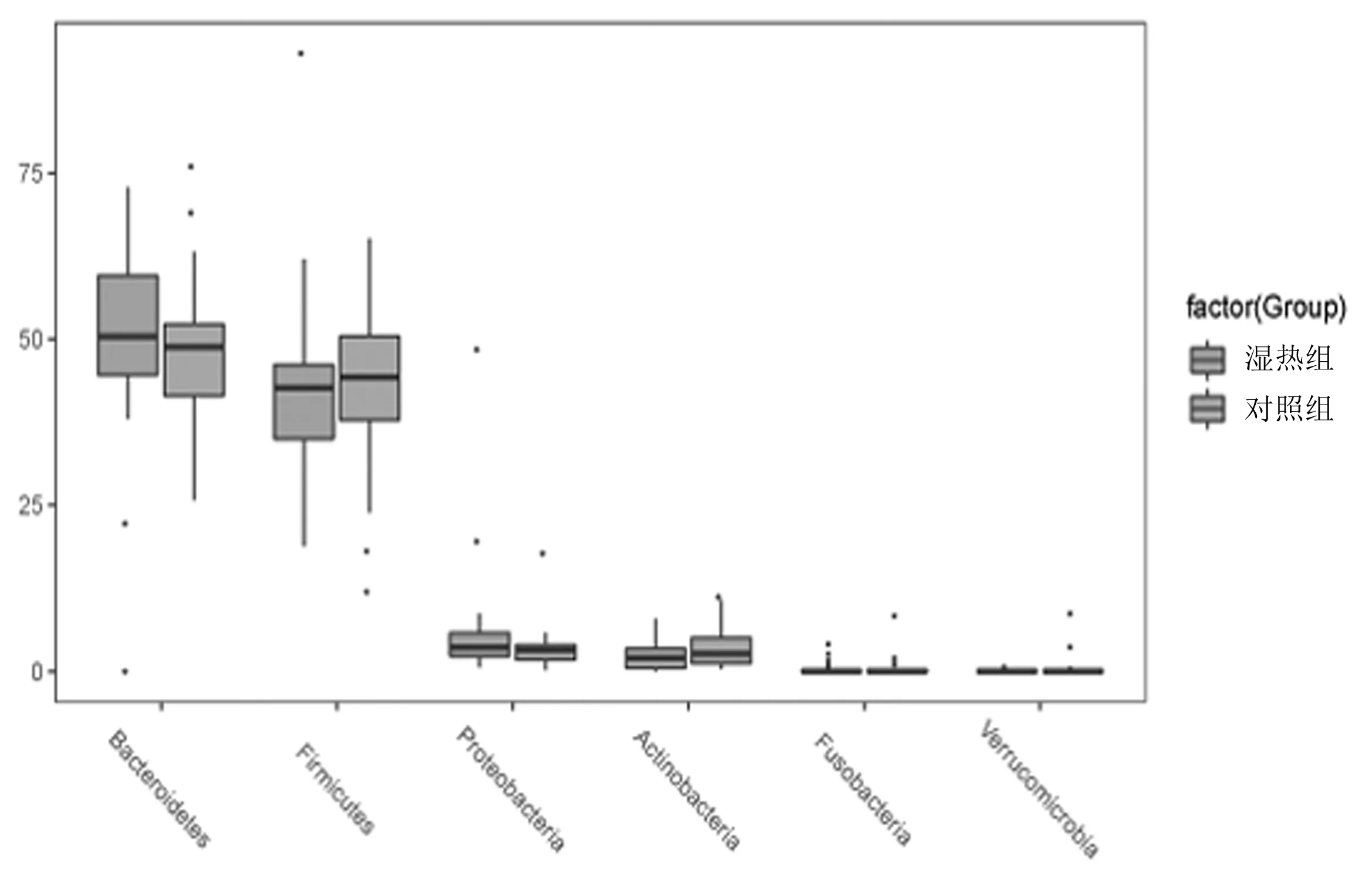
图6 2组前6类优势菌门箱型图
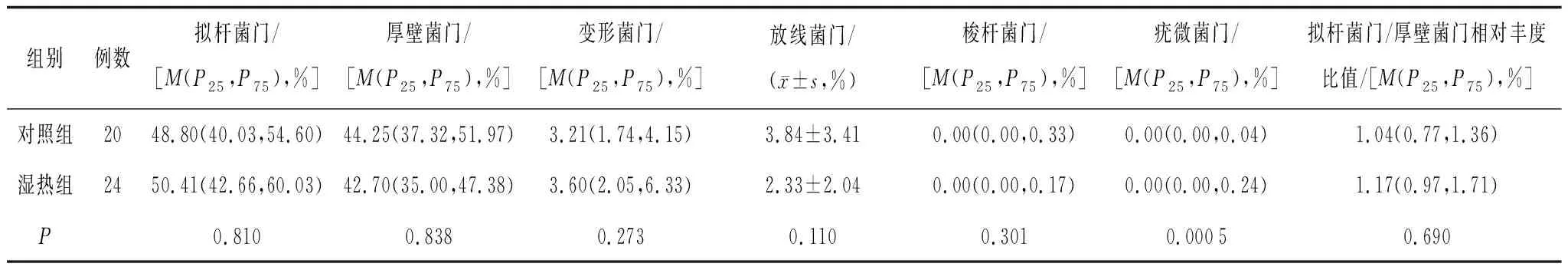
表1 2组细菌门分类的相对丰度比较
2.3.2属分类水平 2组差异性菌属有9种,物种组成见图7。湿热组中布劳特氏菌属(Blautia)、迟缓埃格特菌(Eggerthella)的相对丰度明显高于对照组(P均<0.05),瘤胃球菌属(Ruminococcus)、双歧杆菌属(Bifidobacterium)、Alistipes、颤螺菌属(Oscillospira)、Odoribacter、Anaerostipes、无色杆菌属(Ach-romobacter)的相对丰度明显低于对照组(P均<0.05),见表2。LEfSe分析提示湿热组的差异性菌群有6类,主要分布在红蝽菌目(Coriobacteriales)、布劳特氏菌属(Blautia)、迟缓埃格特菌属(Eggerthella);对照组主要分布在放线菌纲(Actinobacteria)、红蝽菌纲(Coriobacteriia)、假单胞菌目(Pseudomonadales)、鞘脂单胞菌目(Sphingomonadales)、根瘤菌目(Rhizobiales)、瘤胃球菌科(Ruminococcaceae)、芽胞杆菌目(Bacillus),见图8及图9。
图7 2组细菌属分类水平的肠道菌群组成图
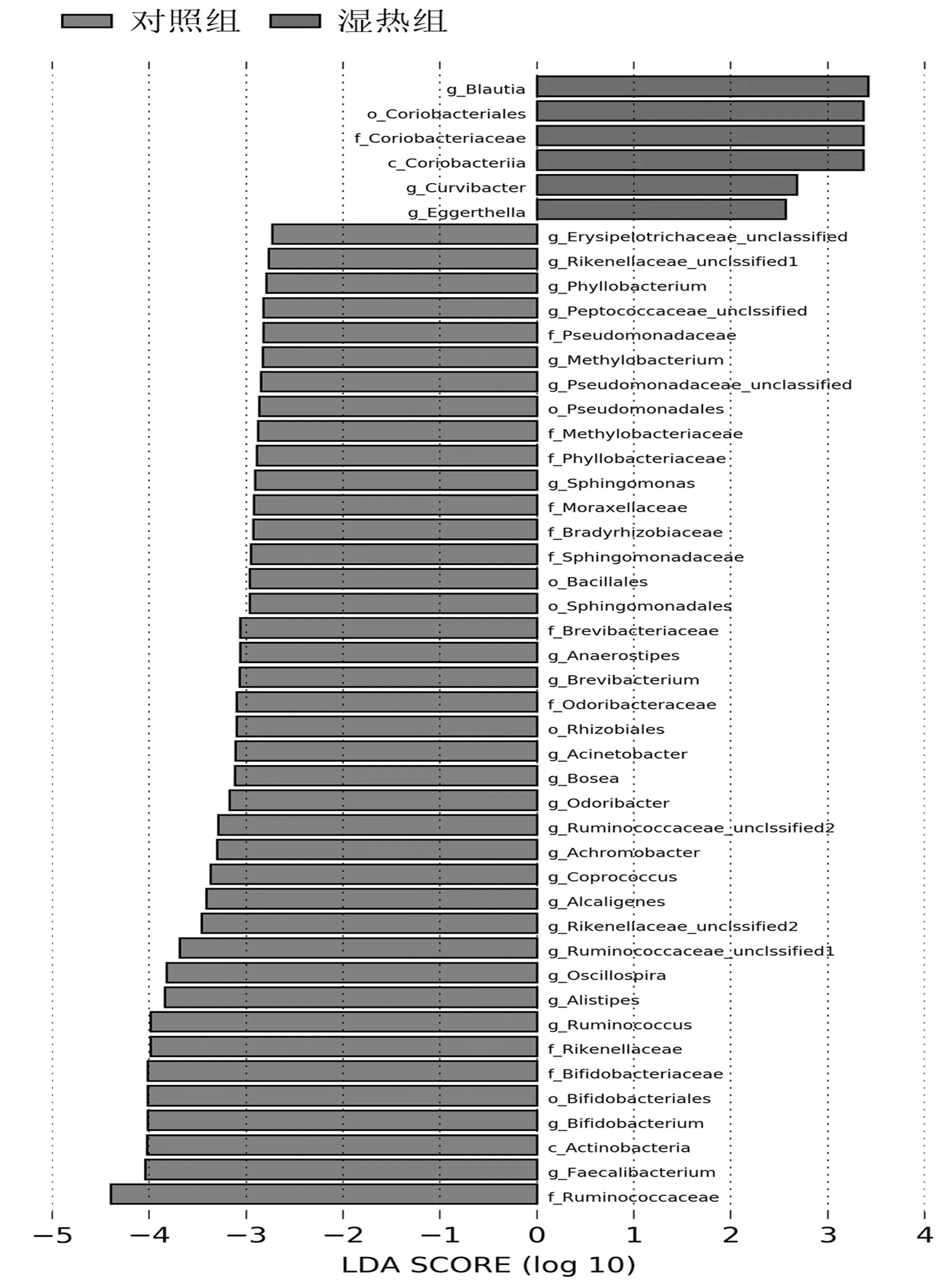
图8 2组LEfSe组成图
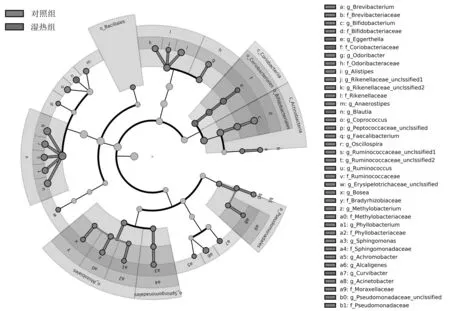
图9 2组物种进化图(门到属水平)
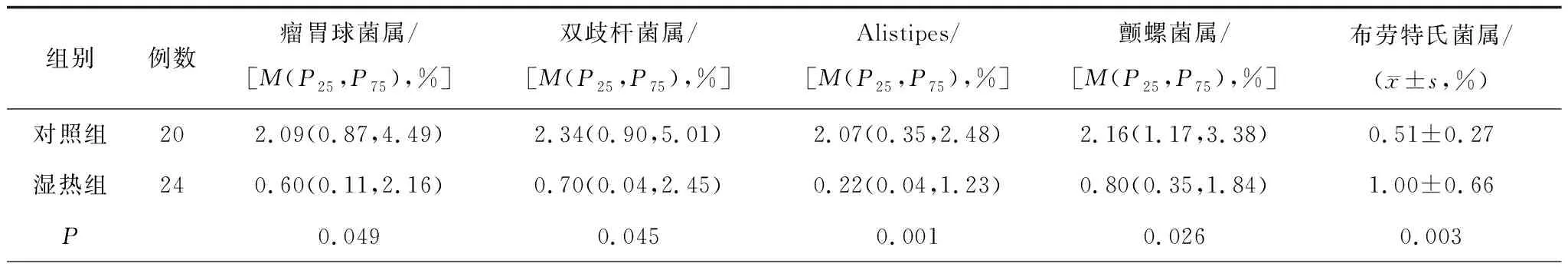
表2 2组细菌属分类的相对丰度比较
3 讨 论
本研究发现湿热组Alpha多样性指数明显低于对照组,提示人体的内生湿热状态与肠道菌群的丰富度和多样性下降密切相关。现代研究表明内生湿热证的生物学本质与机体慢性炎症状态密切相关[10],而肠道菌群失调在炎症反应中发挥至关重要的作用,如肠道微生物群及其代谢产物短链脂肪酸(SCFA)和胆汁酸(BA)可以作用于GLP、PYY和FXR等受体,触发自身免疫过程引起持续炎症刺激[11],这与糖尿病[12]、肥胖[13]等疾病的发病机制相关。拟杆菌门和厚壁菌门是人体内两大优势菌门,主导肠道微生物的多样性[14],拟杆菌门/厚壁菌门相对丰度比值常作为衡量肠道菌群紊乱的指标。本研究结果显示,湿热组拟杆菌门/厚壁菌门相对丰度比值较对照组呈下降趋势,提示湿热证患者存在肠道菌群紊乱,但拟杆菌门/厚壁菌门相对丰度比值下调是否可作为内生湿热证的衡量指标,还需要进一步大样本研究。
本研究显示,内生湿热证与某些特定菌群相对丰度的变化相关,主要表现在的迟缓埃格特菌属、布劳特氏菌属占比上升,瘤胃球菌属、双歧杆菌属、颤螺菌属占比下降。迟缓埃格特菌是一种厌氧、不产孢的革兰阳性杆菌,主要引起胃肠道疾病[15]。Gardiner等[16]报道了迄今为止最大规模的迟缓埃格特菌感染,其中有82%(27/33)的患者有明显的肠道症状。Shen等[17]认为布劳特氏菌属丰度的上升可能是促进非酒精性脂肪性肝病进展的因素之一,Ozato等[18]发现布劳特氏菌属与女性的内脏脂肪面积呈显著负相关,且与性别因素无关,所以对布劳特氏菌属的优缺尚无定论。瘤胃球菌属是厌氧、不产孢的革兰阳性球菌,在大多数人体内被认为是“核心肠道菌群”[19]。Mack等[20]发现瘤胃球菌属能促进肠易激综合征及消化不良患者淀粉降解及复杂氨基酸的合成,进一步促进丁酸盐等短链脂肪酸的合成,对维护肠黏膜代谢、稳态、肠-脑轴信号传导至关重要。双歧杆菌属属于放线菌门,由80个子菌种组成,至今已发现其有杀灭病原体[21]、调节宿主免疫系统[22]、缓解肠道炎症反应[23]、抗肿瘤[24]等功能,是人体内的益生菌。颤螺菌属是一类产丁酸厌氧菌,颤螺菌属中的某些种类可以利用葡萄糖醛酸酯,其在炎症性疾病中含量减少[25]。由此可见,致病菌丰度的升高和有益菌丰度的降低可能参与了内生湿热证发生发展的过程。
综上所述,内生湿热证人群的肠道菌群多样性与健康人存在明显差异,主要表现在拟杆菌门/厚壁菌门相对丰度比值下调,迟缓埃格特菌属丰度上升,瘤胃球菌属、双歧杆菌属、颤螺菌属丰度下降。但由于本研究样本量较少,16S rDNA测序方法的局限性,影响肠道菌群的因素较多等,还需大样本多中心研究进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
