湿润暴露疗法/湿润烧伤膏对大鼠慢性难愈合创面中RELM-α表达的影响
2021-01-28黄许森兰海生李明尚黄海舸岑小宁吕建生唐乾利
黄许森,兰海生,李明尚,黄海舸,岑小宁,吕建生,唐乾利
(1. 右江民族医学院附属医院,广西 百色 533000;2. 右江民族医学院临床学院,广西 百色 533000)
慢性难愈创面是外科常见疾病之一,因其治疗周期长、难度大以及费用高,往往造成患者巨大负担。湿润暴露疗法/湿润烧伤膏(MEBT/MEBO)因其疗效确切、操作简单、价格低廉等特点被广泛应用于各种皮肤创面的修复治疗[1]。近年来研究表明,抵抗素样分子α( RELM-α)具有刺激肌纤维母细胞分化以及促进动脉平滑肌细胞增殖、迁移,收缩血管等功能,而纤维组织的重塑和新生血管的产生在创面愈合中尤为重要[2-4]。基于此,本研究通过动态监测大鼠慢性难愈合创面组织中RELM-α的表达情况,探讨了MEBT/MEBO促进慢性难愈合创面愈合的可能作用机制,旨在为该方法可靠用于临床提供更多的理论支持。
1 实验材料与方法
1.1实验动物 SPF级雄性Wistar大鼠135只,12~14周,体质量240~270 g,购于长沙市天勤生物技术有限公司,于屏障环境动物实验室内进行饲养、造模、取标本。本研究经右江民族医学院实验动物伦理委员会批准,严格遵守实验动物福利伦理原则。
1.2主要药物及试剂 湿润烧伤膏(MEBO,汕头市美宝制药有限公司生产);贝复济(外用重组牛碱性成纤维细胞生长因子,珠海亿胜生物制药有限公司生产);醋酸氢化可的松注射液(上海通用药业股份有限公司生产);RELM-α一抗(Bioss公司,bs-1884R);β-Actin一抗(北京中杉,TA-09);二抗:辣根酶标山羊抗兔(北京中杉,ZB2301)。RELM-α和GAPDH 引物(上海生工),RNA 提取、反转录、荧光试剂盒(北京天根)。
1.3实验方法 将135只大鼠随机分为5组,每组27只54个创面模型。参考文献[5-6]方法,MEBO组、贝复济组、慢创组、急创组以腹腔注射水合氯醛(0.3 mL/100 g)麻醉及背部备皮后,用直径为l.5cm的图章标记,并在无菌条件下沿标记分别于脊柱两侧各做深达筋膜层的全层皮肤缺损创面(每只大鼠做2个创面),然后MEBO组、贝复济组、慢创组立即肌肉注射醋酸氢化可的松注射液(8 mg/100 g)使其形成慢性难愈合创面,而急创组不注射醋酸氢化可的松注射液。空白组只进行备皮而不做任何创面损伤处理。术后创面常规消毒后,慢创组和急创组创面局部涂生理盐水,MEBO组局部涂MEBO,贝复济组局部涂贝复济,外用无菌干纱布包扎固定,每天换药2次。
1.4观察指标及方法
1.4.1创面愈合情况 各组分别于干预后第3,7,14天肉眼观察创面愈合情况,并每组随机选取9只大鼠(共18个创面),在创面周围放置标尺对创面拍照,同时以透明薄膜描印创面。采用NIH lmageJ图像分析软件测量创面面积,计算创面愈合率。创面愈合率=(初始创面面积-观察日创面面积)/初始创面面积×100%[6]。
1.4.2RELM-α蛋白表达水平 采用Western blot法检测:分别于创面处理后第3,7,14天,从每组随机选取9只大鼠(共18个创面),取创面组织100 mg,提取组织蛋白,检测蛋白含量,并将蛋白变性后保存备用;将提取的蛋白上样置于80 V恒压下进行电泳,在300 mA恒流下,转膜至PVDF膜,室温摇床封闭1 h,用PBST洗膜3次,每次5 min,4 ℃摇床内孵育一抗过夜,用PBST洗膜3次,每次5 min,二抗室温孵育1.5 h;用PBST洗膜3次,每次5 min,发光显影;最后用Image J图像分析软件对检测结果进行灰度分析,样本蛋白含量=目的条带积分吸光度值/内参条带积分吸光度值。
1.4.3RELM-α mRNA表达水平 采用qRT-PCR技术检测:分别于创面处理后第3,7,14天,每组随机选取9只大鼠(共18个创面),取创面组织,用Trizol法提取样本组织中的总RNA;RNA电泳以检测RNA的完整性;TIANScript RT KIT进行反转录;用荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。RELM-α上游引物序列:5’-TGGGAAGAAAAAGGTCAAGGA-3’,下游引物序列:5’-GCCACAAGAACAACCAGTAGC;β-actin上游引物序列:5’-CCTAGACTTCGAGCAAGAGA-3’,下游引物序列:5’-GGAAGGAAGGCTGGAAGA-3’。
2 结 果
2.1各组大鼠肉眼观察创面愈合情况 干预后第3天,急创组创面局部可见肉芽组织,且肉芽组织鲜红;MEBO组创面边缘可见少许肉芽组织爬行;贝复济组局部见痂皮覆盖,局部干燥;慢创组肉芽局部水肿,颜色相对灰暗。 干预后第7天,急创组、MEBO组、贝复济组局部见明显鲜红肉芽组织爬行,而慢创组肉芽灰暗。干预后第14天,急创组、MEBO组和贝复济组创面均可见表皮及毛发覆盖,局部干燥;慢创组局部肉芽灰暗、水肿,局部可见渗出液。见图1。
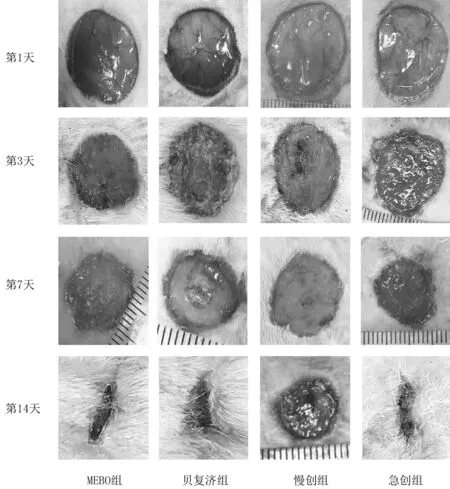
图1 各组大鼠干预后不同时间肉眼观察创面愈合情况
2.2各组大鼠创面愈合率比较 干预后第3天,各组大鼠创面愈合率比较差异无统计学意义(P>0.05);干预后第7天和第14天,急创组、MEBO组、贝复济组大鼠创面愈合率均明显高于慢创组(P均<0.05),且急创组明显高于MEBO组、贝复济组(P均<0.05),MEBO组与贝复济组比较差异均无统计学意义(P均>0.05)。见表1。
表1 各组大鼠干预后不同时间点创面愈合率比较
2.3各组大鼠创面组织中RELM-α蛋白表达水平比较 空白组大鼠各时间点皮肤组织中RELM-α蛋白表达水平未见明显变化(P>0.05);干预后第3天开始,除空白组外,其余组大鼠创面组织中RELM-α蛋白表达水平均逐渐升高(P均<0.05),但MEBO组、贝复济组RELM-α蛋白表达水平均明显低于同期慢创组(P均<0.05),MEBO组与贝复济组比较差异均无统计学意义(P均>0.05)。见图2及表2。
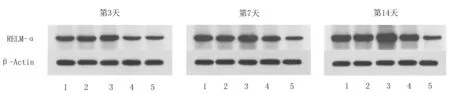
1为MEBO组;2为贝复济组;3为慢创组;4为急创组;5为空白组图2 各组大鼠干预后不同时间点创面组织中RELM-α蛋白表达条带图
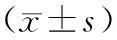
表2 各组大鼠创面组织中RELM-α蛋白表达水平比较
2.4各组大鼠创面组织中RELM-α mRNA表达水平比较 空白组大鼠各时间点皮肤组织中RELM-α mRNA表达水平无明显变化(P>0.05);干预后第3天开始,除空白组外,其余组创面组织中RELM-α mRNA表达水平均逐渐升高(P均<0.05),但MEBO组、贝复济组RELM-α mRNA表达水平均明显低于同期慢创组(P均<0.05),MEBO组与贝复济组比较差异均无统计学意义(P均>0.05)。见表3。
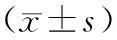
表3 各组大鼠创面组织中RELM-α mRNA表达水平比较
3 讨 论
慢性难愈合创面具有病程长、花费高、发病机制复杂等特点,是外科长期难以解决的治疗难题。随着压疮、下肢静脉性溃疡、糖尿病溃疡等疾病在老年人群中发病率逐年增高,揭示慢性难愈合创面发病机制,寻找有效治疗药物成为临床亟待解决的问题。
创面愈合主要包括组织细胞迁移和增殖、炎症反应、基质沉积、肉芽组织形成以及血管和上皮的再生等过程,当创面形成后,在趋化因子的作用下成纤维细胞开始增殖,并与浸润的炎性细胞和毛细血管构成肉芽组织,其中成纤维细胞是主要的修复细胞[7]。RELM-α是一种与炎症相关的缺氧诱导分泌型蛋白,具有调节炎症、刺激细胞增殖、促进纤维化和血管再生等作用[2,8-9]。本实验结果显示,随着创面形成,RELM-α表达量开始增高,随着时间延长,其表达量逐渐增高,在同一时间点,RELM-α表达量慢创组>MEBO组=贝复济组>急创组>空白组。笔者分析:RELM-α正常情况下微弱表达于啮齿动物的肺、心脏和上皮组织中,故空白组表达量最低,在创面形成后,机体开始诱发炎症反应,而急创组局部炎症较轻,且沉积成纤维细胞较为疏松,故该组RELM-α表达量低于慢创组;慢性难愈合创面在机体诱发炎症反应后,往往在修复过程中出现了修复停滞,不能顺利进入增殖与重塑阶段,局部呈慢性炎症状态,从而上调RELM-α的表达,此外慢性难愈合创面因不能有效促进创面再生,且沉积的细胞外基质主要以致密成纤维细胞为主,从而进一步刺激RELM-α的表达[10-12],故慢性创面组织中RELM-α表达量明显高于急性创面,最终结局表现出慢创组的愈合率最低。而给予MEBO和贝复济干预后,RELM-α表达量下调,考虑可能与MEBO和贝复济能有效抑制局部创面过度纤维化,促进创面再生有关,该结果与课题组前期研究在一定程度上相契合[13]。
在正常创伤修复过程完成后,成纤维细胞及其分泌的因子应当基本消失,理论上RELM-α表达量应当下调,但在本研究中,RELM-α变化趋势是持续性升高,并非是先增高后降低。有研究发现,RELM-α能通过PI3K/Akt等多条信号通路刺激血管平滑肌细胞和内皮细胞增殖、迁移,明显促进组织血管新生[2,8-9]。李利青等[6]研究表明,MEBT/MEBO干预慢性创面第3天及第7天后,创面组织中P13k、AKT表达量明显高于对照组;葛斌等[14]研究表明,MEBT/MEBO能上调慢性难愈合创面组织中VEGFR-2的表达水平,从而促进血管内皮细胞增生,诱导创面血管生成,增加创面局部血供,从而促进创面愈合。故笔者猜测,RELM-α在创面中的表达不仅仅与炎症反应和成纤维细胞沉积有关,还可能与创面新生血管发生侧支生芽有关。此外,RELM-α可激发Th2型免疫应答,同时又被Th2型细胞因子调控,而Th1 /Th2细胞因子失衡是影响损伤组织局部炎症形成、纤维化和新生血管形成的重要因素,而Th2细胞因子的过度表达往往导致组织纤维化[15-17],故RELM-α动态调控Th1 /Th2细胞因子的特点也可能影响其在创面修复中的表达。
综上所述,RELM-α的表达与创面愈合密切相关,其在促进血管新生和慢性难愈合创面修复中可能起到积极作用,为揭示创面愈合机制提供了一定依据,但创面修复机制错综复杂,各通路和因子之间具体是如何相互影响和相互平衡仍未明确,故仍需进一步研究证实。
利益冲突:所有作者均声明不存在利益冲突。
