AtEXD参与植物盐胁迫的作用研究
2021-01-27张香香滕炎桐陈涛
张香香,滕炎桐,陈涛
中国农业科学院生物技术研究所, 北京 100081
在自然界中,植物的每个生长发育阶段都面临着多种非生物胁迫,例如盐胁迫、干旱胁迫、冷胁迫、热胁迫、营养元素缺失胁迫等。这些逆境胁迫对植物的生长发育造成了很多不良影响,导致了粮食作物产量下降。据估计,世界上的主要粮食作物由于逆境胁迫造成的减产约50%,甚至更多[1]。
一直以来,盐胁迫都是影响植物最重要的非生物胁迫之一,造成了粮食作物的严重减产,对植物的各个发育阶段如萌发、营养生长、开花等产生不良影响[2]。大约20%的灌溉农田受到盐渍化的严重影响。盐胁迫是通过影响植物的生理途径,进而影响植物生长,其中对植物的主要影响有两个:一是减弱植物的光合作用,二是产生离子毒害和渗透毒害。当盐胁迫发生时,植物叶肉细胞上的气孔关闭,降低了CO2的有效利用率,进而减弱了植物的光合作用,降低了光合效率,同时也减弱了蒸腾作用,可蒸发水分的减少伴随着叶片温度的升高,在萌发期抑制了幼芽的伸长,降低了出芽率[3]。而植物光合作用的降低也会引起叶片发黄早衰,降低作物产量[2]。
植物的离子毒害主要是盐离子(多是钠离子)积累过多引起的。由于土壤中盐离子浓度过高,植物根部会吸收过多的盐离子,运输到植物体的各个部位,致使植物体内的盐离子积累过多。过多的盐离子会使植物形成生理上的干旱胁迫,同时也会破坏植物体内的离子平衡[4]。植物体内的pH也会随之改变,破环膜结构,影响酶活性,抑制细胞分裂和生长,对植物体造成不可逆转的伤害[2,5]。当然,非生物胁迫也会触发植物体内响应胁迫的分子机制,增加其抗逆性。
为研究植物盐胁迫应答机制,对拟南芥施加盐胁迫,发现了1个在盐胁迫下表达量显著改变的基因AtEXD(At2g25910)。AtEXD是一个具有3’-5’外切酶结构域和KH结构域的蛋白,在进化关系上具有较高的保守性,但目前对拟南芥中AtEXD的功能研究还是未知的。本研究通过酵母双杂交实验筛选与AtEXD相互作用的转录因子,并分析这些转录因子参与植物体内的胁迫应答机制,以期探究AtEXD基因参与拟南芥盐胁迫的应答机制。
1 材料与方法
1.1 材料与试剂
1.1.1实验材料 植物材料拟南芥哥伦比亚生态型col、突变体exd-1(SALK_016153)、exd-2(SALK_080472)为本实验室保存的植物材料,突变体exd-1(SALK_016153)、exd-2(SALK_080472)为T-DNA插入突变体,T-DNA插入突变体是将一段T-DNA插入该基因内,使得该基因在植物体内失去作用,不再表达。将成熟的拟南芥种子,用75%的乙醇灭菌10 min,之后用无菌水清洗5~6次,最后一次留水,4 ℃放置春化2~3 d,点种于1/2 MS培养基上,之后放在光照培养箱培养。培养温度为20~24 ℃,长日照光周期为16 h/8 h,相对湿度为70%左右,光照强度为100~120 μmol·m-2·s-1。
1.1.2实验试剂 超纯RNA提取试剂盒购自康为世纪公司;反转录试剂盒购自Abm公司;KOD高保真酶购自ToYoBo公司;凝胶回收试剂盒、质粒小提试剂盒购自AxyGen公司;pENTR-D-TOPO载体、LR酶购自Invitrogen公司;Taq酶购自Genstar公司;内切酶、T4连接酶购自NEB公司;蛋白胶显影液购自Bio-Rad公司;酵母缺陷型培养基、核酸染色液购自Solarbio公司;抗生素、琼脂糖购自ThermoFisher公司;感受态细胞、PCR Maker北京博迈德公司。
1.2 实验方法
1.2.1AtEXD蛋白序列分析 将AtEXD蛋白序列在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中进行模式生物和其他植物的同源性比对,将所有模式生物和其他植物的同源序列分别下载后,利用MEGA软件分别构建AtEXD与其他模式生物和其他植物的系统进化树。
1.2.2酵母双杂筛选转录因子 将克隆到的基因AtEXD连接到酵母载体pDEST32上获得重组载体,将其转化酵母感受态细胞AH109,获得酵母转化子AtEXD-AD。酵母自激活实验即将转化子AtEXD-AD与正负对照涂于SD/-leu/+X-α-gal固体培养基上,放入30℃培养箱中培养。若正对照显蓝,负对照和转化子AtEXD-AD不显蓝,则没有自激活活性;若正对照和转化子AtEXD-AD显蓝,负对照不显蓝,则有自激活活性。之后将经验证没有自激活活性的酵母转化子AtEXD-AD与活化好的转录因子库菌进行点对点杂交培养,将杂交菌涂于酵母缺陷型培养基(SD/-leu/-trp/+X-α-gal,SD/-leu/-trp/-his,SD/-leu/-trp/-his/-ade)上,放入30℃培养箱中培养观察。若某一转录因子在SD/-leu/-trp/+X-α-gal筛选板上显蓝,在SD/-leu/-trp/-his和SD/-leu/-trp/-his/-ade筛选板上正常生长,则说明该转录因子与AtEXD相互作用。
1.2.3RT-PCR和Western blot RT-PCR:使用超纯RNA提取试剂盒提取拟南芥总RNA,利用反转录试剂盒合成cDNA的第一条链,在KOD高保真酶的作用下扩增目的基因片段,使用0.8%~1%的琼脂糖凝胶电泳对PCR产物进行分离,对电泳条带进行分析。Western blot:使用蛋白提取液[0.1 mol·L-1EDTA(pH 8.0),0.12 mol·L-1Tris-HCl(pH 6.8),4% SDS(pH 7.4),10% β-巯基乙醇,5%甘油,0.005% 溴酚蓝BPB]提取植物蛋白,配制SDS-PAGE胶,上蛋白样后电泳至溴酚兰刚出胶停止,转膜后封闭,孵育双抗后使用蛋白显影液显影,拍照。
1.2.4萌发率统计实验 选择盐处理的浓度梯度,即0、60、90、120、150 mmol·L-1。配制含有各个盐浓度梯度的1/2 MS培养基(Agar浓度为0.65%),高温灭菌后倒板(直径90 mm)备用。对种子进行消毒灭菌操作,4 ℃春化3 d。将配制好培养基的平板划分区域并标记,将种子点种在各自的区域内,每种种子点种25粒。从第2天开始统计并记录种子的萌发率,连续统计10 d以上,利用Microsoft Excel软件生成萌发率折线图。
2 结果与分析
2.1 AtEXD蛋白基本特性分析
对AtEXD进行基本特性分析发现,AtEXD位于拟南芥2号染色体上,编码342个氨基酸,蛋白分子量为38.48 kD,具有2个结构域:3’-5’外切酶结构域和KH结构域。利用构建系统进化树的方法观察了AtEXD与其他生物中同源蛋白的亲缘进化关系。在NCBI数据库中搜索并下载了其他模式生物(大肠杆菌、酵母、线虫、果蝇、水稻、玉米、小麦、斑马鱼、蛙、大鼠、小鼠、猴、人)中的同源蛋白,发现除了玉米中有2个同源蛋白外,其他均只有一个同源蛋白,小麦中没有同源蛋白,这表明AtEXD的同源蛋白在各个模式生物中较为单一。然后利用MEGA软件构建了AtEXD与其他模式生物的系统进化树,如图1A所示,发现这些同源蛋白有从简单生物到复杂生物进化的趋势。AtEXD与其他植物同源蛋白的系统进化树如图1B所示,发现拟南芥AtEXD与同属同科类的植物进化关系较为相近。以上分析说明AtEXD具有较高的序列保守性,且在进化关系中较为保守。
2.2 与AtEXD进行相互作用的转录因子及其功能分析
目前没有任何有关AtEXD功能的研究报道,由于AtEXD有一个KH结构域,而KH结构域可结合DNA并调节其转录。为进一步解析AtEXD的功能,利用酵母双杂实验筛选了与AtEXD进行相互作用的转录因子TFs,该转录因子TFs库共有1 580个已知的转录因子TF位点。首先我们进行了AtEXD的自激活实验,自激活实验结果显示酵母转化子AtEXD-AD在SD/-leu/+X-α-gal平板上正常生长并显蓝,说明AtEXD没有自激活活性(图2A)。之后将AtEXD-AD与转录因子TFs库杂交培养,涂板观察生长状况。实验结果显示共有10个杂交菌斑能在SD/-leu/-trp/-his/-ade平板上正常生长(图2B),表明AtEXD与这10个TFs进行相互作用。之后进一步对这10个TFs进行功能分析发现(表1),其中5个TFs(AT5G06960 OBF5/TGA5、AT1G21910 DREB26、AT5G22570 WRKY38、AT4G18170 WRKY28、AT2G16770 bZIP23)参与植物体内的胁迫响应机制,例如SA、NaCl、热等,那么AtEXD也可能参与植物体内的胁迫响应机制,这与先前发现AtEXD在盐胁迫下表达量显著改变相一致;3个TFs(AT2G36960 TKI1、AT5G23280 TCP7、AT2G33880 STIMPY/WOX9)参与细胞增殖生长;2个TFs(AT5G27050 AGL101、AT4G11250 AGL52)功能未知。
2.3 获得AtEXD的遗传学材料
为了研究AtEXD参与植物体内盐胁迫应答的机制,本研究创建了一些AtEXD的遗传学材料。本实验室保存的突变体exd-1(Salk_016153)和exd-2(Salk_080472)是在拟南芥col背景下的T-DNA插入突变体,T-DNA插入位点在AtEXD基因内,其中exd-2为外显子T-DNA插入突变,exd-1为内含子T-DNA插入突变(图3A)。通过在T-DNA插入位点两侧设计引物,进行RT-PCR实验,结果显示exd-2无AtEXD表达,而exd-1有少量表达(图3B),故exd-2为纯和突变体,exd-1则为突变不彻底。为获得AtEXD的过表达体,将AtEXD连接到pCD3-688(N-FLAG)载体上,利用转基因技术获得AtEXD的过表达体colAtEXD-FLAG(约40 kD),Westhern blot实验进一步验证了colAtEXD-FLAG为AtEXD的过表达体(图3C)。
2.4 AtEXD参与拟南芥中的盐胁迫应答
为获得AtEXD遗传学材料的盐胁迫表型,我们统计了AtEXD突变体和过表达材料在盐胁迫下的种子萌发率(图4、5)。如图4所示,在0 mmol·L-1NaCl条件下,exd-1、exd-2和col的种子萌发趋势一致,且萌发率在第10天时约为100%。在60 mmol·L-1NaCl条件下,与col相比,exd-1和exd-2在前3 d萌发较慢。在90 mmol·L-1NaCl条件下,与col相比,exd-1和exd-2萌发较慢且萌发率较低。在120 mmol·L-1NaCl条件下,与col相比,exd-1和exd-2的萌发率较低,约为20%,小于col的萌发率。这些结果表明,在种子萌发阶段,突变体exd-1和exd-2对盐胁迫较为敏感。
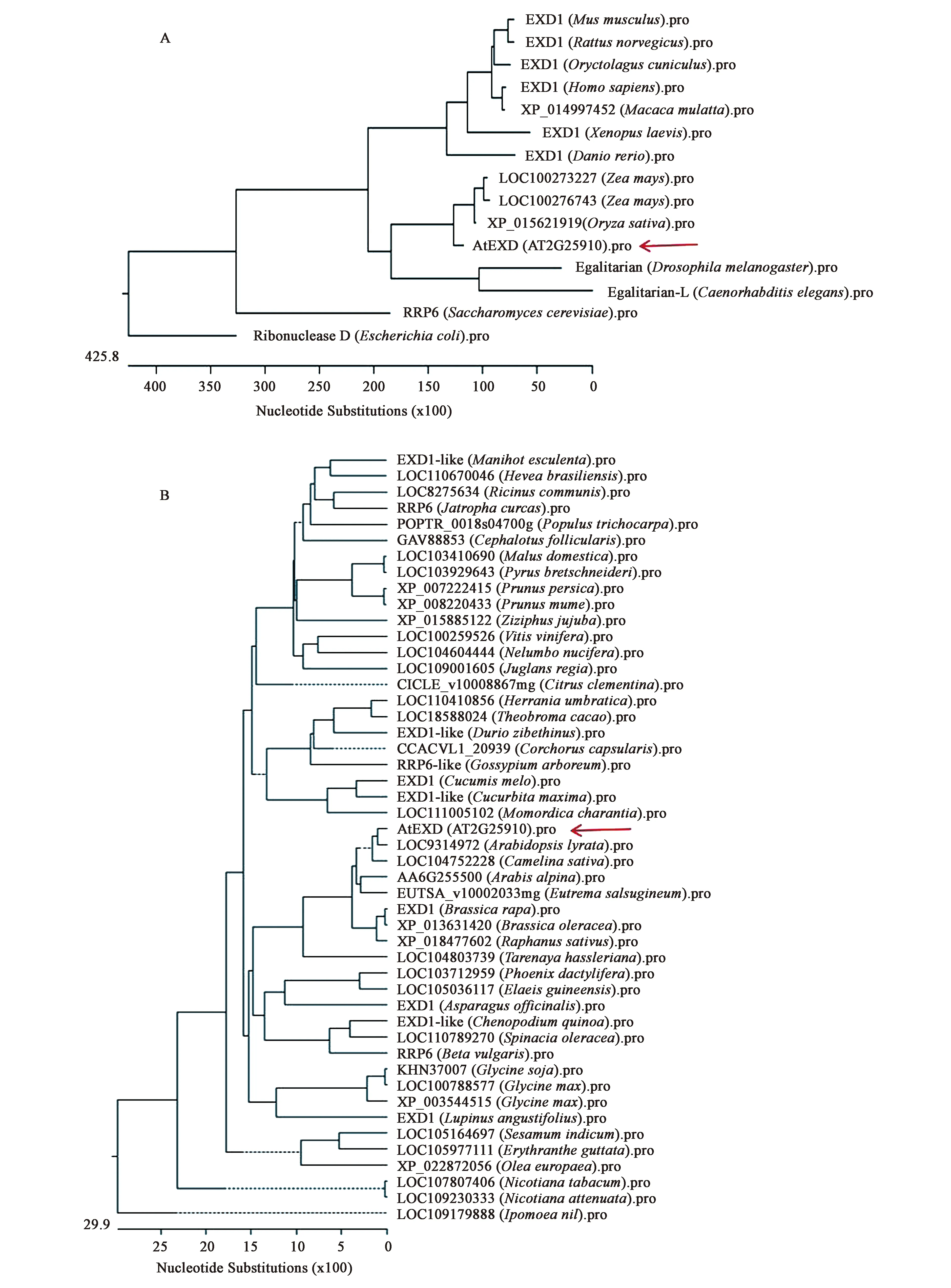
A:AtEXD与其他模式生物的同源蛋白进化树分析;B:AtEXD与其他植物的同源蛋白进化树分析。图1 AtEXD的蛋白结构及序列分析Fig.1 Protein structure and sequence analysis of AtEXD

A:AtEXD自激活实验;B:与AtEXD相互作用的转录因子酵母双杂筛选结果。图2 与AtEXD进行相互作用的转录因子Fig.2 Transcription factors interacting with AtEXD

表1 与AtEXD进行相互作用的转录因子列表Table 1 List of transcription factors interacting with AtEXD
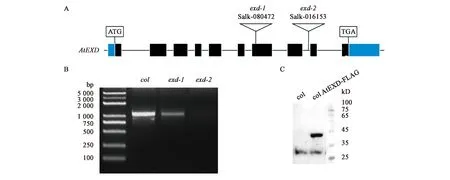
A:AtEXD突变体T-DNA插入位点原理图;B:RT-PCR对AtEXD的纯合单突变体进行鉴定;C:Westhern blot鉴定AtEXD的过表达体。图3 遗传学材料的鉴定结果Fig.3 Identification results of genetic materials
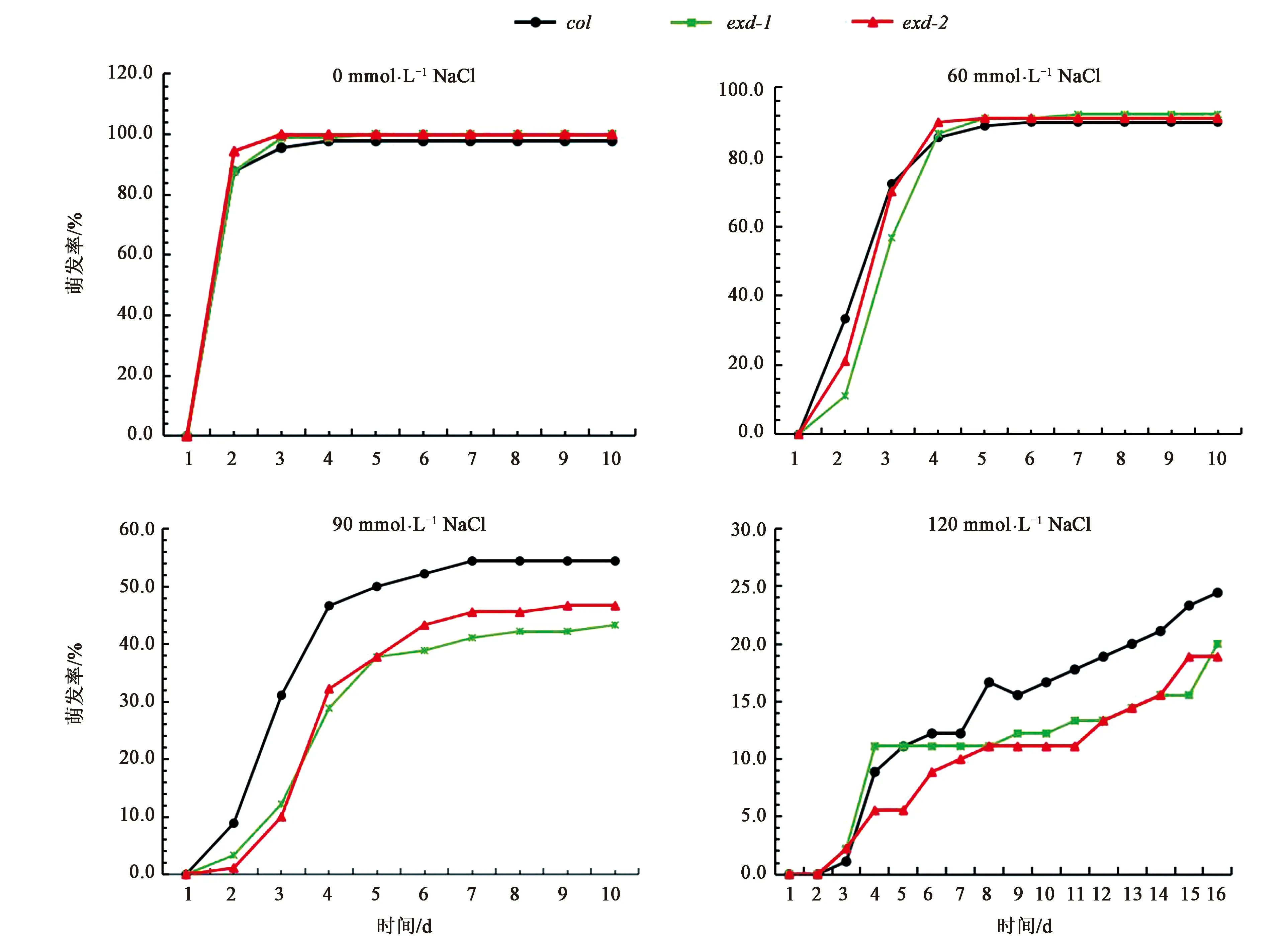
图4 不同浓度盐胁迫条件下col、exd-1和exd-2的萌发率统计Fig.4 Germination rates of col, exd-1 and exd-2 seeds under salt stress with different cocentration
当AtEXD过表达时,过表达材料colAtEXD-FLAG的种子萌发率统计结果如图5所示。在0 mmol·L-1NaCl条件下,colAtEXD-FLAG和col的种子萌发趋势一致,且萌发率在第10天时约为100%。在90 mmol·L-1NaCl条件下,与col相比,colAtEXD-FLAG在前4 d萌发较慢(图5B)。在120和150 mmol·L-1NaCl条件下,colAtEXD-FLAG的种子萌发率大于col。由此可以看出,在种子萌发阶段,过表达材料colAtEXD-FLAG的耐盐性明显增强。综上,突变体的盐敏感性和过表达材料的耐盐性进一步说明AtEXD参与了拟南芥中盐胁迫应答。
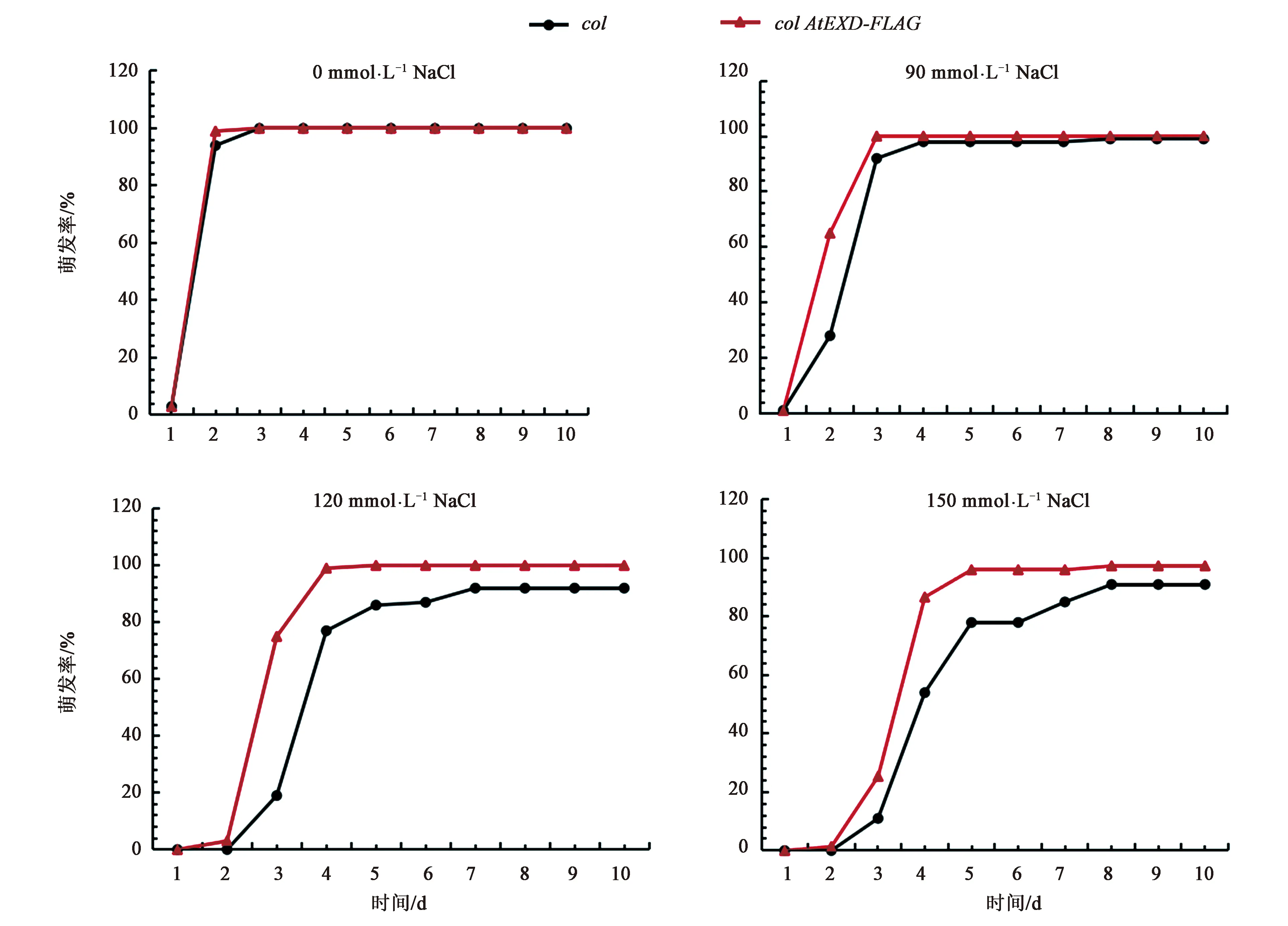
图5 盐胁迫条件下col和col AtEXD-FLAG的萌发率统计Fig.5 Germination rates of col and col AtEXD-FLAG seeds under salt stress
3 讨论
人口持续增长,保证粮食安全一直是国家的重中之重,然而植物在生长过程中会遭受各种各样的逆境胁迫。由于逆境胁迫对植物的生长发育、新陈代谢等产生了极大的不良影响,尤其是造成了一些农作物的严重减产,科研工作者一直没有停止对植物应答逆境胁迫的研究。其中盐胁迫作为对植物影响最大的非生物胁迫之一,一直是科研的热点领域,解析植物应答盐胁迫的作用机理具有重大的理论与实践意义。本研究初步明确了AtEXD基因参与拟南芥中盐胁迫应答机制。在对AtEXD的遗传学材料的研究中我们发现,在种子萌发阶段,突变体exd-1和exd-2具有明显的盐胁迫敏感表现型;而当AtEXD过表达时,拟南芥表现出较高的耐盐性。这表明AtEXD很可能正调控拟南芥的耐盐性。
我们利用酵母双杂交实验筛选到了一些与AtEXD相互作用的转录因子,其中有一半的转录因子参与拟南芥中逆境胁迫应答机制。例如转录因子DREB26(AT1G21910)参与植物体的防御系统,响应盐胁迫、干旱胁迫、渗透胁迫等[9-10]。转录因子WRKY38参与植物体的生物胁迫和非生物胁迫(冷胁迫、干旱胁迫等)应答,以及水杨酸SA信号通路[11-13]。这些结果为研究AtEXD调控植物体的耐盐性提供依据,同时也为我们提供了新的研究方向——AtEXD是否也在植物体内响应其他的逆境胁迫。
在对AtEXD的基本特性分析中发现AtEXD具有2个结构域:3’-5’外切酶结构域和KH结构域。3’-5’外切酶在植物体内的主要功能是降解核苷酸,参与DNA复制、DNA修复、DNA重组、细胞周期调控等细胞生物学进程[23]。含KH结构域的蛋白主要参与转录、mRNA稳定性、翻译沉默和mRNA定位等[24]。同时结合本研究筛选到的转录因子,其中有3个转录因子TKI1(AT2G36960)、TCP7(AT5G23280)、STIMPY/ WOX9(AT2G33880)调控核内复制,与染色质代谢、分生组织生长和胚胎形成相关[18-19,21-22]。那么AtEXD很可能也参与植物体内遗传物质的转录和翻译过程,值得进一步深究。综上,本研究结果为深度解析AtEXD的功能、探究其参与的细胞生物学进程打下了基础。
