JAK2/STAT3作为新型抗癌药物靶点的研究进展
2021-01-27张文颖王思情张新妍李庆伟李莹莹
张文颖,王思情,张新妍,李庆伟,2,3,李莹莹,2,3*
1.辽宁师范大学生命科学学院, 辽宁 大连 116081;2.辽宁师范大学七鳃鳗研究中心, 辽宁 大连 116081;3.大连工业大学海洋食品精深加工关键技术省部共建协同创新中心, 辽宁 大连 116034
2019年1月,国家癌症中心发布了最新的全国癌症统计数据。数据显示,肝癌、乳腺癌、胰腺癌等3种癌症居我国恶性肿瘤前十位[1]。目前,癌症的治疗途径主要包括手术治疗、放射治疗、化学药物治疗(简称化疗)。其中化疗是常见的治疗手段之一,但是化疗所使用的许多抗癌药物的特异性较差,易产生毒副作用、耐药性等问题,严重影响治疗效果[2]。为了有效改善目前癌症治疗所面临的问题,靶向治疗成为了研究热点。分子靶向治疗是指利用药物或其他物质靶向特定分子来阻止癌细胞的生长和扩散。肿瘤分子靶向治疗成功的关键在于分子靶点选择,一般来说,作为分子靶向药物开发的理想分子靶点应能够区分癌细胞和正常细胞的特异基因突变[3]。因此,相对于化疗而言,靶向治疗能够更好地区分正常细胞和肿瘤细胞,进而在不损伤正常细胞的前提下特异性地杀死肿瘤细胞。
Janus激酶/信号转导和转录激活因子(Janus kinases/signal transducer and activator of transcription,JAK/STAT)信号通路由细胞因子刺激后参与了多种重要的生物学过程。作为一类非受体型酪氨酸激酶,JAKs包含4个成员,STATs包含7个成员[4]。在JAK/STAT信号通路中,JAK2/STAT3信号通路作为重要的组成部分参与了多种实体瘤的发生和发展,并且在肿瘤细胞中呈现过度激活状态。因此,针对STAT3和JAK2/STAT3信号通路的靶向治疗是目前研究的热点[5]。本文围绕JAK2/STAT3信号通路分子在实体恶性肿瘤发生、发展及转移过程中的重要作用进行了综述,以期为以JAK2/STAT3信号通路分子作为肿瘤治疗新型靶点开发药物提供参考,进而促进肿瘤细胞凋亡或者逆转恶性表现型,为肿瘤治疗开辟新的途径。
1 JAK2/STAT3信号通路
JAK/STAT信号通路参与了多种生物学过程,如细胞增殖、分化及免疫调节等[6]。该信号通路的传递过程主要由3个部分组成,即酪氨酸激酶相关受体(receptor tyrosine kinases,RTKs)、酪氨酸激酶JAK和转录因子STAT。
RTKs是最早被发现的激酶,该激酶与肿瘤发生相关。JAK2是非受体酪氨酸激酶家族成员,含有7个JAK同源结构域(JAK homology domain,JH),其中:JH1为激酶区,JH2为“假”激酶区,JH6和JH7为受体结合区[7-8](图1)。其中,JH1结构域能够与受体内Src同源2区(Src homology 2 domain,SH2)结构域相互作用,受体激活后可使底物蛋白的催化活性增强[10]。此外,JAK2还与Ⅱ型粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)受体家族(IL-3R、IL-5R和GM-CSF-R)的信号转导有关[11-12]。
作为重要的信号转导与转录因子,STATs参与了多种生物学过程,如细胞分化、免疫、应答及胚胎发育等,其中包括STAT1、2、3、4、5a、5b和6这7个成员。STAT3蛋白作为STAT蛋白家族成员之一,主要由氨基端保守区、卷曲螺旋区、DNA结合域(DNA-binding domains,DBD)、连接区、SH2结构域、转录激活区(transcription activation domain,TAD)、酪氨酸、丝氨酸磷酸化的位点等组成(图1)[9]。其中,SH2结构域最初是在癌症中被鉴定的,其长度为100个氨基酸,能够作为细胞内信号转导级联的调节模块,与靶肽链序列进行特异性结合并发挥作用[13]。STAT3具有2个酪氨酸磷酸化(phosphorylation tyrosine,pY)位点(Y701和Y705)和1个丝氨酸磷酸化(phosphorylation serine,pS)位点(S727)[14],SH2能特异性识别磷酸化酪氨酸残基,从而使含有该结构域的蛋白质定位于酪氨酸磷酸化位点[15]。
STAT3可被受体相关的Janus激酶磷酸化,形成同源或异源二聚体,并易位至细胞核(图2)。STAT3通过其特殊的SH2结构域与受体上的磷酸化酪氨酸残基结合,并在JAK激酶的作用下实现其C端酪氨酸残基的磷酸化[12],进而启动一系列的信号转导,最终导致基因表达或其他细胞学反应[13-15]。具体地,STAT3第705位酪氨酸被磷酸化后,可通过与干扰素、表皮生长因子(epidermal growth factor,EGF)、白细胞介素IL-5和IL-6的配体相互作用而被激活。
2 JAK2/STAT3信号通路与癌症
JAK/STAT信号通路参与了生物体内细胞分裂、分化等多种生理过程[16-19],且该信号通路参与了多种疾病的发生,如肿瘤、自身免疫疾病及心血管疾病等。作为JAK/STAT信号通路的重要组成部分,JAK2/STAT3信号通路在多种实体瘤中呈现持续激活状态[20],且JAK2/STAT3信号通路中的STAT3的异常活化与多种恶性肿瘤的发生和发展紧密相关[21]。因此,关于JAK2/STAT3信号通路及其相关分子在实体肿瘤中的作用机制研究目前已成为热点。研究显示,组成型STAT3的激活与多种人类癌症的预后不良有关[22-24]。提示JAK2/STAT3信号通路相关分子可作为癌症治疗及预后的标记分子,并可成为癌症治疗的新靶点。
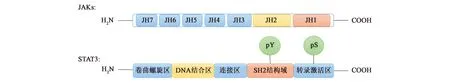
图1 JAKs结构域及STAT3蛋白功能结构域[7-9]Fig.1 Domain structure of Janus kinases and several functional domains of STAT3 protein[7-9]
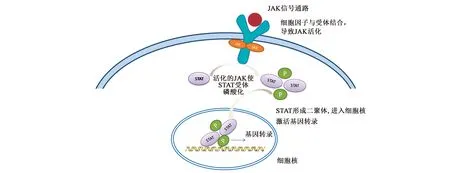
图2 细胞因子JAK/STAT信号转导通路图Fig.2 Cytokine JAK/STAT signal transduction pathway map
2.1 JAK2/STAT3信号通路与肝细胞癌
肝细胞癌(hepatocellular carcinoma cells,HCC)占据全球癌症死亡的第3位,其中主要原因是手术切除后复发率和转移率高[25-26]。在HCC细胞中,JAK2/STAT3信号通路中的JAK2和STAT3分子存在过度激活现象[27-28]。因此,JAK2/STAT3信号通路与HCC的发生发展密切相关[29]。此外,近年研究表明,HCC复发率和转移率高的特性是由HCC癌症干细胞 (HCC cancer stem cells,HCC CSCs) 和其他分化较多的肝癌细胞所驱动的[30-32],并且HCC CSCs负责癌症的发生、复发、转移和耐药[33]。因此,HCC CSCs功能的挖掘已成为开发新型抗癌药物的关键靶点[34],JAK2/STAT3信号通路对于HCC CSCs的作用研究可为HCC治疗提供新的思路。
2.2 JAK2/STAT3信号通路与乳腺癌
近年来,乳腺癌(breast cancer,BC)的诊断和治疗取得了重大进展,但其仍然是世界范围内女性癌症死亡的主要原因[35]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种具有不同特征侵袭性和异质性的恶性肿瘤,这种肿瘤内或者肿瘤间的异质性使得TNBC获得了对现有药物的抗性,目前还没有临床批准的靶向治疗方法[36]。化疗是TNBC的主要治疗方法,但是大部分患者仍然会远处转移复发,这使得TNBC患者死亡率高。研究发现,白细胞介素-6(interleukin-6, IL-6)介导的JAK2/STAT3信号的异常激活与人乳腺癌上皮间质转化和转移正相关[37]。且JAK2/STAT3信号通路中的STAT3分子也参与了人类乳腺癌的生物学过程,主要体现在STAT3的过度表达与乳腺癌的侵袭性增强密切相关,而STAT3的高表达导致了乳腺癌患者预后不良及生存时间短[38]。因此,JAK2/STAT3信号通路及STAT3分子在乳腺癌生物学过程中的作用将为临床乳腺癌的治疗开辟新途径。
2.3 JAK2/STAT3信号通路与胰腺癌
胰腺癌(pancreatic cancer,PC)是一种恶性程度高的消化道恶性肿瘤,约90%为起源于腺管上皮的导管腺癌。胰腺癌早期的确诊率不高,手术死亡率较高,且治愈率很低,5年生存率小于1%,预后较差。现已证实,JAK2/STAT3信号通路参与了胰腺癌细胞的增殖和凋亡过程[39],且发现相较于低转移性胰腺癌细胞,磷酸化的STAT3(p-STAT3)的表达水平在高转移性胰腺癌细胞中表达量更高[40]。异常活化的STAT3信号通路通过抑制细胞凋亡、加速炎症进展、诱导血管生成等方式参与胰腺癌的发生发展,阻断该信号通路的活性能显著抑制肿瘤细胞的恶性生物学行为[41]。因此,JAK2/STAT3信号通路及相关分子可作为胰腺癌治疗的新靶点。
3 JAK2/STAT3作为癌症治疗靶点的研究
3.1 靶向抑制癌细胞的增殖和诱导凋亡
JAK2/STAT3通路在癌细胞的增殖和凋亡过程中发挥重要作用。多种肿瘤细胞的形成与该信号通路的异常激活有关,这表明该信号通路是调节肿瘤细胞增殖和凋亡的重要信号通路[42]。利用姜黄素联合Krüppel样转录因子8(Krüppel-like factor 8,KLF8)基因siRNA可通过抑制JAK2/STAT3信号通路活性促进人乳腺癌细胞MCF-7的凋亡,在此过程中,p-JAK2、p-STAT3、Cyclin D1和Bcl-2蛋白表达水平也受到抑制[43];同样地,利用姜黄素处理人骨肉瘤细胞MG-63后,也检测到了p-JAK2和p-STAT3表达水平下调,进而促进了MG-63细胞的凋亡[44]。2-Ethoxystypandrone作为STAT3信号转导抑制剂,能够阻断STAT3的活化,同时能够抑制JAK2分子的表达,进而抑制了HCC细胞的增殖,并以剂量依赖的方式诱导HCC细胞凋亡。因此,2-Ethoxystypandrone可通过抑制JAK2/STAT3通路分子的活性用于开发抗癌药物靶向HCC CSC[45]。基于此,JAK2/STAT3通路相关分子可以作为癌症治疗的靶标分子,通过抑制JAK2/STAT3通路活性来达到促进癌细胞凋亡的目的。
作为JAK2/STAT3信号通路的关键分子,STAT3可被JAK2分子磷酸化并易位至细胞核行使转录因子的功能。因此,STAT3的磷酸化及其信号通路下游分子的表达水平也可作为癌症治疗的靶标分子。蛋白质二硫键-异构酶A3(protein disulfideisomerase A3,PDIA3)是一种伴侣蛋白,能调节糖蛋白的折叠并响应内质网应激,在HCC细胞中表达上调可作为预后不良的标志。研究显示,PDIA3的敲低表达降低了STAT3信号通路的p-STAT3水平和STAT3信号通路下游的抗凋亡蛋白表达水平,进而诱导了HCC细胞的凋亡[46]。在胰腺癌中的研究显示,具有显著抗肿瘤作用的大黄酸与表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂联合使用能够抑制STAT3的磷酸化,从而可通过抑制STAT3途径使人胰腺癌细胞对EGFR抑制剂敏感[47]。除STAT3的磷酸化外,在肝细胞癌中的研究表明,抑制STAT3活性和下调STAT3靶基因表达,可以达到抑制癌细胞增殖和促进细胞凋亡的目的[48-49]。此外,STAT3活化与肝癌患者肿瘤组织中HSD17B4蛋白表达增加呈正相关,HSD17B4过表达可能通过增强STAT3下游靶基因的表达从而促进了肝癌HepG2细胞的增殖[50]。
综上,通过靶向抑制JAK2/STAT3通路以及STAT3的活化可达到抑制癌细胞的增殖和诱导凋亡的目的,因此可作为癌症治疗中的有效靶标。
3.2 靶向抑制癌细胞的侵袭和转移
JAK2/STAT3通路在癌细胞的侵袭和转移过程中也发挥着重要作用[51]。在肝癌中的研究显示,大黄提取物能够通过抑制STAT3和JAK2分子的磷酸化,以及下调STAT3靶蛋白的表达从而抑制了肝癌细胞的迁移与侵袭[52]。因此,通过基因靶向药物抑制JAK2/STAT3信号通路分子以及STAT3分子或者JAK2分子与其他分子的相互作用来控制肿瘤等相关疾病,可以达到靶向治疗的目的。
JAK2/STAT3通路中的关键分子STAT3还能够通过调控lncRNAs分子的表达参与肝癌转移[48]。LncRNAs是一类非编码RNA转录本,可以控制肌肉分化[53]、诱导多能干细胞的重编程[54]以及调控细胞侵袭等[55]。HOXD-AS1是新近发现的一个关键的肿瘤相关lncRNA。HOXD-AS1异常表达于肿瘤细胞中,在肿瘤的发生发展中发挥着重要的调控作用,有望成为新型的肿瘤标志物[56]。在肝癌转移相关的研究中显示,HOXD-AS1在HCC细胞中上调并且与HCC患者的不良预后显著相关,STAT3可以上调HOXD-AS1的表达,STAT3介导HOXD-AS1上调后,可作为竞争性内源RNA(competing endogenous RNA,ceRNA)通过调控SOX4转录因子的表达促进肝癌转移。因此,通过抑制STAT3的表达可使得HOXD-AS1低表达进而抑制了HCC细胞的迁移、侵袭及转移。作为一种关键的抗血管生成蛋白,血管生成素样蛋白1(angiopoietin-like protein 1,ANGPTL1)能够通过抑制STAT3/Bcl-2介导的抗细胞凋亡途径促进细胞凋亡,通过下调转录因子SNAIL和SLUG基因的转录减少细胞迁移和侵袭;ANGPTL1也能够与整合素α1β1相互作用,通过抑制JAK2/STAT3信号通路抑制HCC血管生成和转移[57]。热休克蛋白HSP90能够通过调节信号转导蛋白的成熟和稳定促进肿瘤的进展和转移,是潜在的治疗靶点。作为HSP90 C末端的抑制剂,L80能够通过抑制TNBC细胞的增殖及AKT/MEK/ERK/JAK2/STAT3的信号转导达到抑制TNBC的肿瘤生长、血管生成和远处转移的目的[58]。在TNBC中的研究表明,IL-6/JAK2/STAT3通路以及下游信号在癌细胞中呈异常持续激活状态,而Wwox能够通过抑制JAK2/STAT3的磷酸化达到抑制TNBC细胞的转移和增殖[59],该研究认为通过Wwox靶向抑制JAK2/STAT3可为TNBC提供有前景的治疗策略。因此,该作用机制有望为TNBC的个性化治疗提供靶点和线索。STAT3信号转导通路在胰腺癌侵袭过程中也起着重要作用,研究表明通过激活和阻断人胰腺癌细胞中的STAT3信号转导通路,发现IL-6可促进人胰腺癌细胞Capan-2细胞的增殖,同时,使得p-STAT3、血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)表达明显升高,增强了细胞的侵袭能力[60]。黄陈等[61]在胰腺癌细胞中的研究发现,AG490能够抑制STAT3活化进而降低了胰腺癌细胞的增殖和侵袭。以STAT3信号转导通路为靶点的基因治疗可为胰腺癌治疗提供新的方向。明确JAK2/STAT3信号通路上下游分子组成及调控机制,有助于寻找更多的与癌症治疗有关的靶分子,并有利于深入探讨癌症发病的分子机理。针对于目标分子的靶向治疗,可达到通过抑制癌细胞的增殖、存活及促进其凋亡,进而达到抑制癌细胞侵袭和转移的目的。
综上所述,通过靶向抑制STAT3以及JAK/STAT3信号转导途径来抑制癌细胞的侵袭和转移,可作为癌症治疗中的新靶标。
4 展望
JAK2/STAT3信号通路在细胞发育、分化及多种疾病中发挥了重要作用。虽然已证实JAK2/STAT3信号通路分子在多种癌细胞中存在过度激活的现象[5],但相关分子机制尚不清楚。研究表明,JAK2/STAT3信号通路的STAT3分子常在肿瘤细胞中高表达,例如,绝大多数乳腺癌组织细胞,包括原位癌和浸润性导管癌,其细胞质和细胞核都检测到STAT3的过度表达[62]。而通过靶向抑制和调控STAT3的表达能抑制细胞的恶性转化及进展[63]。此外,通过调控STAT3的表达也能够调节免疫抑制的肿瘤微环境[64]。这提示着JAK2/STAT3信号通路分子有望成为新型抗癌药物靶点。
本文综述了JAK2/STAT3信号通路分子在肝癌、乳腺癌、胰腺癌等癌症中的相互作用及表达模式。可以设想,未来肿瘤治疗以JAK2/STAT3信号通路分子为靶点,通过抑制JAK2/STAT3信号通路分子的表达水平来阻断肿瘤细胞的信号传递途径,促进肿瘤细胞凋亡或者逆转恶性表现型,从而达到治疗肿瘤的目的,为肿瘤治疗开辟了新的途径。对于JAK2/STAT3信号通路的调控也可能成为治疗癌症的靶点,与分子靶向药物联合,通过抑制癌细胞的增殖和侵袭,促进癌细胞凋亡,进而达到靶向治疗癌症的目的。
