环状RNA及其在生态毒理学研究中的应用进展
2021-01-27王瑞李亮
王瑞,李亮
1.南通大学学工处, 江苏 南通 226019;2.中国农业科学院生物技术研究所, 北京 100081
人口的快速增长和技术的进步导致了无数的污染物和环境毒素的暴露,数以千计的人工合成化合物被创造出来用于工业,并随后被引入到日常消费产品中,包括药品(如抗生素)、农药、兽药、食品及饲料添加剂、个人护理产品、阻燃剂等。据估计,市场上约有8万种化学品[1],而且每年都有新合成的化学品被大量生产并释放到环境中,它们在环境中的降解、蓄积、迁移和转化过程会对生态系统和人类健康造成威胁。监测污染物在环境中的迁移和转化及其对人类和生态系统健康的影响是生态毒理学的研究重点,而敏感、有效的生物标志物对生态毒理学研究和环境危险评价具有重要意义。生态毒理范畴的生物标志物是经外源化学物质暴露或影响后生物体生理、生化或组织学发生变化的指标,可用于阐明生物暴露和产生生物效应的信息[2]。目前,国际标准化组织(International Organization for Standardization,ISO)、经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)、美国国家环境保护局(United States Environmental Protection Agency,US EPA)、美国材料实验协会(American Society of Testing Materials,ASTM)发布的标准以及我国的国家标准中用于评价毒性效应的方法侧重于测量生理生化生物标志物,观察表型改变、形态学指标、致死和非致死效应、生殖和生长率及死亡率等毒性终点。如一些研究报道了暴露在草甘膦、内分泌干扰物和甲基叔丁基醚中的鱼类,胚胎畸形、幼鱼骨骼及软组织异常、幼鱼出血的发生率和死亡率增加[3-5];也有研究显示来自多氯联苯和二噁英类化合物污染地区的雀形目鸟类心脏畸形,且繁殖率受到影响[6]。与这些终点相比,在分子水平上评价毒性终点呈现出特定的优势,因为它们可以在更高的生理水平出现毒性效应之前被检测到,为研究人员提供早期的毒性预警。分子生物学的发展正在将生物标志物扩展到基因水平,作为污染物暴露和毒性效应的早期预警指标,分子生物标志物因具有特异性、预警性和广泛性等特点而受到广泛关注,并已成为国内外生态毒理学研究的热点之一[7]。
随着分子生物学的不断发展,越来越多的研究发现,在遗传信息表达中,RNA水平上的调控精密而复杂,且具有时空特异性[8-9],在生命科学领域“RNA世界假说”也被普遍认同[10]。近年来,非编码RNA成为研究热点,真核生物细胞中存在多种非编码RNA,如环状RNA(circular RNAs,circRNAs)、小RNA(microRNAs,miRNAs)、小核RNA(small nuclear RNAs,snRNAs)、Piwi相互作用的RNAs(piwi-interacting RNAs,piRNAs)、长链非编码RNA(long non-coding RNAs,lncRNAs)等[11]。其中,circRNAs是一种内源性非编码RNA(non-coding RNAs),在不同物种、不同发育阶段和不同病理状态下差异表达。早在20世纪70年代,Sanger等[12]就在类病毒中发现了单链、共价闭合的circRNAs分子,并且Hsu和Coca-Prados[13]在电子显微镜下观察到了没有自由末端的circRNAs,但早期研究只是证明了这些circRNAs分子的存在,并未充分认识其潜在的生物学影响。随着RNA-seq技术的发展以及专门的生物信息学计算管道开发,开启了circRNAs爆发式的研究[11,14-15]。研究发现circRNAs与许多疾病密切相关,如癌症[16-18]、心脑血管疾病[19-21]、糖尿病[22-24]、神经系统疾病[25-27]等,由于circRNAs没有游离端,与线性转录本相比稳定性更高,使它们成为临床诊断生物标志物和治疗干预的理想候选者。此外,近期在生态毒理学研究相关的模式生物中陆续鉴定出circRNAs,如小鼠(Musmusculus)[15]、秀丽隐杆线虫(Caenorhabditiselegans)[15,28]、黑腹果蝇(Drosophila)[29-30]、斑马鱼(Daniorerio)[31-32]、拟南芥(Arabidopsisthaliana)[33-34]、水稻(Oryzasativa)[35]等,且经环境污染物暴露的生物体内circRNAs表达水平出现差异,提示circRNAs也有在生态毒理学研究中作为生物标志物的可能性。基于此,本文对circRNAs的生物合成与降解、生物学功能、分析方法及其目前在生态毒理学相关模式生物中的研究进行梳理概述,探讨circRNAs作为新型环境生态风险评价生物标志物的潜能,以期为生态毒理学研究和环境风险评价提供参考。
1 CircRNAs的生物合成与降解
1.1 CircRNAs的生物合成
CircRNAs是由pre-mRNAs成熟过程中发生的剪接事件产生的,可来自外显子(exonic circular RNAs,ecircRNAs)、内含子(circular intronic RNAs,ciRNAs)、外显子-内含子(exon-intron circular RNAs,EIciRNAs)。当下游的5′端剪接位点(供体位点)反向连接到上游3′端剪接位点(受体位点)时形成包含外显子的套索,外显子发生反向剪接和环化,从而形成ecircRNA或EIciRNA(图1a)[36]。基于外显子两侧内含子中反向重复互补序列(如Alu重复序列)配对驱动的环化过程,形成ecircRNA或EIciRNA(图1b)[37]。RNA结合蛋白(RNA binding proteins,RBPs)二聚化促使上游和下游内含子之间形成“桥梁”,然后反向剪接形成ecircRNA或EIciRNA(图1c)[38]。ciRNA在细胞核中含量丰富,它们参与亲本基因的表达调控,形成机制是由靠近5′端剪接位点附近富含GU的7个碱基元件和邻近的分支剪接位点富含C的11个碱基元件共同作用。在反剪接过程中,这2个元件结合成一个包含切除的外显子和内含子的套索中间产物,被剪接体切断形成ciRNA(图1d)[39]。ecircRNAs还可能由成熟的mRNA外显子经过反向剪接环化形成(图1e)[40]。在古生菌和果蝇中还发现了一种特殊的tricRNAs(tRNA intronic circRNAs),是通过tRNA剪接酶剪接Pre-tRNA内含子而形成的,一部分由3′-5′磷酸二酯键生成tricRNAs,另一部分生成tRNA(图1f)[41-42]。
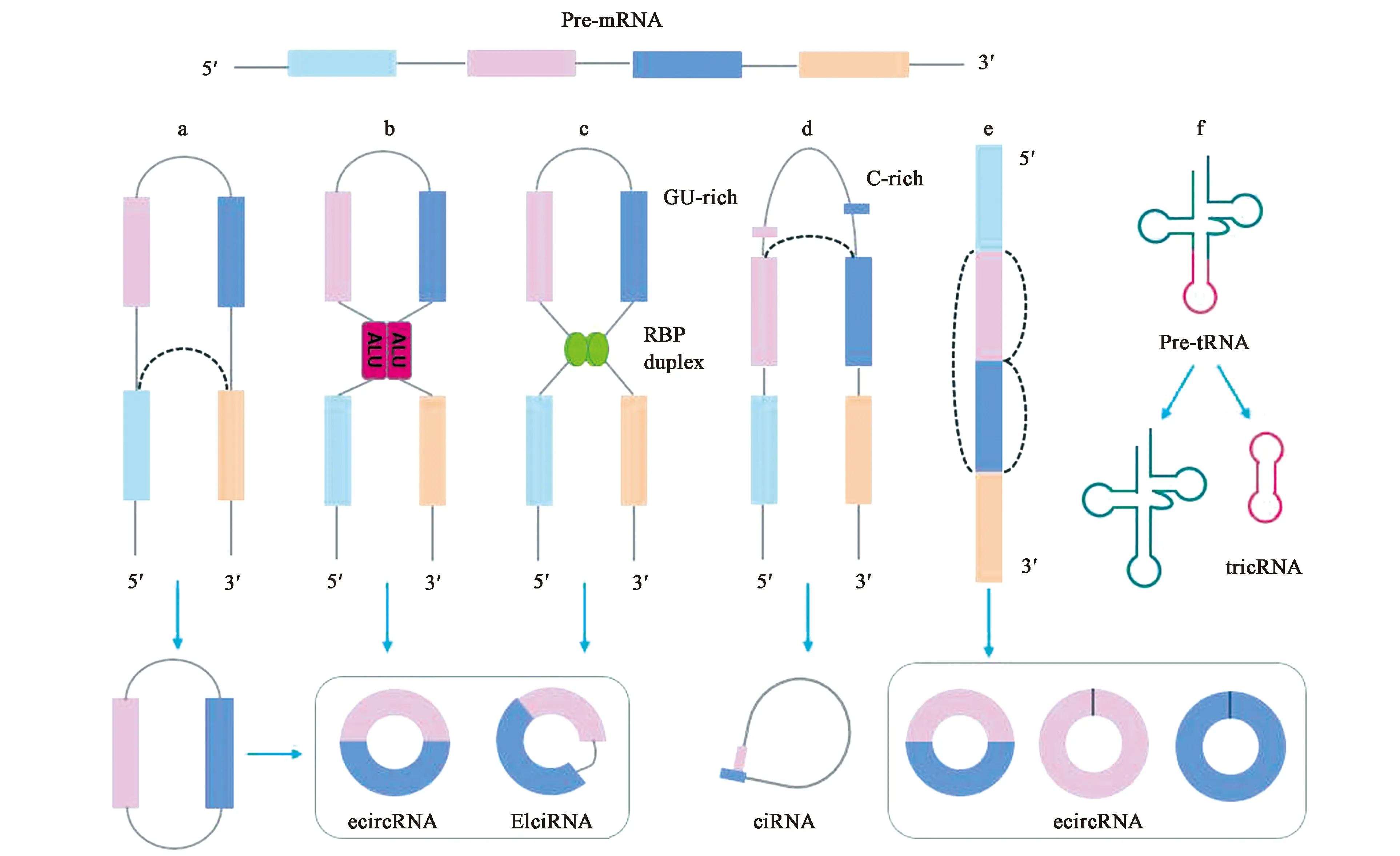
图1 CircRNAs的形成Fig.1 The formation of CircRNAs
1.2 CircRNAs的降解
由于circRNAs没有游离末端,对核糖核酸酶R不敏感,因此不能通过典型的RNA降解途径降解。体外实验研究证明,大多数circRNAs的半衰期(18.8~23.7 h)都长于其线性对应物的半衰期(4.0~7.4 h)[43]。最具特征性的circRNAs降解途径是miRNAs介导的降解,迄今为止唯一的例子是miR-671对ciRS-7的降解,ciRS-7也称为小脑变性相关蛋白1反义转录物(cerebellar degeneration-related protein 1 anti-sense,CDR1as),miR-671以AGO2(Argonaute 2)依赖的方式内切CDR1as,直接调节CDR1as的量,CDR1as中miR-671的结合位点高度保守[14],该位点的缺失导致CDR1as水平显著增加[44]。RNA的N6-甲基腺嘌呤(N6-methyladenosine,m6A)修饰也具有潜在的circRNAs降解作用。m6A修饰广泛存在于circRNAs中[45],Park等[46]研究发现,RNA的m6A修饰可促进招募具有circRNAs降解潜能的核酸内切酶。还有研究显示HeLa细胞被聚肌胞苷酸[poly(I∶C)]刺激或脑心肌炎病毒(encephalomyocarditis virus,EMCV)感染后出现circRNAs的降解现象[47]。另外,胞吐作用也可以将circRNAs从细胞中清除[48]。
2 CircRNAs的生物学功能
2.1 作为miRNAs海绵
研究发现有些circRNAs含有多个miRNAs结合位点,因此推测circRNAs可以作为吸附miRNAs的海绵,抑制miRNAs对靶基因的作用。如CDR1as有73个miR-7的结合位点[14],Piwecka等[49]发现在CDR1as基因敲除小鼠脑中,miR-7的表达量平缓但显著降低,同时miR-7的直接靶基因Fos表达量增强。睾丸特异性circ-SRY中含有16个miR-138结合位点,可以抑制miR-138在细胞中的表达量[14]。CircHIPK3也被证实能与9种miRNAs(miR-124、miR-152、miR-193a、miR-29a、miR-29b、miR-338、miR-379、miR-584和miR-654)相互作用并调节细胞生长[50]。最近有研究证明circ-ITCH通过吸附miR-17和miR-224,上调p21和PTEN的表达,从而抑制膀胱癌病情的发展[51]。
2.2 与RBPs互作
circRNAs还能与RBPs共同作用,调节蛋白质的翻译和细胞周期。HuR是一种被广泛研究的RBPs,可以与多种RNA结合,在转录后水平调控RNA的稳定性和蛋白质表达,CircPABPN1能抑制HuR与核多聚腺苷酸结合蛋白[poly(A) binding protein nuclear1,PABPN1] mRNA的结合,从而降低了PABPN1的表达[52]。另外也有研究发现在小鼠心脏成纤维细胞中,circ-Foxo3通过与p21和周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)结合,形成circ-Foxo3-p21-CDK2三元复合物,抑制了CDK2的活性,进而延缓了细胞周期进程[53]。
2.3 翻译为蛋白质
由于circRNAs缺少翻译所需要的起始元件5′端帽子结构和3′端的poly(A)尾部,所以被认为不具有编码蛋白质的能力。但是早在20世纪80年代就有研究发现,来源于丁肝病毒的circRNAs可以作为翻译模版,合成一段含有122个氨基酸的多肽链[54]。近年来有研究表明circRNAs可被翻译,并且它们的翻译机制不依赖于5′端帽子,而是与内部核糖体进入位点(internal ribosome entry site,IRES)有关。其中许多circRNAs与宿主mRNA使用相同的起始密码子,并具有进化上保守的终止密码子,被与膜偶联的核糖体翻译[55]。m6A是真核生物中最丰富的RNA内部修饰方式[56]。2017年,Yang等[57]首次发现circRNAs包含大量的m6A修饰,能够以不依赖帽子结构的方式进行蛋白质翻译,并且单个m6A位点足以驱动翻译的起始。随后Leginii等[58]对小鼠和人成肌细胞体外分化过程中的circRNAs表达谱进行分析,发现Circ-ZNF609与重链多核糖体相关,并以剪接依赖性和帽依赖性的方式表达出定位于细胞核蛋白质,这项研究为真核细胞内源性circRNAs被翻译成蛋白质的潜力提供了证据。另一项研究显示,circRNAs编码的肽在癌症中具有的潜在分子功能。Circ-FBXW7编码一个21 kD的蛋白质FBXW7-185aa,在癌细胞中上调FBXW7-185aa的表达量,可以抑制细胞增殖和细胞周期的加速[59]。虽然这项研究是基于circRNAs的过表达,但也为circRNAs可编码体内功能性蛋白提供了依据。然而,由于多核糖体相关的circRNA的比例和翻译效率都较低,因此预期circRNAs在生物学相关水平上不会产生许多蛋白质。
2.4 调控亲本基因转录
在各类circRNAs中,ecircRNAs主要分布在细胞质中,而ciRNAs和EIciRNAs在细胞核中含量丰富,研究表明ciRNAs和EIciRNAs在调控亲本基因转录中起着至关重要的作用。Zhang等[39]发现转录和剪接之间的偶联可能允许加工的ciRNA在其亲本基因转录位点累积,与延伸的RNA聚合酶Ⅱ(Pol Ⅱ)复合体缔合增强其转录活性,并以顺式作用方式调节亲本基因的转录。EIciRNA可以在其亲本基因的启动子上与U1小核糖核蛋白(U1-snRNP)结合,EIciRNA-U1 snRNP复合物可能与PolⅡ复合体相互作用以促进宿主基因表达[60]。这些结果说明EIciRNAs和ciRNAs可以促进其亲本基因的转录。此外,ecircRNAs也显示出调节转录的作用。FECR1是来自FLI1的外显子circRNA,分布在细胞质和细胞核中,可以结合FLI1启动子并募集TET1脱甲基酶,诱导启动子的CpG岛DNA去甲基化来顺式调控FLI1转录[61]。
3 CircRNAs的分析方法和数据库
3.1 分析方法
通过RNA测序(RNA-seq)和基因芯片技术(gene chip technology,GCT)可以获取大量的circRNAs。RNA-seq测序不限于检测与现有基因组序列相对应的转录本,且具有背景信号低且灵敏度高的特点,目前构建circRNAs文库的方式分为两种:一种为去除rRNA的文库构建,另一种为去除rRNA和线性RNA的文库构建。前者可同时检测各类RNA的表达水平,便于关联分析,但对低丰度表达的circRNAs不敏感,而后者则更利于检测低丰度表达的circRNAs。基因芯片技术检测效率高,得到的circRNAs数目比RNA-seq更多,然而只能检测已知的circRNAs,因而RNA-seq更适合用于新circRNAs的鉴定。若进一步验证和确认circRNAs差异表达水平,则需对检测出的circRNA进行实时荧光定量PCR(real-time fluorescent quantitative PCR,RT-qPCR)分析,RT-PCR是鉴定circRNA最简单快速的方法[62-63]。CircRNA预测软件有circRNA_finder、find_circ、CIRCexplorer、CIRI、MapSplice、DCC、KNIFE、NCLscan、PTESFinder、UROBORUS、segemehl等,不同的软件使用不同的算法有各自的优点,满足了大部分研究者的需求[64]。
3.2 CircRNA数据库
随着circRNA的研究越来越多,已知的circRNA数据信息也在快速增长,常用的数据库有circBase、circRNABase、circ2Traits、circNet、deepBase v2.0、CircInteractome、circRNADb、CIRCpedia v2、TSCD(tissue-specific circRNA database)、CSCD(cancer-specific circRNA database)、Mi OncoCirc、exoRBase、circRNADisease、AtCircDB、circbank等,各数据库的基本信息见表1。
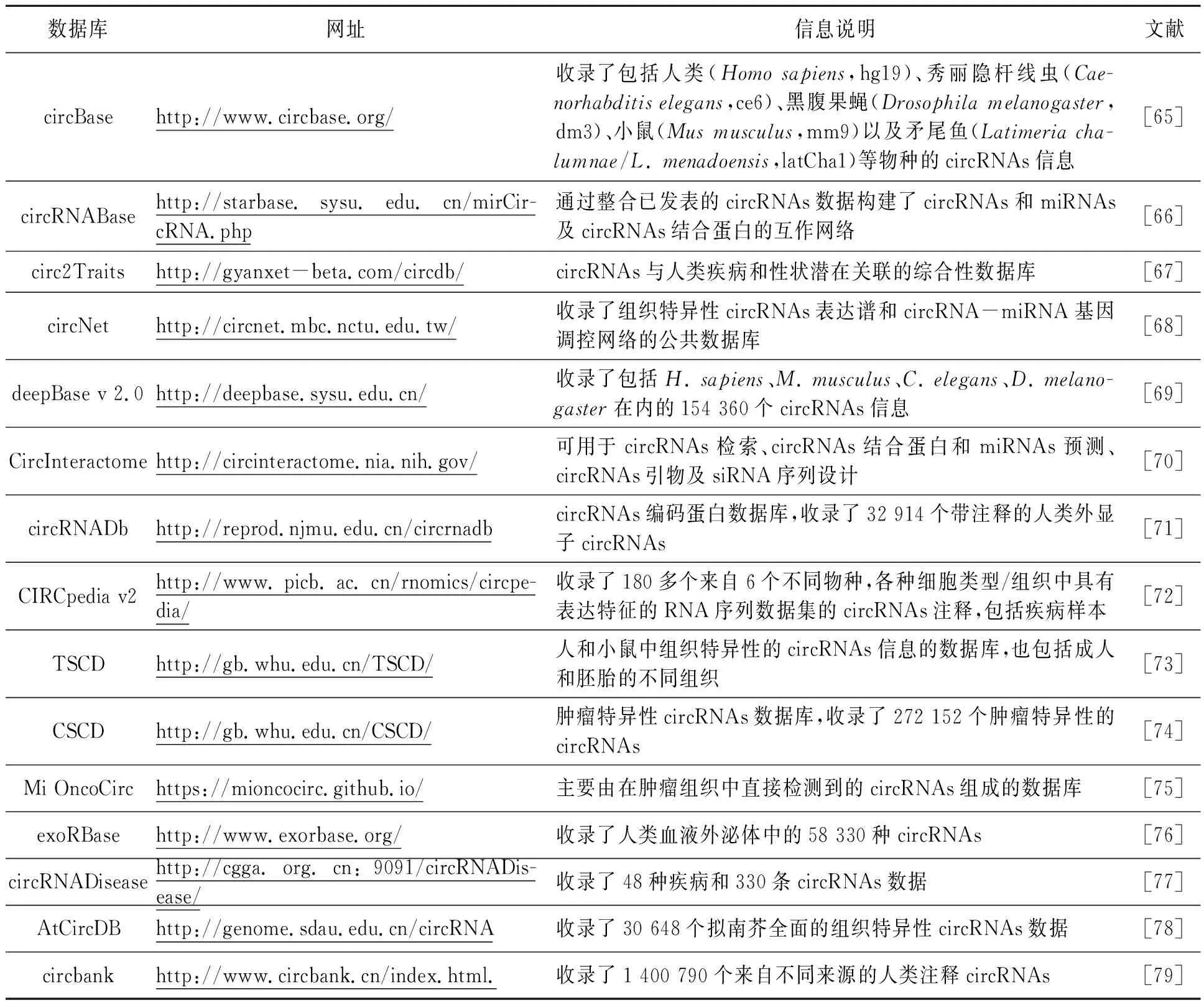
表1 CircRNAs数据库Table 1 Databases for circRNAs
4 CircRNAs在生态毒理学中研究进展
化学物质与生物体的所有初级相互作用都发生在细胞的分子水平上,因此从分子水平上理解生态毒理学是了解毒性机理和提高预测能力的关键[80]。几乎无一例外,基因表达的改变是毒性暴露过程中直接或间接的结果[81]。转录组学方法在生态毒理学中的应用可以从分子机制上理解生物或种群的毒性效应,在时间和空间上架起不同尺度的桥梁,从而弥合分子和生态系统水平之间因果的鸿沟。许多研究已经揭示了非编码RNA在毒性作用中的重要性[82-85],随着circRNAs研究的深入,其在环境化学污染物毒性中的作用也受到广泛关注。
4.1 CircRNAs在有毒有害气体生态毒理学研究中的应用
空气中的有毒有害气体是主要的环境污染物。氡(222Rn)是最臭名昭著的环境放射性气体,已被世界卫生组织(World Health Organization,WHO)归类为致癌物质[86]。氡可从建筑材料和土壤中释放出来并在大气中迅速扩散,通过呼吸系统进入身体后,体内组织器官都可能受到暴露。Pei等[87]将6只小鼠每天暴露于浓度为100 000 Bq·m-3的氡中12 h,累积剂量达60个工作水平月(working level months,WLM)。研究结果表明,氡暴露对小鼠肺组织造成了严重的损伤,对照组和暴露组小鼠肺组织中circRNAs的表达谱显示,氡暴露小鼠肺组织中有107个circRNAs上调及83个circRNAs下调,并预测了前30个上调及下调circRNAs中每个circRNA的5个miRNAs结合位点,发现这些circRNAs和miRNAs可能在氡致肺损伤中发挥重要的协同作用。
氨气(NH3)是畜禽养殖舍内主要的有害气体之一,动物吸入后会刺激呼吸道粘膜并引起肝损伤和繁殖能力下降。Chen等[88]提取了42 d NH3暴露后的鸡胸腺组织进行研究分析,组织病理学结果表明,NH3可导致鸡胸腺炎症性损伤。进一步对转录谱分析发现,NH3暴露降低了鸡胸腺抗氧化相关基因gpx、gst4的mRNA表达,同时增加了炎症相关基因IL-1β、IL-6、IL-8、iNOS的mRNA表达,而且有5个circRNAs基因和100个mRNAs基因表达显著异常。共表达结果显示circRNA-mRNA调控网络与生物体内转录、蛋白质泛素化和降解功能、发育和功能成熟过程及保护细胞免受氧化损伤密切相关。该研究证明circRNAs和mRNAs的共表达参与了NH3暴露诱导的鸡胸腺炎症性损伤。
4.2 CircRNAs在农药生态毒理学研究中的应用
草甘膦(glyphosate)和阿特拉津(atrazine)除草剂是全球广泛使用的农用化学品,在环境中残留量很大,严重影响陆地和水生态系统。体外研究实验表明,草甘膦可通过血脑屏障和胎盘屏障[89],围产期小鼠接触草甘膦会导致子代前额叶皮质中miRNA的差异表达[90]。考虑到circRNAs在基因表达调控中的关键作用,Yu等[91]对围产期小鼠进行50 mg·kg-1·d-1剂量的草甘膦暴露,然后分析暴露组和对照组小鼠海马circRNAs的表达谱。与对照组相比,暴露组中有663个circRNAs表达水平发生了显著变化,其中330个显著上调,而剩余333个显著下调,表明circRNAs在草甘膦诱导的神经毒性中发挥潜在作用。从差异表达的circRNAs中筛选出MMU-circRNA-014015、MMU-circRNA-28128和MMU-circRNA29837进行GO注释和KEGG通路分析,结果显示它们与细胞氮化合物代谢过程、有机物代谢过程、免疫突触和tRNA甲基转移酶活性及醛固酮合成和分泌途径相关,表明这3种circRNAs可能通过调节应激相关的类固醇代谢途径参与草甘膦诱导的神经毒性。circRNAs-miRNA基因网络预测MMU-circRNA-29837可能作为脑损伤相关miRNAs(MMU-miR-7035e5p、MMU-miR3083e5p和MMU-miR-34a-5p)的靶向海绵。上述结果提示,异常表达的circRNA参与了草甘膦诱导的神经毒性,为理解草甘膦暴露诱导的神经毒性分子机制提供了新思路。
阿特拉津是一种环境内分泌干扰物,可诱导许多动物的生殖毒性。Sai等[92]报道阿特拉津暴露引起的circRNAs表达变化与非洲爪蟾睾丸发育毒理密切相关。研究显示,经过180 d 100 μg·L-1阿特拉津的暴露会导致雄性非洲爪蟾(Xenopuslaevis)蝌蚪生殖腺的发育及相关基因表达异常,睾丸中有405个circRNAs差异表达,包括44个上调的circRNAs和361个下调的circRNAs,其中282个差异表达的circRNAs具有miRNAs海绵功能。KEGG通路分析表明,差异表达的circRNAs相关靶基因与Wnt信号通路和孕酮介导的卵母细胞成熟通路有关,可能参与了阿特拉津诱导的睾丸发育异常。
4.3 CircRNAs在抗肿瘤药物的生态毒理学研究中的应用
近年来恶性肿瘤的发病率呈上升趋势,随之而来的是抗肿瘤药物产量和使用量也逐年攀升。抗肿瘤药物的作用机制是通过直接或间接的方式破坏DNA结构,抑制转录,从而影响蛋白质的生物合成,母体药物及代谢产物最终会排放到自然环境中,对非靶标生物具有潜在的毒性风险。雷公藤甲素在多种人类肿瘤中发挥着有效的抗肿瘤活性,是一种很有前途的抗癌新药。然而,动物和人类暴露于雷公藤甲素可能会导致器官损伤,它还通过干扰啮齿类动物的精子产生和精子功能而导致不孕不育。对10周龄雄性C57BL/6J小鼠以50 μg·kg(体重)-1·d-1的雷公藤甲素进行暴露,35 d后与只给予生理盐水(0.9% NaCl)的对照组相比,雷公藤甲素暴露小鼠睾丸重量明显减轻(P<0.05),精子头部和尾部畸形率显著增加(45.75%),睾丸组织学显著改变,如生精细胞减少、管腔缩小、空泡化和其他形态异常。在睾丸中一共检测到33 057个lncRNAs和11 956个circRNAs,经雷公藤甲素暴露后,344个lncRNAs上调,143个lncRNAs下调,对于circRNAs,有374个上调,206个下调;同时,雷公藤甲素可上调2 551个mRNAs,下调1 028个mRNAs。GO和KEGG分析表明,差异表达的lncRNAs靶点、circRNAs同源基因和mRNAs的功能与精子发生的许多过程密切相关,提示circRNAs作为雷公藤甲素雄性生殖毒性的候选标志物具有潜在的应用价值,值得进一步研究[93]。另一项研究报道了抗肿瘤药物米托蒽醌(mitozantrone)对斑马鱼胚胎的毒性作用,并分析了米托蒽醌暴露处理前后斑马鱼胚胎差异性表达的circRNAs,结果显示这些circRNAs的来源基因与ABC转运蛋白、药物代谢、RNA转运和降解以及神经活性配体-受体作用通路相关,表明差异性表达的circRNAs可能参与了斑马鱼胚胎的体内运输以及米托蒽醌诱导的神经毒性作用[94]。
5 展望
生态毒理学研究的核心是环境污染物对生命有机体产生的生物效应。环境化学污染物进入生物体后作用于靶位点,引起分子水平上的改变,进而导致细胞和组织器官受损,最终表现为生理或行为上的变化。而生物标志物是生态毒理学中用于诊断毒性效应的主要技术手段之一,用来指示环境暴露和毒效应之间的关系。目前环境风险评价中的毒性终点普遍基于运动行为、致畸性、死亡率等表型指标,但是考虑到基因的遗传多态性和表观遗传学差异对蛋白质表达的影响,不同物种对环境化学污染物暴露的反应也会存在差异,有可能导致相同的毒性机制却表现出不同的反应。因此,可靠、敏感和特异的分子水平生物标志物可了解和诊断生物体的毒性效应,并快速预测对生态系统的不利影响,对生态毒理研究和环境风险评价具有重要意义。
CircRNAs因其高度的保守性、稳定性以及时空特异性都预示着它有作为分子生物标志物的潜能,上述基于环境化学污染物暴露后生物体内circRNAs的研究结果也表明,经过暴露后生物体内的circRNAs出现差异性表达,暗示了circRNAs参与了环境化学污染物诱导的毒性效应。这提示circRNAs或许可作为生物标志物应用于环境风险评价中。然而,研究circRNAs对环境暴露相关毒性效应的发生和发展作用仍处于初级阶段,未来的研究可针对2个方面:鉴定与毒性效应相关的特异性circRNAs,以及环境化学污染物暴露浓度与circRNAs表达水平间的定量关系。相信随着转录组测序技术的不断发展以及在生态毒理学中的应用,对circRNAs在毒性效应中的作用机制会有更透彻的认识,circRNAs也极有可能作为新型的生物标志物,在环境风险评价中为生态毒理学家和环境学工作者提供新的技术手段与研究方向。
