分级纳米多孔铋电化学传感器用于镉离子的检测
2021-01-27郑亚辉曾和平
郑亚辉, 张 玲, 曾和平
(上海理工大学 光电信息与计算机工程学院,上海 200093)
微量金属元素是生命活动必需的营养元素,如Zn、Fe、Cu 等[1]。然而,有害重金属即使在低浓度时也具有毒性,Cd 尤其令人担忧[2],它存在于各种高毒性环境污染物中[3],会引起骨关节病、自发性骨折、血压升高和心肌功能障碍[4]。因此,对Cd 进行灵敏检测和有效监测极其重要。目前,原子吸收光谱法[5]、电感耦合等离子体质谱法[6]、免疫分析法[7]等多种方法已被应用于Cd 的检测。但是,大多数方法所用仪器体积大、采集速度慢、不易于规模化。相比之下,电化学技术以其低成本、高灵敏度的特点在各个领域都有突出的表现,被认为是一种有效的重金属离子检测方法[8-10]。为了提高电化学传感器的检测能力,需要制备具有高孔隙率、高响应速率的敏感材料。
Bi 具有菱方六面体的晶体结构,其化学稳定性高,且载流子浓度低[11],在相对负电位区具有较宽的可达电位窗口,被认为是一种潜在的环保电极材料。在以往的研究中,薄膜修饰电极和Bi 纳米颗粒被应用于痕量重金属的检测[12-13]。本文以Bi 基双相合金为前驱体,通过一步脱合金法制备了分级纳米多孔铋(hierarchical nanoporous bismuth, HNBi),结合方波阳极溶出伏安(square wave anodic stripping voltammetry, SWASV)法实现了对Cd2+的超灵敏检测。采用HNBi 加工的电化学传感器为重金属离子检测提供了一种可选择的新载体。
1 实 验
1.1 试剂和实验设备
所用盐酸(质量分数为36.0%~38.0%),冰醋酸(质量分数为99.9%),硫酸镉(质量分数为≥ 99.0%),氯化钾(质量分数为≥ 99.5%),氯化钠(质量分数为≥ 99.5%)和无水氯化钙(质量分数为≥ 96.0%)均购于国药集团试剂有限公司。无水乙酸钠(质量分数为≥ 99.0%)购于阿拉丁集团。以上试剂均为分析纯。超纯水电阻率为18.2 MΩ,由实验室自制。试验完毕后所有试剂需进行回收处理。
实验设备:FA1604N 电子天平(上海菁华科技仪器有限公司);SRL-2000 真空感应熔炼炉(上海钜晶精密仪器制造有限公司);VF-RQB20 单辊甩带机(日本真壁技研公司);KQ3200B 超声波清洗器(昆山市超声仪器有限公司);MYP11-2 磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);UPT 超纯水制造系统(成都优普实业有限公司);CHI650E 电化学工作站(上海晨华仪器有限公司);TST-E804-60A 真空干燥箱(东莞市特斯特检测仪器有限公司);Quanta-FEG250 扫描电子显微镜(scanning electron microscope,SEM)(赛默飞世尔科技有限公司);Quasor能谱分析仪(energy dispersive spectrometer,EDS)(赛默飞世尔科技有限公司)。
1.2 HNBi 电极制备
双相合金Mg79Bi21前驱体采用感应炉熔炼合金和真空甩带的方式制备。按照原子配比为79∶21来称量Mg(质量分数为99.9%)和Bi(质量分数为99.9%)金属原料,后将Mg 和Bi 置于真空感应炉中,升温至649 ℃,进行熔炼。将凝固后的合金锭机械打磨以清除表面的氧化层,并放入超声波清洗器中清洗,最后使用高真空单辊甩带机制备合金Mg79Bi21条带。将剪切处理的合金Mg79Bi21条带置于0.06 mol/L 盐酸溶液中腐蚀70 min 获得HNBi 电极(大小为5.00 mm×20.00 mm×0.05 mm)。将制备好的电极用超纯水冲洗后置于真空干燥箱,在80 ℃条件下干燥20 min,取出后保存在干燥柜中备用。使用EDS对脱合金前后电极材料的元素种类与含量进行了分析,电极材料的微观结构采用SEM 进行表征。
1.3 Cd2+检测流程及原理
电化学检测采用三电极体系,HNBi 电极为工作电极,银/氯化银电极为参比电极,铂丝电极为对电极。电解液采用0.2 mol/L 醋酸-醋酸钠溶液,通过将0.2 mL 不同浓度的Cd2+水溶液依次加入装有20 mL 电解液的电解池中来调整电极周围环境中的Cd2+浓度。参照Cd 的标准电极电位(−0.403 V),在负电位的条件下,将Cd 通过Cd2+阴极还原沉积在HNBi 电极上进行预电解,并通过改变沉积电位和沉积时间控制沉积量。Cd 沉积完成后静置30 s,随后采用SWASV 法,用与预电解相反的电极过程将沉积在电极表面的金属进行阳极溶出以实现对Cd2+的定性和定量分析。溶出电位在−1.1~−0.2 V之间,采用正向扫描(频率为15 Hz、电位阶跃为4 mV、振幅为25 mV)得到伏安特性曲线。由于金属元素自身的氧化电位决定了其溶出电位值,以及电流随金属的负载量而变化,因此,溶出峰位与金属种类相关,而电流与沉积金属量相关。通过监测伏安特性曲线中溶出峰的电位位置和电流可实现Cd2+的定性和定量分析。实验步骤和检测原理示意图如图1 所示。

图 1 实验步骤和检测原理示意图Fig.1 Schematic diagram of experimental procedure and detection principle
2 结果与讨论
2.1 能谱分析与微观形貌表征
图2 为脱合金前后的电极材料的EDS 分析结果。从图2 可知:该电极材料中含有Mg 和Bi 2 种元素,Mg 的质量分数为30.43%,Bi 的质量分数为69.57%;脱合金后Mg 的含量为0,电极材料的成分变为单一金属Bi。
使用SEM 在20 kV 下观察脱合金处理后HNBi电极表面的显微组织,如图3 所示。图3 表明,HNBi 电极结构由尺寸400 nm 左右的孔道组成,且孔道壁上有大量小于30 nm 的小孔。该分级纳米多孔结构具有高孔隙率和较宽的电解质通道,孔的大小可以通过改变脱合金时间和腐蚀液浓度来调节[14]。

图 3 HNBi 电极的SEM 图Fig. 3 SEM image of HNBi electrode

图 2 电极材料的EDS 谱图Fig. 2 EDS spectrums of the electrode materials
2.2 优化实验参数
电化学检测是一个动态过程,电流的大小与沉积电位、沉积时间、电解液pH 有关。因此,探究合适的实验参数显得尤为重要。为了在检测过程中获得大的溶出电流,分别对沉积电位、沉积时间和电解液pH 的具体参数进行了优化。优化实验参数之前,HNBi 电极需在电解液中不存在其他重金属离子的情况下进行预沉积,以排除其他物质的伏安信号对待检测物质的干扰,确保对Cd2+检测的准确性。图4所示为HNBi 电极在不含Cd2+电解液中的预沉积信号(空白组)及在含有10−7mol/L Cd2+电解液中的沉积结果(实验组)。由图4 可知,含有Cd2+的电解液中在−0.78 V 处出现明显的氧化峰,而不含Cd2+的电解液中则没有发现任何氧化峰,因此,以HNBi 为工作电极,在−0.78 V 处的氧化峰对应为Cd2+,该电极对Cd2+检测不存在干扰。
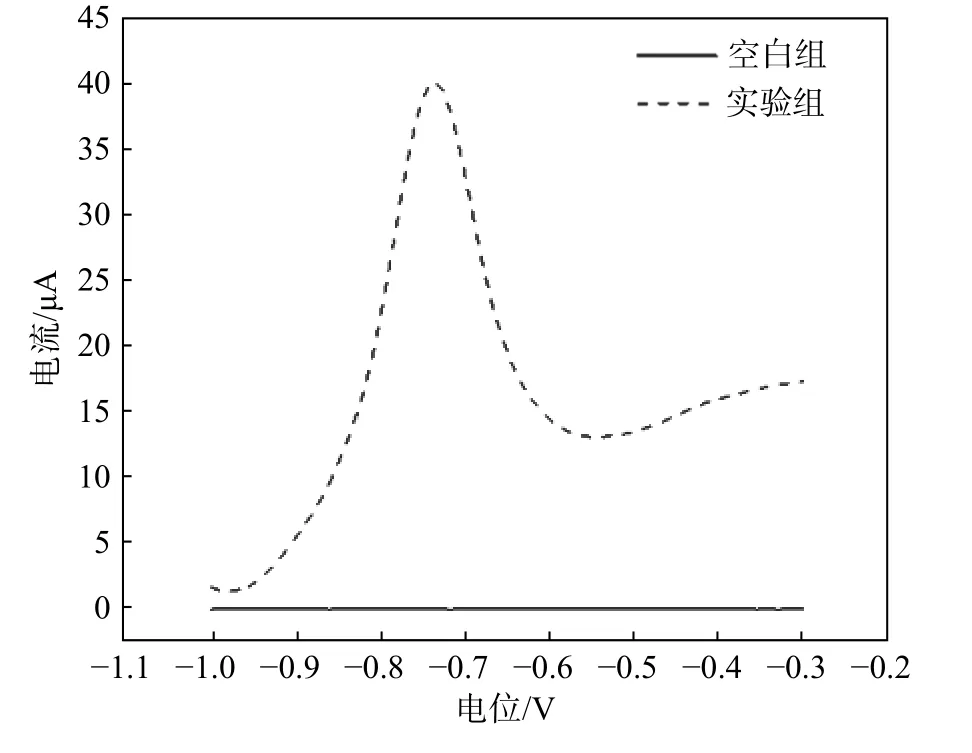
图 4 预沉积实验Fig. 4 Predeposition experiment
由于Cd2+检测的直观表现为溶出电流,而溶出电流与沉积电位和沉积时间相关。图5(a)为在含有10−7mol/L Cd2+的电解液中,采用不同电位、相同时间沉积Cd 时沉积电位与电流的关系图。由图5(a)可知,当沉积电位由−1.0 V 变为−1.2 V 时,溶出电流增大;而继续向负电位增大电压到−1.4 V 时,溶出电流减小。导致电流减小的可能原因为:沉积电位低于氢的析出电位(−0.8 V)时,氢气会在HNBi 电极表面产生,沉积电位越负析出氢气量越多,沉积电位为−1.4 V 时电极表面析出的氢气不能充分扩散[15],在电极表面形成了气体层,进而影响Cd2+的沉积量,导致最终溶出电流下降。因此以HNBi 为工作电极进行Cd2+检测时,最佳沉积电位为−1.2 V。
采用相同的沉积电位时,沉积时间越长则沉积金属总量越多,因此合适的沉积时间对提高SWASV 检测灵敏度也很重要。为了确定沉积时间和电流的关系,固定沉积电位在−1.2 V,从100 s 到350 s 调整沉积时间,每次改变50 s,图5(b)为沉积时间与电流的关系图。通过线性关系式(1)可确定最佳沉积时间。

式中:K 为斜率;ΔI 为电流的变化量;ΔT 为时间的变化量。
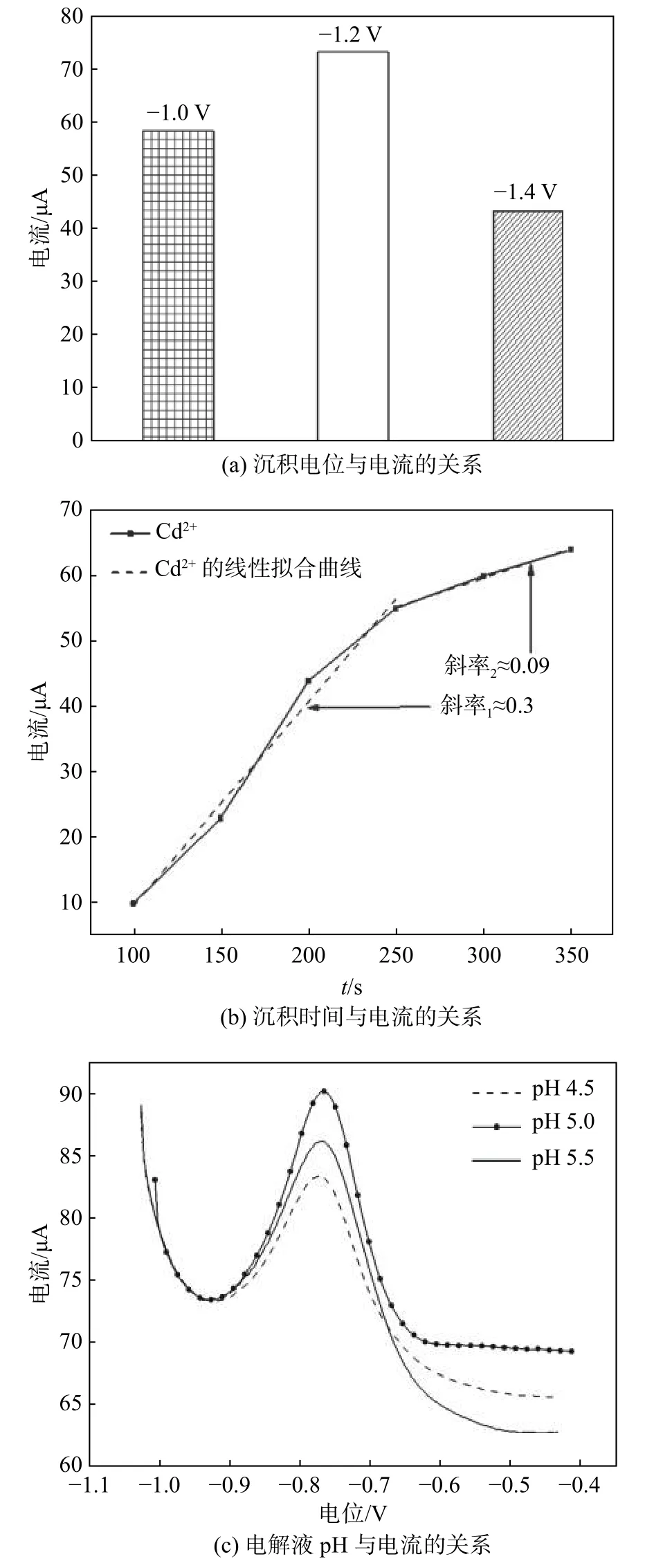
图 5 实验参数的优化Fig. 5 Optimization of experimental parameters
由图5(b)可知,沉积时间从100 s 到250 s 时,由斜率的线性关系式(1)可得斜率约为0.30,当沉积时间从250 s 到350 s 时,斜率下降至约0.09。斜率的变化表明Cd2+的沉积速度不是恒定的,它与电极的表面条件有关。随着Cd2+的积累,HNBi 电极逐渐被Cd 金属覆盖,可能会造成介孔以及纳米孔堵塞,进而降低沉积速率。基于以上分析,沉积时间选择250 s。
由于金属离子在电极上的沉积强烈依赖于电解液pH[16],研究了pH 为4.5、5.0、5.5 的醋酸-醋酸钠电解液(0.2 mol/L)对电流的影响。图5(c)为电解液pH 与电流的关系图。配制电解液所需实验试剂用量可通过式(2)计算得出:
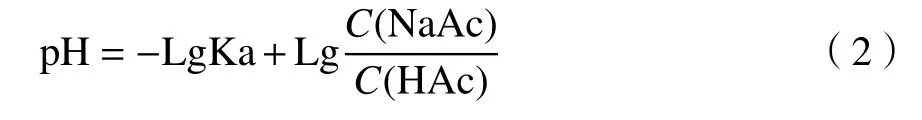
式中:pH 为电解液的酸碱度;Ka 为醋酸的解离常数;C(NaAc)为醋酸钠的浓度;C(HAc)为醋酸的浓度。
由图5(c)可知,电流随着电解液pH 从4.5 到5.0而增大,电流随着电解液pH 从5.0 到5.5 而减小。电流的增大是由于Cd 完全电离成阳离子形式,在HNBi 电极表面发生强络合作用和静电吸引导致[17];而金属离子水解则会减弱电流[18]。因此,确定最佳电解液pH 为5.0。
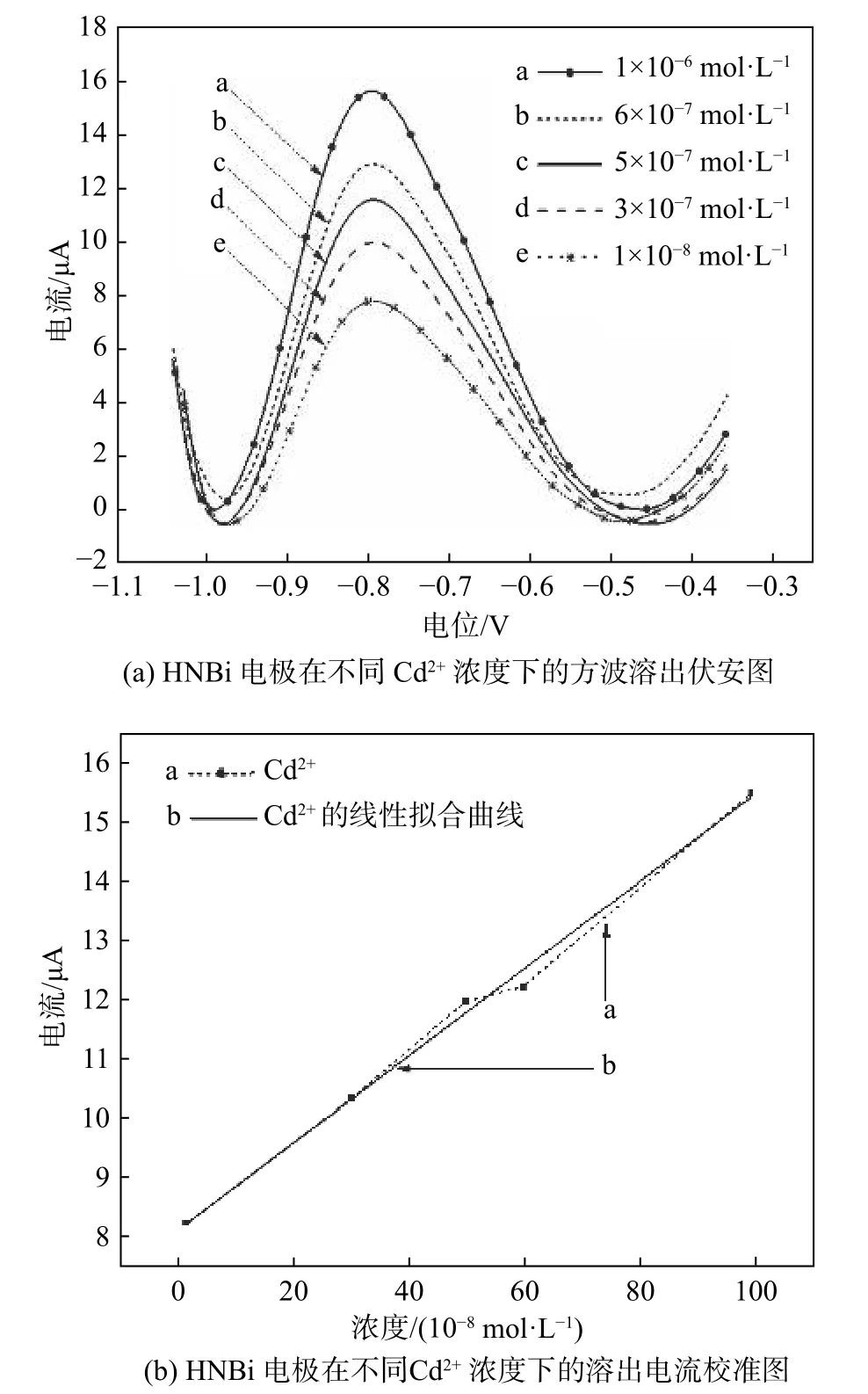
图 6 HNBi 电极在不同Cd2+浓度的电解液中进行SWASV 法测定Fig. 6 SWASV measurements of the HNBi electrode in the electrolytes with different concentrations of Cd2+
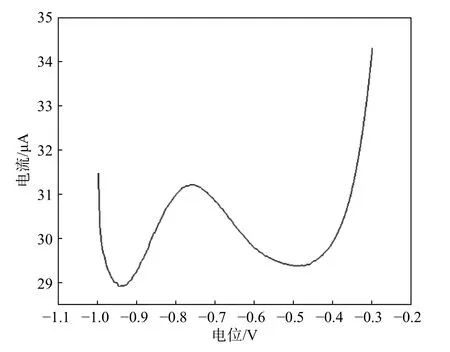
图 7 HNBi 电极在含有10-9 mol/L Cd2+的电解液中进行SWASV 法测定Fig. 7 SWASV measurements of the HNBi electrode in the electrolyte with the Cd2+ concentrations of 10-9 mol/L
2.3 线性关系和检测极限
在电化学检测过程中,电极的动态监测范围及检测极限对其具体应用领域有着一定的影响,因此采用优化后的测试参数对HNBi 电极的线性动态响应范围及检测极限进行了测定。图6 为HNBi 电极在含有10−8mol/L 至10−6mol/L Cd2+的电解液中进行SWASV 测定的结果。图6(a)显示了电流的变化随电解液中Cd2+浓度的变化关系,采用式(3)对实际测试点进行校准所得线性拟合曲线如图6(b)所示。

式中:I 为电流;C 为电解液中Cd2+的浓度;方程的相关系数为0.994 2。
由图6(b)可见,当Cd2+浓度介于10−8mol/L 至10−6mol/L 时,表现出较好的线性关系。
图7 为HNBi 电极在含有10−9mol/L Cd2+的电解液中进行SWASV 测定的结果。由图7 可知,通过增加沉积时间可以进一步提高灵敏度。调整沉积时间为300 s,检测含有10−9mol/L Cd2+的电解液,仍然可以得到明显的氧化峰。说明HNBi 电极的检测极限低于10−9mol/L。
3 结 论
本文通过一步脱合金法制备了HNBi 电极,为重金属离子电化学传感器开发提供了新的材料和方法。同时,该传感器具有良好的灵敏度,对Cd2+的检测结果表现出明显的氧化溶出峰,在浓度为10−8mol/L 至10−6mol/L 时 具 有 较 好 的 线 性 响应。通过控制Cd2+的沉积时间,可以进一步提高检测范围,检测极限低于10−9mol/L。此外,结合方波阳极溶出伏安法该电极可用于其它重金属离子检测,具有广泛的应用范围。
