藏药秦艽花黄酮体外诱导肿瘤细胞凋亡的研究
2021-01-26刘相海
刘相海,李 琦,刘 群
(西南民族大学生命科学与技术学院,四川 610041)
筛选和评价药物的抗肿瘤作用具有体外和体内两种研究方法。体内研究方法主要考察药物对机体肿瘤免疫相关活性细胞和肿瘤免疫相关因子的影响等,体外研究方法主要考察肿瘤细胞对药物的敏感性,如药物抑制肿瘤细胞的生长和药物诱导肿瘤细胞凋亡等[1-3]。体外研究抗肿瘤药物的关键是要选择增殖快、生长稳定、对药物敏感的瘤细胞株系。体外研究主要选用腹水瘤、白血病、各种实体瘤细胞株系,如S180小鼠腹水瘤细胞株、Hepa1-6小鼠肝癌细胞株、L1210小鼠白血病细胞株、B16-F10小鼠黑色素瘤细胞株、SP2/0小鼠骨髓瘤细胞株等[4-7]。目前在天然药物抗肿瘤研究领域,植物多糖和黄酮类化合物对肿瘤细胞的促凋亡作用研究受到国内外广泛关注,并已成为肿瘤治疗的重要手段之一[8-9]。本研究以藏药秦艽花黄酮为研究材料,以S180、Hepa1-6、L1210、B16-F10、SP2/0瘤细胞株为研究对象,CCK-8、AO/EB、Annexin V/PI结合流式细胞术为研究手段,瘤细胞形态、瘤细胞生长抑制率、瘤细胞凋亡率为检测指标,探讨藏药秦艽花黄酮促肿瘤细胞凋亡的作用,为藏药开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 受试药物 藏药白花秦艽(GentianamacrophyllaPall.)花为龙胆科麻花秦艽的干燥花,采集于四川甘孜色达地区(由西南大学园艺园林学院李先源鉴定),室温通风干燥,避光保存;秦艽花黄酮(藏药秦艽花总黄酮提取工艺条件:乙醇体积分数45%、提取温度60 ℃、提取时间30 min、料液比1∶25,黄酮实际得率22.13 mg/g),4 ℃冰箱避光保存。
1.1.2 瘤细胞株 S180小鼠腹水瘤细胞株、Hepa1-6小鼠肝癌细胞株、L1210小鼠白血病细胞株、B16-F10小鼠黑色素瘤细胞株、SP2/0小鼠骨髓瘤细胞株。由国家细胞共享资源库提供,冻存(75%的基础培养基+5%的DMSO+20%的FBS)。
1.1.3 主要试剂 细胞增殖-毒性检测试剂盒 (Cell Counting Kit-8),北京四正柏生物科技有限公司产品;Annexin V-FITC/PI Kit 凋亡检测试剂盒,北京四正柏生物科技有限公司产品;活细胞/凋亡细胞/坏死细胞鉴别试剂盒,江苏凯基生技术股份有限公司产品。
1.1.4 主要仪器设备 荧光倒置显微镜(1X73),日本奥林巴斯公司产品;流式细胞仪(CytoFLEX),美国贝克曼库尔特有限公司产品;离心机(TGL-16),四川蜀科仪器有限公司产品;水浴锅(HWS-26),上海一恒科学仪器有限公司产品;超净工作台(BBS-DDC),济南鑫贝西生物技术有限公司产品;生物安全柜(BSC-1100),济南鑫贝西生物技术有限公司产品。
1.2 方法
1.2.1 瘤细胞复苏和传代 冻存细胞,37 ℃水浴解冻,细胞培养液37 ℃、5% CO2培养箱培养过夜,待细胞长融合度为80%左右时,传代并进行细胞计数。根据瘤细胞生长特性,S180、L1210细胞悬浮培养传代;Hepa1-6、B16-F10、SP2/0细胞贴壁培养传代。
1.2.2 瘤细胞生长抑制作用检测 采用CCK-8法检测秦艽花黄酮对瘤细胞生长的抑制作用[10-13]。采用等比设计,确定敏感瘤细胞株。收集处于对数生长期的瘤细胞并制成1×105/mL的细胞悬液于96孔板内进行试验。具体试验分组和处理如下:
空白对照组:100 μL培养液、10 μL CCK-8溶液、无细胞、无受试药物,用作调零;阴性对照组:100 μL培养液、10 μL CCK-8溶液、细胞、无受试药物;阳性对照组:100 μL培养液、10 μL CCK-8溶液、细胞、10 μL凋亡诱导剂(5-FU);受试药物组:100 μL培养液、10 μL CCK-8溶液、细胞、10 μL受试药物(受试药物组的受试药物为不同浓度的秦艽花黄酮溶液1 000.0、100.0、10.0、1.0、0.1 μg/mL)。
1.2.2.1 操作步骤 按照“细胞增殖-毒性检测试剂盒”操作进行,酶标仪测定450 nm处的吸光度值(650 nm波长作为参考波长进行双波长测定,即检测波长450 nm~490 nm,参比波长600 nm~650 nm)。
1.2.2.2 检测指标 瘤细胞生长抑制率=(Ac-As)/(Ac-Ab)×100%。As为受试药物孔OD值(含有细胞的培养基、CCK-8、受试药物);Ac为阴性对照孔OD值(含有细胞的培养基、CCK-8、无受试药物);Ab为空白对照孔OD值(不含细胞和受试药物的培养基、CCK-8)。
5种瘤细胞株系中,选取细胞生长抑制率最高的细胞株,作为受试药物相对敏感瘤细胞株系并进行后续试验研究。
1.2.3 瘤细胞凋亡形态学检测 采用AO/EB染色法,结合荧光显微镜,对敏感瘤细胞进行凋亡形态学检测[14-16]。试验分组如下:阴性对照组为瘤细胞、培养液、10 μL AO/EB染色混合液、无药物;阳性对照组为瘤细胞、培养液、10 μL AO/EB染色混合液、凋亡诱导剂(5-FU);受试药物组为瘤细胞、培养液、10 μL AO/EB染色混合液、受试药物(受试药物组的受试药物为不同浓度的秦艽花黄酮溶液1 000.0、100.0、10.0、1.0、0.1 μg/mL)。
1.2.3.1 操作步骤 在6孔板中配制成2.5 mL细胞悬液(细胞数2.5×106个/每孔),根据上述试验分组,按照细胞悬液总体积5%~10%比例加入相应药物(125 μL~250 μL),细胞培养箱孵育24 h~48 h,诱导细胞凋亡;PBS洗涤细胞两次并配制成 5×105个/mL~6×106个/mL的细胞悬液;将染料试剂1和染料试剂2等体积混合配制成形成混合染料试剂;吸取25 μL的细胞悬液和1 μL的混合染料试剂,轻轻混匀;吸取上述10 μL的混合液,置于洁净载玻片上,盖玻片盖上细胞;最后在荧光显微镜(激发波长510 nm)下观察敏感瘤细胞形态。
1.2.3.2 观察指标 正常细胞,细胞结构正常,核质体绿染,单一大小形状;凋亡早期细胞,不规则形细胞,核质体绿染;凋亡晚期细胞,核质体橙染,染色质浓缩,核碎裂成点状,大小不一,有突起芽状胞质;坏死细胞,椭圆形细胞,核质体橙染,单一大小形状。
1.2.4 瘤细胞凋亡检测(流式细胞术) 采用Annexin-V/PI双染法,结合流式细胞仪,检测瘤细胞凋亡[1,17-18]。试验分组结果分阴性对照组:50 μL培养液、瘤细胞、Annexin-V/PI工作液;阳性对照组:50 μL培养液、瘤细胞、Annexin-V/PI工作液、凋亡诱导剂(5-FU);受试药物组:50 μL培养液、瘤细胞、Annexin-V/PI工作液、受试药物(受试药物组的受试药物为不同浓度的秦艽花黄酮溶液1 000.0、100.0、10.0、1.0、0.1 μg/mL),其中瘤细胞浓度为1×106个/mL~5×106个/mL。
1.2.4.1 操作步骤 按照Annexin-V/PI双染法操作步骤进行,流式细胞仪检测瘤细胞凋亡。具体如下:调节电压,空白管:阴性对照细胞,不加Annexin V/FITC、碘化丙锭PI溶液;调节补偿,单染管:阳性对照细胞,只加Annexin V/FITC;用空白管和单染管调节好电压补偿后,检测管:处理的细胞,加Annexin V/FITC、碘化丙锭PI溶液,获得所需要的流式数据)。
1.2.4.2 观察指标 根据Annexin V/PI双染法检测瘤细胞凋亡原理,经流式细胞仪分析获得4个象限组成的直方图,其中,左下象限R3代表正常活细胞,Annexin V-FITC-/PI-;右下象限R4代表早期凋亡细胞,Annexin V-FITC+/PI-;右上象限代表坏死细胞或晚期凋亡细胞,Annexin-V-FITC+/PI+;左上象限代表细胞收集过程中出现的损伤细胞,Annexin-V-FITC-/PI+。
1.2.5 数据分析 采用SPSS18.0软件对进行统计分析,数据均以“平均数±标准差”表示,对数据进行t 检验,采用方差分析和多重比较进行统计分析。
2 结果
2.1 瘤细胞生长抑制作用
CCK-8法,检测不同浓度秦艽花黄酮(1 000.0、100.0、10.0、1.0、0.1 μg/mL)分别对5种瘤细胞(S180、Hepa1-6、L1210、B16-F10、SP2/0)的生长抑制作用,细胞抑制率(平均值)结果见表1。

表1 肿瘤细胞株生长抑制率
由表1表明,经统计学分析,秦艽花黄酮在1 000.0 μg/mL浓度时,对S180细胞生长的抑制效果相对较好,达到19.00%;秦艽花黄酮在0.1 μg/mL~100 μg/mL低浓度内对L1210细胞的抑制作用随浓度升高而抑制作用下降,但1 000.0 μg/mL浓度时抑制作用又明显增加,达到18.20%;秦艽花黄酮在1 000.0 μg/mL浓度时对HEPA1-6、B16-F10抑制率分别是-13.24%、-11.43%,说明秦艽花黄酮对HEPA1-6、B16-F10细胞生长表现为小剂量抑制效果;秦艽花黄酮在1 000.0 μg/mL浓度时抑制作用最大,达到达到36.45%。
综上所述,秦艽花黄酮在低浓度范围内(0.1 μg/mL~100 μg/mL)随着黄酮浓增加抑制作用下降,但在1 000.0 μg/mL高浓度时对S180、L1210、SP2/0瘤细胞抑制作用明显增强,其抑制率分别为19%、18.2%和36.45%,结合阳性药物5-Fu对SP2/0瘤细胞的生长抑制率(86.91%)显著高于其他4种瘤细胞的生长抑制率,考虑到秦艽花黄酮1 000.0 μg/mL浓度对SP2/0瘤细胞的生长抑制效果相对较好,故选择SP2/0瘤细胞作为敏感瘤细胞进行后续研究。
2.2 SP2/0瘤细胞凋亡形态学
SP2/0瘤细胞继续贴壁培养,经AO/EB染色,510 nm荧光显微镜下观察,细胞凋亡形态学结果见图1A、图1B和图1C。
图1A表示阴性对照组无明显凋亡细胞,细胞仍保持原有的生长形态,表现为圆形细胞、细胞核完整、结构正常、被染成均一绿色、绿色荧光弥散均勾、色泽均一(个别细胞凋亡可能是由于收集细胞过程中损伤所致);图1B表示阳性对照组出现明显的凋亡细胞,大多数被染成红色并出现染色体凝集、细胞核固缩、凋亡小体等凋亡形态学特征;图1C表示1 000.0 μg/mL黄酮组出现明显大量凋亡细胞,细胞体积变小、皱缩状、橙色,细胞核裂解等。
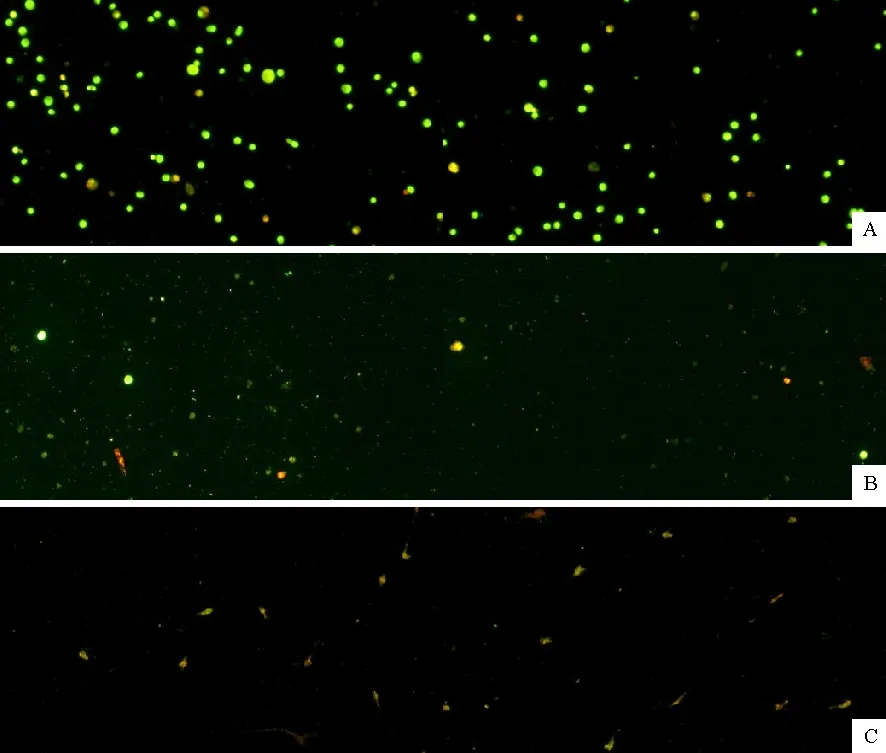
A.阴性对照组;B.阳性对照组;C.1 000.0 μg/ mL黄酮A.Negative control group; B.Positive control group; C.1 000.0 μg/mL flavonoids
2.3 SP2/0瘤细胞凋亡率
SP2/0瘤细胞为秦艽花黄酮相对敏感细胞,浓度为1 000 μg/mL时生长抑制率最大、凋亡形态明显。为进一步探讨秦艽花黄酮诱导SP2/0瘤细胞凋亡作用的发生,采用等差法梯度调整黄酮浓度为250、500、750、1 000 μg/mL,通过Annexin-V/PI双染法结合流式细胞术,将活细胞、早期凋亡细胞、晚期凋亡细胞及坏死细胞区分开,根据凋亡散点图(细胞凋亡散点图中,其左上象限(Q1)表示死亡细胞,右上象限(Q2)表示晚期凋亡或死亡细胞,左下象限(Q3)表示活细胞,右下象限(Q4)表示早期凋亡细胞),统计出各自百分比。统计右上象限(Q2)的晚期凋亡细胞和右下象限(Q4)的早期凋亡细胞百分比之和,计算出3次重复试验的平均值,获得秦艽花黄酮对SP2/0瘤细胞的诱导凋亡率。结果见表2和图2。
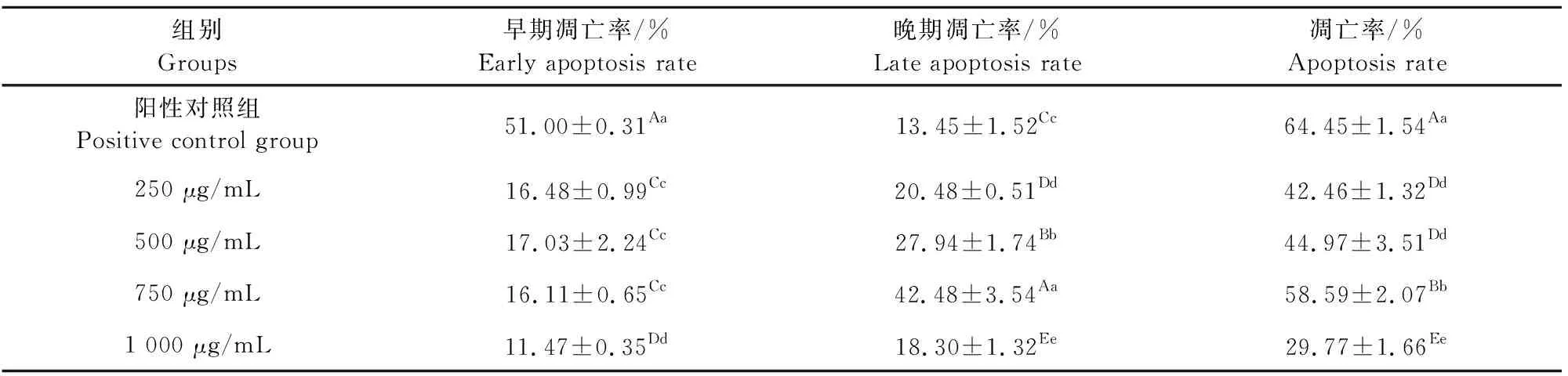
表2 SP2/0细胞的凋亡率
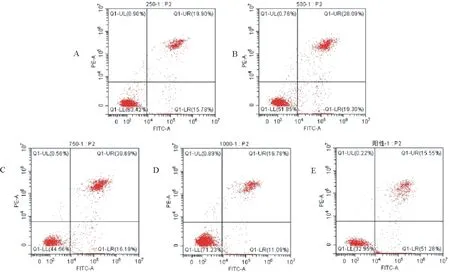
A~E.黄酮250 μg/mL、黄酮500 μg/mL、黄酮750 μg/mL、黄酮1 000 μg/mL、阳性药物A-E.Flavonoids 250 μg/mL,flavonoids 500 μg/mL,flavonoids 750 μg/mL,flavonoids 1 000 μg/mL,positive drug
表2表示,经统计学分析,阳性药物组诱导SP2/0细胞凋亡率达到64.45%;当秦艽花黄酮浓度在250 μg/mL~750 μg/mL范围内递增时,细胞凋亡率呈剂量依赖递增,分别为42.46%、44.97%和58.27%,750 μg/mL浓度时细胞凋亡率达到最大(58.27%);阳性药物组早期凋亡率极显著(P<0.01)高于秦艽花黄酮各浓度组,随着秦艽花黄酮浓度的增加,250、500 L、750 μg/mL的3个浓度组早期凋亡细胞率无显著性差异(P>0.05),且均显著高于1 000 μg/mL浓度组的早期凋亡率(P<0.05);4个黄酮浓度组晚期凋亡细胞率均显著高于阳性药物组的晚期凋亡率(P<0.05),且随着黄酮浓度的增加,250 μg/mL、750 μg/mL浓度组的晚期凋亡率均极显著高于1 000 μg/mL浓度组(P<0.01),其中750 μg/mL浓度组的晚期凋亡率达到42.54%;随着黄酮浓度的增加,总的细胞凋亡或死细胞率在250 μg/mL~750 μg/mL浓度区间逐渐增加,750 μg/mL浓度最高达到58.27%。结合图2,阳性药物诱导小鼠骨髓瘤细胞凋亡率(包括死细胞)为64.45%,以早期细胞凋亡明显(51.00%);750 μg/mL浓度的秦艽花黄酮诱导小鼠骨髓瘤细胞凋亡率(包括死细胞)为58.27%,以晚期细胞凋亡明显(42.54%)。
3 讨论
3.1 细胞凋亡及检测
细胞凋亡是受基因调控的一种程序性死亡,以形成细胞膜、细胞质皱缩和细胞核固縮的凋亡小体为显著形态特征。目前通常以细胞生长、形态学、凋亡率筛选和评价药物体外诱导肿瘤细胞凋亡的作用。CCK-8试剂中含有水溶性四唑,水溶性四唑(2-(2-甲氧基-4-硝基苯)-3-(4-硝基苯)-5-(2,4-二磺基苯)-2 H-四唑单钠盐)类似于MTT,在电子耦合剂存在时很容易被线粒体脱氢酶还原成甲臜染料(formazan)并溶解,培养基呈橙黄色,由于颜色深浅与培养基中活细胞数量呈线性关系,当细胞越多、增殖速度越快,则培养基的颜色越深(反之则颜色越浅),因而CCK-8法可用于药物对细胞进行增殖和药物毒性分析。细胞凋亡早期,染色质、细胞质固缩、细胞膜完整具有选择透通性;凋亡后期,核染色质裂开并与某些细胞器聚集,被细胞膜包围和分离形成凋亡小体;由于吖啶橙(dye reagent 1,AO)能透过完整的细胞膜,即透过活细胞膜并嵌入细胞核与双链DNA结合发出绿色荧光,正常活细胞核及处于凋亡早期的细胞核呈现绿色;溴化乙锭(dye reagent 2,EB)仅能透过受损细胞膜,嵌入核DNA发出橘红色荧光,死亡细胞及凋亡晚期的细胞核呈橙色;经AO/EB染料染色后,荧光显微镜下可观察到四种细胞,即活细胞、早期凋亡细胞、晚期凋亡细胞和非凋亡的死亡细胞,因此AO/EB法可用于对正常细胞、凋亡细胞和坏死细胞的形态区别。细胞凋亡早期,细胞膜内侧的磷脂酰丝氨酸(PS)翻至外侧,早于核染色质皱缩,PS与Ca2+依赖性磷脂结合蛋白的Annexin V有高度亲和力,于凋亡早期细胞外侧结合,虽然PS翻转在细胞坏死中也发生,但凋亡早期细胞膜完好而坏死细胞已被破坏;碘化丙啶(PI)不能通过完整的细胞膜,但对中晚期凋亡细胞和死亡细胞,PI透过透性增加或通过被破坏的细胞膜进入并与细胞核结合呈红色荧光;AnnexinV-FITC与PI联合应用,由于PI不能染色早期凋亡细胞和活细胞,FITC和PI结合可同时染色坏死细胞和晚期凋亡细胞,呈双阳性,在待测细胞被两种染色剂处理后,可在凋亡不同时期呈现不同荧光颜色,借助流式细胞仪可以将细胞分为若干亚群,因此AnnexinV-FITC/PI双染法结合流式细胞术可用于细胞凋亡率的检测。
3.2 秦艽花黄酮诱导瘤细胞凋亡作用
研究表明,大多数抗癌药物都能引起其敏感瘤细胞凋亡的发生实现抗肿瘤效果,如植物多糖、姜黄素、白黎芦醇等通过死亡受体途径、线粒体途径、κB途径、PI3K/Akt信号途径等诱导细胞凋亡的发生[19-20]。本研究以S180、Hepa1-6、L1210、B16-F10、SP2/0瘤细胞株为研究对象,CCK-8、AO/EB、Annexin V/PI结合流式细胞术为研究手段,瘤细胞形态、瘤细胞生长抑制率、瘤细胞凋亡率为检测指标,研究秦艽花黄酮促肿瘤细胞凋亡的作用。CCK-8结合AO/EB研究表明,秦艽花黄酮在低浓度范围内(0.1 μg/mL~100 μg/mL)随着浓增加,虽然抑制瘤细胞生长作用下降,但1 000.0 μg/mL高浓度时对S180、L1210、SP2/0瘤细胞抑制作用明显增强,尤其是对SP2/0瘤细胞的生长抑制率达36.45%,结合阳性药物5-Fu对SP2/0瘤细胞的生长抑制率(86.91%)显著高于其他4种瘤细胞的生长抑制率以及1 000 μg/mL黄酮药物组SP2/0(AO/EB染色)出现明显大量凋亡细胞,细胞体积变小、皱缩状、橙色,细胞核裂解等,选择SP2/0瘤细胞作为秦艽花黄酮敏感瘤细胞进行后续研究;Annexin V/PI双染法结合流式细胞术研究表明,随着秦艽花黄酮浓度的增加,250、500、750 μg/mL这3个浓度的早期凋亡细胞率无明显差异,但晚期细胞凋亡率均显著高于5-FU,且随着黄酮浓度的增加,3个浓度的晚期凋亡率均极显著高于1 000 μg/mL浓度,其中750 μg/mL浓度的晚期凋亡率达到42.54%,750 μg/mL浓度的总的细胞凋亡或死细胞率达到58.27%。研究结果表明,秦艽花黄酮(750 μg/mL)通过诱导SP2/0瘤细胞晚期凋亡达到接近阳性药物5-FU的诱导凋亡作用。
秦艽花黄酮具有诱导SP2/0瘤细胞凋亡的作用并呈剂量依赖性特点,浓度在750 μg/mL通过诱导晚期瘤细胞凋亡达到接近阳性药物5-FU(主要诱导瘤细胞早期凋亡)的诱导凋亡效果,为中西药联合用药治疗肿瘤疾病提供了科学依据。
