湖北省猪2型链球菌的分布及耐药性分析
2021-01-26刘泽文袁芳艳周丹娜杨克礼段正赢田永祥
刘泽文,袁芳艳,刘 威,高 婷,周丹娜,杨克礼,段正赢,郭 锐,梁 婉,田永祥
(农业农村部畜禽细菌病防治制剂创制重点实验室/湖北省农业科学院畜牧兽医研究所,湖北武汉 430064)
猪链球菌(Streptococcussuis,SS)是一种可引起人兽共患传染病的重要动物病原菌,该菌按荚膜抗原共分为35个血清型,其中猪2型链球菌(Streptococcussuistype 2,SS2)是其中致病力最强的一种,该菌不但能引起猪的急性败血症、脑膜炎、关节炎甚至死亡[1-2],给养猪业造成很大经济损失,同时也可导致养猪从业人员感染和死亡,因此对其进行预防和控制研究十分必要。本研究从湖北多个地市的发病猪场采集病料,分离鉴定猪2型链球菌16株,并进行全部分离菌株的药敏试验,旨在为临床控制链球菌病提供用药指导。
1 材料与方法
1.1 材料
1.1.1 培养基 胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB),青岛海博生物技术有限公司生产,按说明书配制、灭菌后加入50 mL/L的小牛血清。
1.1.2 标准菌株 猪SS2标准菌株,由国药集团动物保健股份有限公司提供。
1.1.3 药敏纸片 头孢呋辛、头孢曲松等药敏纸片,杭州滨和微生物试剂有限公司产品;氟苯尼考药敏纸片,Oxoid公司产品,按药敏纸片生产公司提供的标准判断结果。
1.1.4 主要试剂和仪器设备 2×TaqMaster mix(Dye plus),Vazyme公司产品;新生牛血清,浙江杭州生物科技股份有限公司产品;Applied Biosystems PCR仪,Life technologies公司产品;凝胶成像系统,上海勤翔科学仪器有限公司产品;净化工作台,上海龙跃仪器设备有限公司产品;隔水式恒温培养箱,上海精宏实验设备有限公司产品。
1.2 方法
1.2.1 病料采集和培养 采集湖北武汉、黄石、黄冈、十堰、荆州等地市发病猪的脑、关节液、心血和肺等,接种于TSA平板,37 ℃培养24 h后,挑选带蓝光的单个菌落,再接种TSA培养基,37 ℃培养24 h。
1.2.2 染色和镜检 挑选纯化培养的细菌进行涂片,革兰氏染色,显微镜下观察细菌形态,挑选呈短链、长链状球菌为疑似猪链球菌进行下一步鉴定。
1.2.3 PCR鉴定
1.2.3.1 PCR引物和PCR扩增 按文献[3]合成引物并进行PCR扩增,PCR产物电泳,凝胶成像系统扫描照相。猪链球菌鉴定引物(SS-1和SS-2)扩增长度566 bp,猪2型链球菌鉴定引物(SS2-1和SS2-2)扩增长度498 bp。
1.2.3.2 猪链球菌的PCR鉴定 挑选疑似猪链球菌的48株纯培养物于无菌水中,100 ℃煮沸10 min~15 min作为PCR 模板。用SS-1和SS-2引物进行PCR扩增,PCR产物电泳,凝胶成像系统扫描照相。
1.2.3.3 猪2型链球菌菌株的PCR鉴定 以SS2-1、SS2-2引物对鉴定为猪链球菌阳性样品模板进行PCR扩增,PCR产物电泳,凝胶成像系统扫描照相。
1.2.4 分离菌株的生化鉴定 将PCR鉴定呈阳性的猪2型链球菌接种改良TSB培养基,37 ℃振摇培养18 h~20 h,分别接种糖发酵和其他生化试验培养基小管,每管0.2 mL,37 ℃培养,观察结果。
1.2.5 分离菌株的药敏试验 将分离纯化的菌株按常规方法进行药敏试验[4]。
2 结果
2.1 菌落形态和染色特性
分离的疑似猪链球菌菌落直径针尖大小、灰白色、半透明、表面光滑、圆形、边缘整齐(图1);革兰氏染色后显微镜下观察,可见革兰氏染色阳性、单个、成对或成链状排列的球菌(图2)。
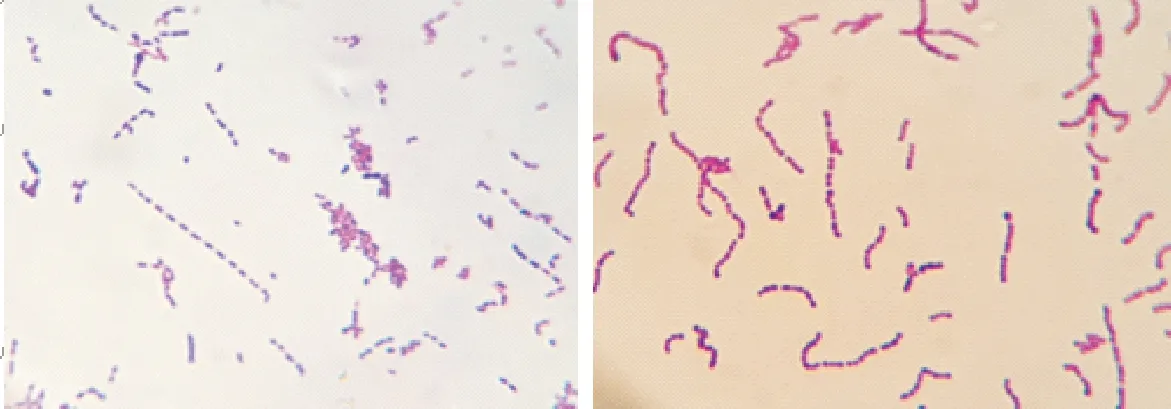
图2 分离菌株革兰氏染色结果
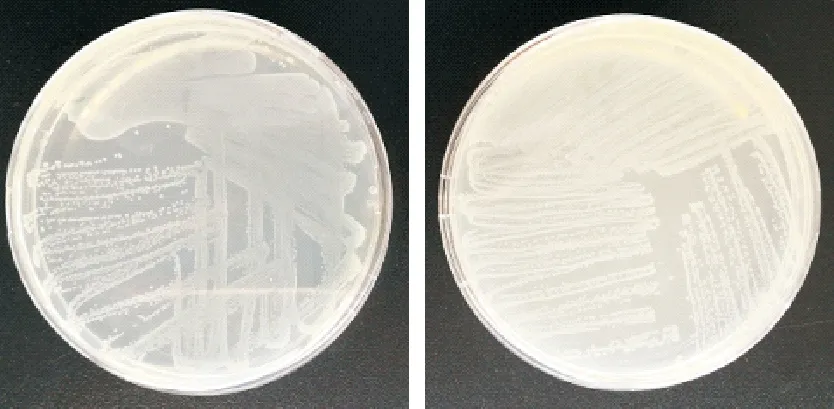
图1 分离菌株菌落形态
2.2 猪链球菌PCR鉴定结果
对革兰氏染色疑似猪链球菌的48株分离菌株用猪链球菌鉴定引物进行PCR扩增,结果有34株分离菌株扩增到目的条带(图3),鉴定为猪链球菌,其病料来源和分离部位见表1。
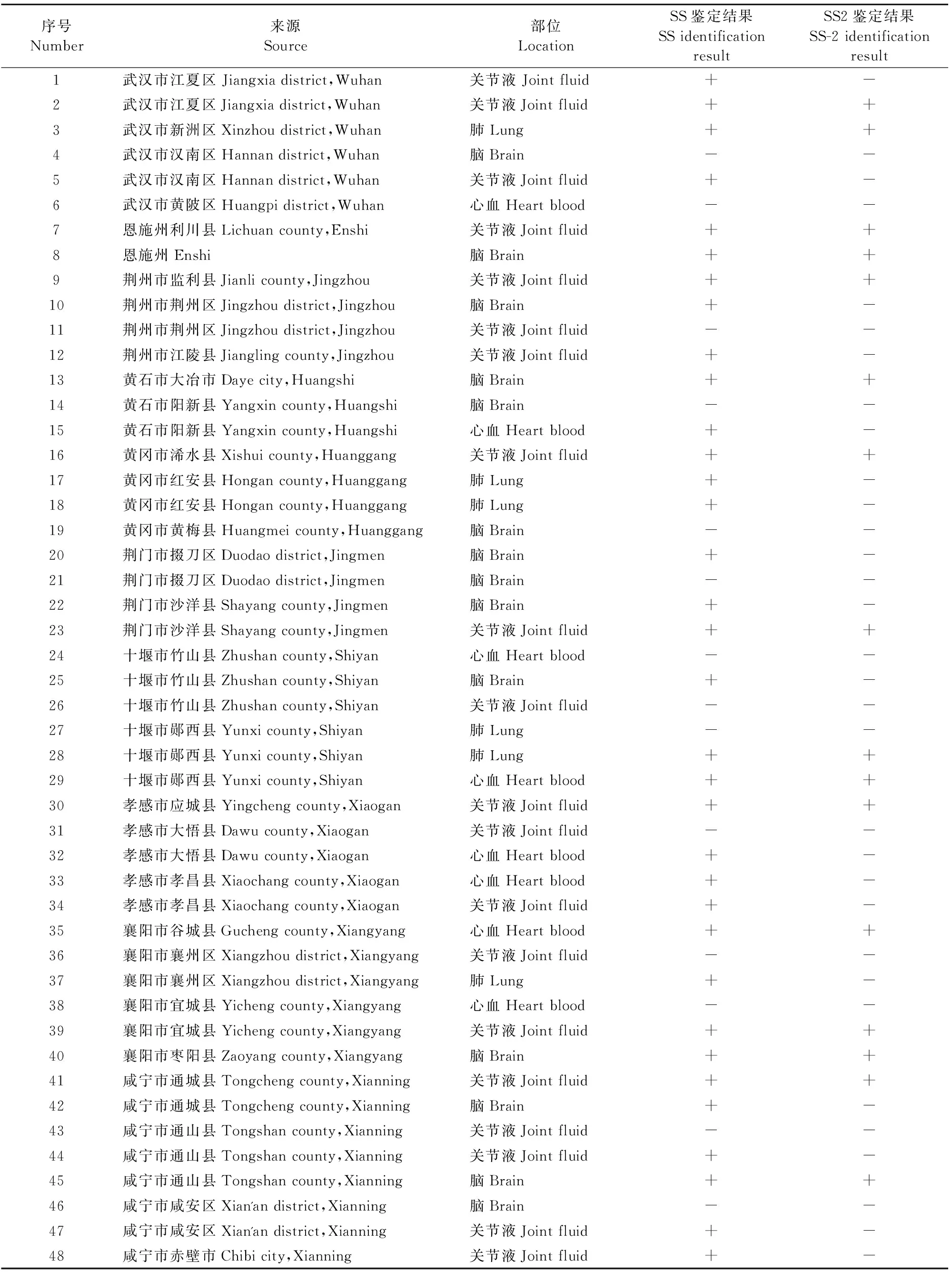
表1 病料来源及部位
2.3 猪2型链球菌PCR鉴定结果
对经PCR鉴定为猪链球菌的34株分离菌株用SS2型引物进行PCR扩增,结果有16株分离菌株扩增到目的条带(图4),鉴定为猪2型链球菌。

M.DNA标准DL 2 000; P.阳性对照; 1~34.分离菌株M.DNA Marker DL 2 000; P.Postive control; 1-34.Isolated strains
2.4 生化鉴定结果
挑选鉴定为猪2型链球菌菌株进行生化鉴定,其生化鉴定结果符合猪链球菌生化特性(表2)。
2.5 药敏试验结果
分离菌株药敏试验结果显示,分离的猪链球菌对头孢呋辛、头孢曲松、阿莫西林和氨苄西林全部高度敏感,对林可霉素、依诺沙星、洛美沙星、卡那霉素、四环素、阿米卡星、庆大霉素和磺胺异恶唑等全部耐药(表3)。
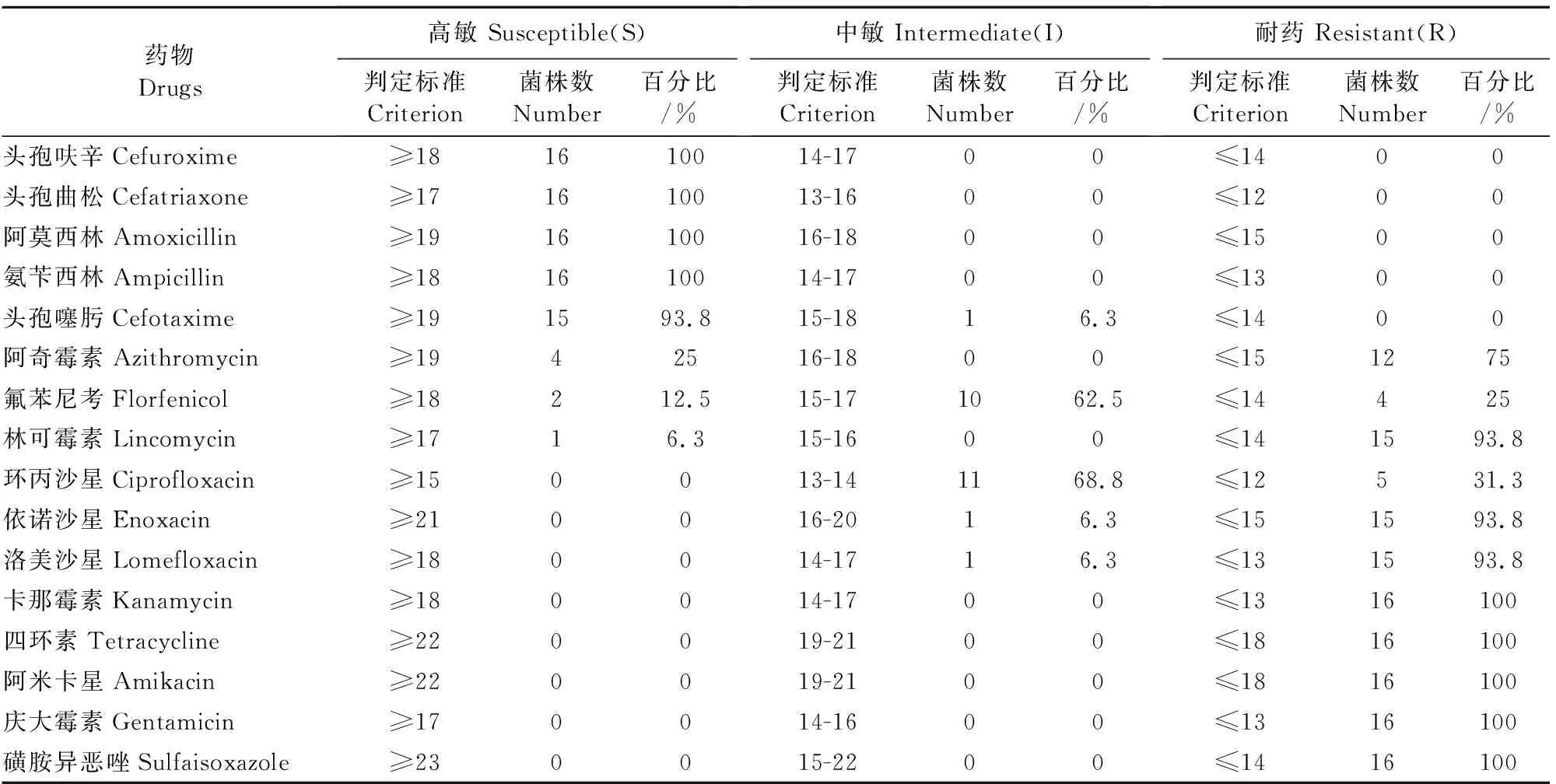
表3 药敏试验结果
3 讨论
猪链球菌是世界范围内猪链球菌病主要病原[5],该病呈世界范围流行,严重危害养猪业的发展[6]。我国于1990年首次报道广东省有该病的发生[7]。近年来,猪链球菌病的发病呈上升趋势[8-10],该病往往发病急,死亡快,给养殖业带来了重大的经济损失,其中猪链球菌临床检出率最高、毒力最强的血清型是猪2型链球菌[11-12]。猪2型链球菌又是重要的人畜共患病原菌,可引起脑膜炎、感染性休克,严重时可致人死亡。该病自丹麦1968年首次报道以来[13],我国和世界其他地方多次出现猪2型链球菌感染人的报道[14-15]。因此,猪链球菌病不仅对养猪业造成重大经济损失,也给公共卫生和食品安全带来了严重危害,需要对此病的流行引起高度重视。我国已将猪链球菌病列为二类动物疫病。
从湖北武汉、宜昌、十堰等10个地区的29个县(市、区)的48份样品中分离出猪2型链球菌16株,占全部分离链球菌的47.1%,说明湖北省猪链球菌中主要以2型链球菌为主导。16株2型链球菌分布于湖北省10地区的15个县(市、区),调查结果表明,猪2型链球菌在湖北省各地分布广泛,随着环境条件改变及猪群免疫力降低,容易造成猪链球菌病的发生,因此对猪链球菌的防治应该引起足够的重视。
通过对16株2型链球菌分离菌株的药敏试验,结果显示全部菌株对头孢呋辛、头孢曲松、阿莫西林和氨苄西林的高度敏感;对卡那霉素、四环素、阿米卡星、庆大霉素和磺胺异恶唑全部耐药,16株分离菌株耐药在7种和11种之间。结果说明,分离的猪2型链球菌存在严重的多重耐药性,因此临床上对于猪链球菌病的治疗,在早期可采用2种~3种药物进行试验性治疗,在病情得到确诊以后,应当先进行细菌的药敏试验,筛选敏感药物进行治疗,以免延误治疗时机。同时在使用药物进行猪链球菌病预防时,可采用几种药物交替使用,避免长期使用同一种药物,以防细菌产生耐药性。