新疆株猪圆环病毒3型Cap基因的序列分析及原核表达
2021-01-26屈勇刚谷思颖杨慧敏吴圆圆于会举
任 敏,屈勇刚,魏 其,谷思颖,杨慧敏,吴圆圆,于会举
(1.石河子大学动物科技学院,新疆石河子 832003;2.巴音郭楞职业技术学院生物工程系,新疆库尔勒 841002)
猪圆环病毒(Porcine circovirus,PCV)在世界各国养猪业中普遍存在,对免疫器官有严重的侵害性,可导致机体免疫系统被抑制,对国内外养殖业造成了巨大的经济损失。猪圆环病毒3型(Porcine circovirus type 3,PCV3)是近年新发现的病毒,在美国报道本病与猪皮炎和肾病综合征、繁殖障碍等临床症状有关[1],目前已有多个国家以及我国多个省市发现该病毒的存在[2-9]。2017年,在我国广东省某猪场中首次鉴定到PCV3,随后华中农业大学对全国11个省的样本进行检测,PCV3的阳性率高达68.6%。已有报道从中国21个省份(即广东、广西、安徽、重庆、福建、河北、河南、湖南、湖北、江苏、江西、辽宁、沈阳、吉林、浙江、山东、甘肃、内蒙古、北京、四川和云南)的商业养猪场发现PCV3。该病给养猪业带来了巨大的威胁,也给该病的防控工作带来了巨大挑战。猪圆环病毒Cap蛋白是病毒的结构蛋白,含有多个抗原表位,宿主细胞和病毒的结合与Cap蛋白密切相关。湛洋等[10]通过对PCV3 Cap结构及抗原性分析发现,PCV2和PCV3氨基酸同源性仅为30.0%,表现出很大的差异,推测PCV2和PCV3不具有交叉免疫保护的特性。本试验通过扩增新疆株PCV3 Cap基因,在对Cap基因序列分析、二级结构和抗原表位预测的基础上,构建原核重组质粒pET30a-PCV3-Cap,进行原核表达。通过人工诱导原核表达新疆株PCV3 Cap重组蛋白,可为日后PCV3的基因工程亚单位疫苗的研制和血清学诊断方法的建立提供生物学材料。
1 材料与方法
1.1 材料
1.1.1 病料 采集新疆某猪场病死仔猪肝脏组织样品,低温冰箱保存待用。
1.1.2 主要试剂 大肠埃希氏菌感受态细胞Trans1-T1和E.coliBL21(DE3)、载体 pEASY-Blunt Simple和pET30a(+),北京全式金生物技术有限公司产品;限制性内切酶NdeⅠ和Hind Ⅲ、T4 DNA连接酶、Prime STAR酶,宝生物工程(大连)有限公司产品;抗体His-Tag(27E8)Mouse mAb和Anti-mouse IgG、HRP-linked Antibody,Cell Signaling Technology公司产品;DNA回收试剂盒和质粒提取试剂盒,天根生化科技有限公司产品。
1.1.3 主要仪器 PCR仪,杭州博日科技有限公司;凝胶成像分析系统,Molecular Imager公司产品;垂直电泳仪,Cleaver公司产品。
1.2 方法
1.2.1 目的基因的扩增和克隆 根据GenBank中PCV3全基因组序列,设计1对扩增Cap全基因的引物,引物序列分别为P1:5'-GGAATTCCATATGTTAGAGAACGGACTTGTAACGA ATC -3'(下划线处为NdeⅠ酶切位点);P2: 5'-CCCAAGCTTATGAGACACAGA GCT ATATTCAGA-3'(下划线处为Hind Ⅲ酶切位点),预计扩增片段大小为645 bp,引物由北京华大基因科技有限公司合成。以PCV3阳性病料总核酸为模板,扩增PCV3 Cap基因,反应体系:Prime STAR酶25 μL,上、下游引物(P1、P2)各2 μL,模板2 μL,ddH2O补至50 μL;扩增程序:98 ℃ 30 s,55.4 ℃ 40 s,72 ℃ 40 s,共35个循环;72 ℃ 10 min。将回收的扩增产物克隆至pEASY-Blunt Simple载体,阳性质粒由北京华大基因科技有限公司测序鉴定,将测序鉴定正确的重组质粒命名为Blunt Simple-PCV3 Cap。
1.2.2 PCV3 Cap基因序列分析 使用MegAlign和MEGA 6.06软件将本试验所获Cap基因核苷酸序列与国内外PCV3参考序列进行序列分析,序列比对用clustal W算法,构建系统发育树用Neighbor-joining方法。
1.2.3 Cap蛋白结构及抗原表位预测 根据对Cap蛋白二级结构、亲水性/疏水性、可及性、可塑性和抗原指数的预测与分析,并结合软件BepiPred 2.0的结果对Cap蛋白抗原表位进行了预测。
1.2.4 pET30a-PCV3-Cap 重组质粒的构建 将1.2.1中获得的Blunt Simple-PCV3 Cap和pET-30a(+)载体用NdeⅠ和Hind Ⅲ进行双酶切,质粒24 μL,NdeⅠ和Hind Ⅲ限制性内切酶各4 μL,10 mol/L buffer 8 μL,用ddH2O补足50 μL。37 ℃ 酶切1.5 h,酶切产物用琼脂糖凝胶电泳验证,纯化回收目的片段。按照T4 DNA连接酶试剂盒使用说明进行连接并转化Trans1-T1感受态细胞。进行PCR和测序鉴定,将测序正确的重组质粒命名为pET30a-PCV3-Cap。
1.2.5 pET30a-PCV3-Cap诱导表达 将构建好的pET30a-PCV3-Cap重组质粒转化到BL21(DE3)感受态细胞中,然后均匀涂布到LB平板上(含50 μg/mL的硫酸卡那霉素),之后倒置于37 ℃培养箱过夜,挑取单克隆,接种到4 mL的LB培养基中(含50 μg/mL的硫酸卡那霉素),待培养至OD 600 nm为0.5~0.8,向试管培养液中加入终浓度0.2 mmol/L IPTG,之后分别置于15 ℃、37 ℃诱导表达16 h。
1.2.6 SDS-PAGE分析鉴定诱导表达 取诱导后的培养物12 000 r/min离心5 min,去除上清液,加入PBS重悬沉淀,最后加入SDS-PAGE上样缓冲液于100 ℃下加热样品10 min,然后离心取上清电泳。制胶两块,80 V、30 mA电泳,待溴酚蓝带迁移至离凝胶底部1 cm,取出一块凝胶用考马斯亮蓝染色液染色,随后转入脱色液中,脱色至背景清晰,另一块用做Western blot鉴定。
1.2.7 Western blot鉴定 用湿转法将蛋白转印至NC膜,在含有50 g/L脱脂奶粉的平皿中室温摇床上封闭2 h,鼠抗His标签抗体(His-Tag Mouse mAb)用TBST按1∶1 000稀释,作为一抗孵育膜2 h,抗鼠IgG抗体(Anti-mouse IgG,HRP-linked Antibody)用TBST按1∶3 000稀释,作为二抗孵育膜1 h。进行Western blot鉴定,验证重组蛋白的抗原性。
2 结果
2.1 目的基因扩增结果
以阳性病料总核酸为模板,P1和P2为引物,扩增出与预期大小一致的特异性条带,为645 bp,并获得Cap基因序列,登录号QGM49266.1(图1)。
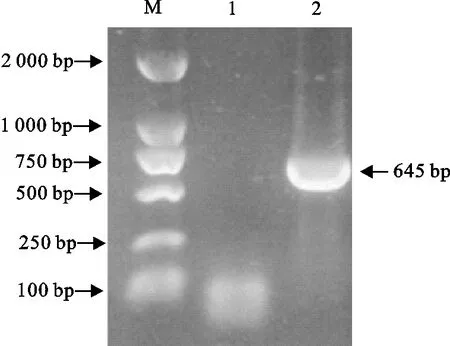
M.DNA 标准DL 2 000;1.阴性对照;2.样品M.DNA Marker DL 2 000;1.Negative control;2.Samples
2.2 PCV3 Cap基因序列分析
本试验PCV3 Cap基因核苷酸序列与国内外参考序列对比分析,进化树结果显示分为两个分支,本试验China-Xinjiang株与俄罗斯株在同一分支,而与中国广东株及其他国家的Cap基因序列不在同一分支(图2)。核苷酸同源性分析可见,同源性为98.0%~98.6%,与瑞典株同源性最高98.6%,与泰国株最低98.0%(表1)。China-Xinjiang与其他国家毒株相比,一共有7个氨基酸突变位点(24、27、29、56、75、77和150),可以看出各毒株氨基酸差异不大(表2)。

表1 PCV3 Cap核苷酸序列同源性分析
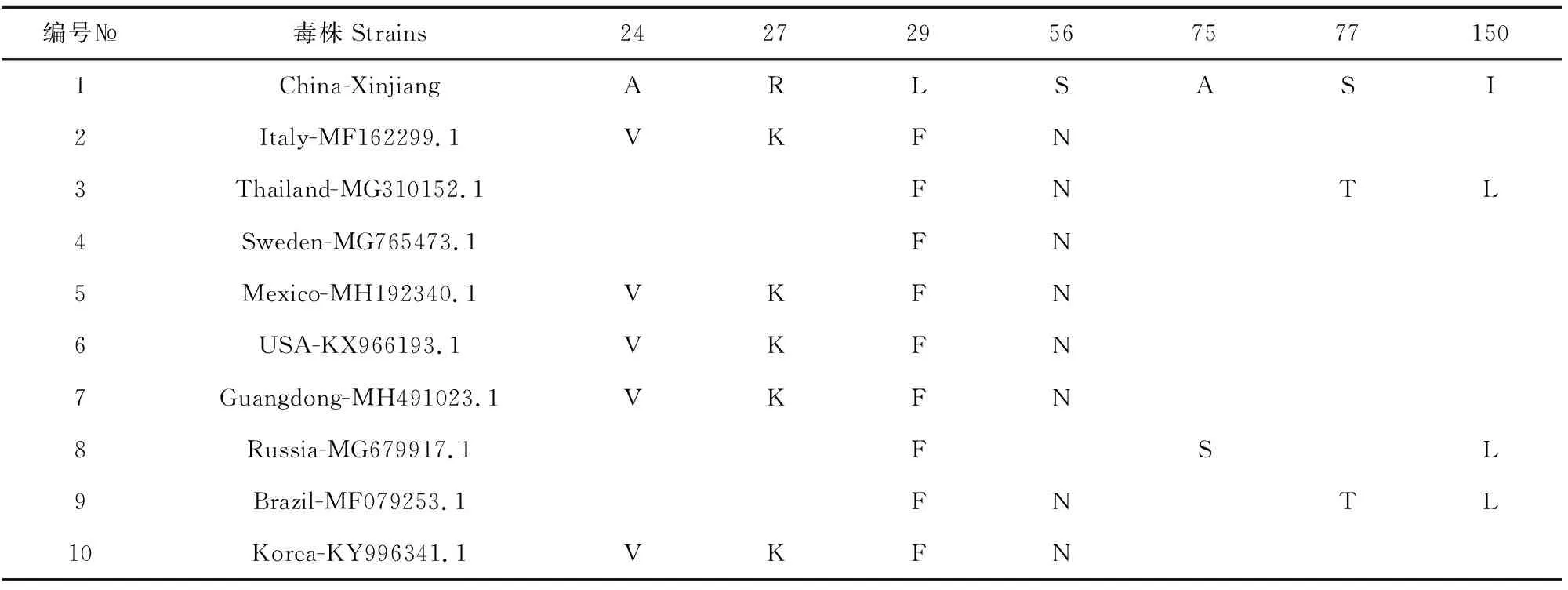
表2 PCV3 Cap氨基酸突变位点
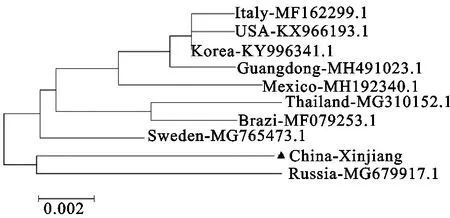
图2 PCV3 Cap基因遗传进化树
2.3 Cap蛋白结构及抗原表位预测结果
用Kyte-Doolittle方法分析了Cap结构蛋白的亲水性,结果表明,在氨基酸序列的187位的W处为最大值1.633,疏水性最强,在18位的R处为最小值4.356亲水性最强,表现为亲水性的区域是5-31、33-46、53-78、81-83、95-104、114-147、155-160、168-181、191-203和205-209aa,总体来看,PCV3 Cap氨基酸的大部分为亲水性氨基酸,所以整个多肽链表现为亲水性(图3)。根据对信号肽及跨膜区域的预测,结果显示无信号肽和跨膜区域(图4和图5)。

图3 PCV3 Cap氨基酸序列的疏水性/亲水性分析
图4 PCV3 Cap氨基酸序列信号肽的预测

图5 PCV3 Cap氨基酸序列跨膜区域预测
用Chou-Farplus方法分析PCV3 Cap蛋白的二级结构,发现有3个α 螺旋区域(0-8、59-72、106-109aa) ,有8个β 折叠区域(25-31、44-51、73-94、114-123、134-137、162-167、178-193、203-214aa)(图6)。

图6 PCV3 Cap蛋白二级结构预测
用Emini方法预测了结构蛋白的可及性区域为8-26、31-34、37-44、54-60、68-73、78-80、97-101、119-146、167-178、191-197aa,以10-20、22-24、40、56、130和140残基周围可及性程度相对较高,可能位于PCV3 Cap蛋白表面(图7)。而氨基酸残基8-21、32-38、39-44、52-59、95-101、115-120、122-133、135-142、146-149、153-162、168-172、175-178、192-199、201-204,可能具有一定的柔韧性(图8)。

图7 PCV3 Cap蛋白表面可及性分析

图8 PCV3 Cap蛋白柔性区域分析Fig.8 Protein flexible region analysis of PCV3 Cap
用Jameson-Wolf方法预测了蛋白的抗原指数,2-9、5-47、53-61、70-75、95-103、109-114、120-150、155-161、168-172、174-179和191-209aa为抗原指数较高区域(图9)。
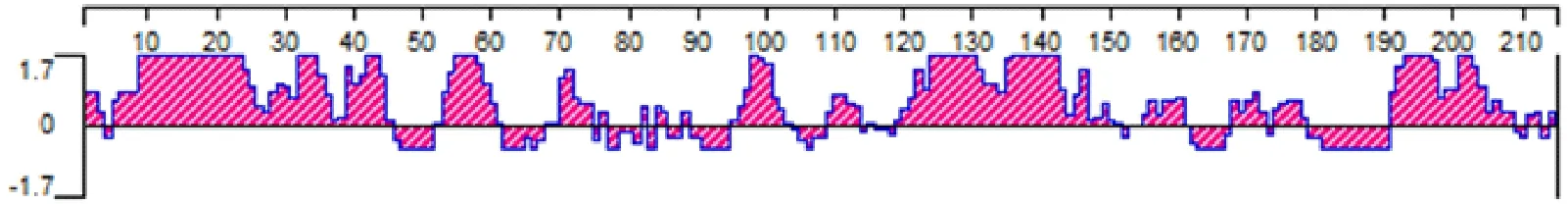
图9 PCV3 Cap蛋白抗原指数分析
综上多种方法对PCV3 Cap蛋白的预测结果,得出PCV3 Cap蛋白抗原的B细胞表位区域可能在11-17、37-41、54-60、97-101、119-134、138-140、142-146、155-160、170-172、175-181和192-202aa,或者在它们附近。
2.4 pET30a-PCV3-Cap双酶切鉴定结果
重组质粒pET30a-PCV3-Cap经限制性内切酶NdeⅠ和Hind Ⅲ进行双酶切后,经10 g/L的琼脂糖凝胶电泳,得到预期大小的2个片段(图10)。

M.DNA 标准DL 8 000;1.pET30a-PCV3-Cap质粒;2~3.pET30a-PCV3-Cap双酶切产物
M.DNA Marker DL 8 000;1.pET30a-PCV3-Cap plasmid;2-3.Products of pET30a-PCV3-Cap of double enzyme digestion
图10 pET30a-PCV3-Cap双酶切鉴定结果
Fig.10 Identification result of recombinant plasmid pET30a-PCV3-Cap withNdeⅠ andHind Ⅲ
2.5 pET30a-PCV3-Cap重组质粒PCR鉴定结果
以重组质粒pET30a-PCV3-Cap为模板,P1和P2为引物,扩增出与预期大小一致的特异性条带,为645 bp(图11)。

M.DNA 标准DL 2 000;1~3.pET30a-PCV3-Cap中Cap扩增片段;4.阴性对照M.DNA Marker DL 2 000;1-3.PCR products of the pET30a-PCV3-Cap;4.Negative control
2.6 pET30a-PCV3-Cap的原核表达
含重组质粒pET30a-PCV3 Cap的BL21(DE3)经终浓度0.2 mmol/L IPTG 15 ℃、37 ℃诱导16 h后,按1.2.6的方法处理蛋白,分别取上清和沉淀进行SDS-PAGE电泳检测。结果显示,全菌破菌离心后上清中无目的条带,在沉淀中出现目的蛋白条带,大小约32 ku。表明重组pET30a-PCV3-Cap蛋白主要以包涵体形式存在(图12)。
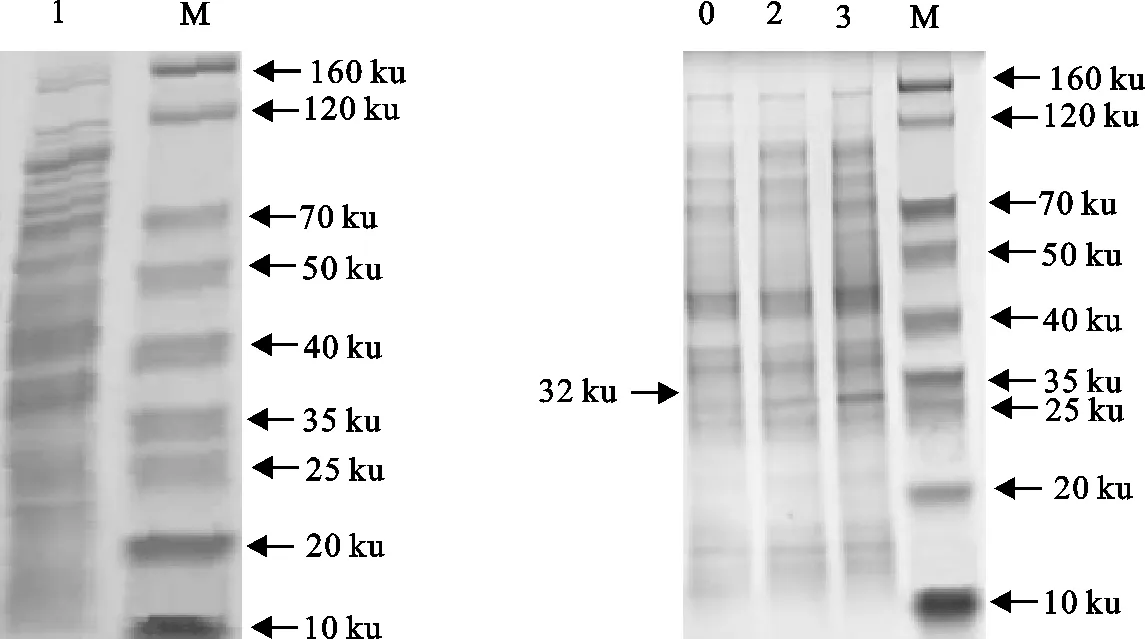
M.蛋白分子质量标准; 1.全菌破菌离心后上清;0.空载体对照;2.15 ℃诱导16 h菌体裂解离心后沉淀;3.37 ℃诱导16 h菌体裂解离心后沉淀M.Protein molecular weight Marker;1.Supernatant of bacterial lysate;0.Blank vector control;2.Bacterial precipitate of pET30a-PCV3-Cap at 16 h after induction by IPTG at 15 ℃;3.Bacterial precipitate of pET30a-PCV3-Cap at 16 h after induction by IPTG at 37 ℃
2.7 Western blot鉴定
如图13所示,DAB显色可观察到一条大小为32 ku的清晰条带,表明抗His标签抗体与pET30a-PCV3-Cap重组蛋白可以发生特异性反应。

M.蛋白分子质量标准;1.重组质粒菌pET30a-PCV3-Cap/BL21诱导后菌体裂解产物M.Protein molecular weight Marker;1.Expression product of Cap gene in E.coli BL21 transformed with pET30a-PCV3-Cap
3 讨论
2016年,Phan T G等[11]的团队发表了关于利用原核表达重组PCV3 Cap蛋白包被ELISA板建立检测PCV3抗体的间ELISA方法。2018年,Deng J等[12]根据PCV3-Cap蛋白的生物学特性,从中截取了Cap的部分基因进行表达,从而建立了间接ELISA方法。与PCR相比,ELISA具有更大的优势,因为它只需要较短的操作时间且检测速度快,因此能够及时判定猪群中PCV3的感染情况。
本试验得到的新疆株PCV3 Cap基因序列与俄罗斯株在同一分支,而与中国广东株及其他国家的Cap序列不在同一分支。基因同源性分析看出同源性为98.0%~98.6%,与瑞典株同源性最高(98.6%),与泰国株最低(98.0%),氨基酸序列突变位点分析有7个突变位点,证明新疆株PCV3与中国广东株及其他国家毒株有差异。
因此,在本试验进行了新疆株PCV3 Cap基因的原核表达,通过蛋白预测,结果显示在N末端没有核定位信号(NLS),也没有跨膜区域,大部分区域为亲水性,推测得出PCV3 Cap蛋白抗原的B细胞表位区域可能在11-17、37-41、54-60、97-101、119-134、138-140、142-146、155-160、170-172、175-181和192-202aa,或者在它们附近。以上结果证实,Cap是可用于检测PCV3特异性抗体的合适靶抗原。经过对比分析发现,PCV3 Cap的NLS序列的N末端富含有大肠埃希氏菌中的低使用的密码子编码的精氨酸残基,所以先进行密码子优化后再进行原核表达。我们选择了目的基因表达量大而且成本低的大肠埃希氏菌原核表达系统,分别取上清和沉淀进行SDS-PAGE电泳发现全菌破菌离心后上清中无目的条带,在沉淀中出现大小约32 ku的目的蛋白条带,说明重组pET30a-PCV3-Cap蛋白主要以包涵体形式存在,Western blot分析反应抗His标签抗体与pET30a-PCV3-Cap重组蛋白可以发生特异性反应,说明所获得的重组蛋白具有良好的反应原性。
一项全国性的回顾性血清学调查表明,PCV3在2015年首次被发现,并且自那时起在中国广泛传播。PCV3与猪皮炎肾病综合征和繁殖障碍以及心脏和多系统炎症有关[1,11]。然而,在没有任何临床症状的健康猪中也检测到PCV3。必须在猪体建立PCV3感染模型,以评估其对养猪业的重要性。2015年-2017年中期PCV3的阳性率从22.35%增加到51.88%,表明PCV3普遍存在并且中国猪的患病率在增加[13]。为了能够及时判定新疆猪群中PCV3的感染情况,建立ELISA方法十分必要。
