济南市犬瘟热病毒H基因遗传进化分析
2021-01-26王召阳蒋亚君刘雪婷侯绍华郭晓宇朱鸿飞
王召阳,蒋亚君,刘雪婷,侯绍华,郭晓宇,鑫 婷,朱鸿飞,贾 红
(中国农业科学院北京畜牧兽医研究所,北京 100193)
犬瘟热(Canine distemper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)引起的一种急性、高度接触性传染病[1]。CDV可引起多种食肉动物感染,发病率高,致死率高达50%[2],严重威胁犬只健康。犬瘟热也对其他野生动物,包括东北虎[3]、大熊猫、狮子、猕猴[4-5]等造成严重威胁。临床症状主要包括眼鼻分泌物增多、双相热、腹泻、呕吐、足垫增厚和抽搐等[1,6],且CDV常与其他病原(犬细小病毒、犬冠状病毒虫和滴虫等)共同感染[7-8]。
目前预防犬瘟热的主要方法是疫苗免疫接种,正确的疫苗接种可提供长期的免疫保护[9],然而仍有免疫动物发生CDV感染的情况[10]。可能是CDV发生变异,导致疫苗免疫保护效果降低所致,因此对流行的CDV进行遗传进化分析具有重要意义。CDV是一种带囊膜的负链RNA病毒,属于副黏病毒科,麻疹病毒属[9],包含6个基因区域,分别以独立、不重叠的转录单位排列的6个结构蛋白,包括核衣壳蛋白(N)、磷蛋白(P)、病毒聚合酶(L)、基质膜蛋白(M)、血凝素(H)和融合蛋白糖蛋白(F)[11]。其中,H蛋白是主要的抗原决定簇[12],决定病毒的趋向性,在免疫应答中起关键作用,感染CDV恢复的犬可产生针对H蛋白的中和抗体,达到终生免疫[11]。有报道显示CDV免疫小鼠后,可筛选到具有中和活性靶向H蛋白单克隆抗体[13]。并且H蛋白存在糖基化位点,而糖基化与CDV的毒力有关[14]。同时,H蛋白变异率较高,常用于分析不同CDV毒株之间的遗传变异[9],因此本研究选用CDV的H基因进行克隆及分析其遗传进化规律。
CDV毒株的基因型分布大体上遵循地理分布的原则[15],但由于经济全球化的发展、各地区文化科技的交流,病毒的遗传进化也有所改变,Asia-Ⅲ和Asia-Ⅳ都曾在中国报道[9]。近期CDV在灵长类身上感染的报道[5]也提示该病毒有感染人类的潜在可能性[16],因此监测CDV流行情况极其重要。
1 材料与方法
1.1 材料
1.1.1 病料来源 采集2019年1月-6月济南市某宠物医院7份临床样品(眼鼻拭子),置于-20℃保存。该样品均来自疑似患犬瘟热疾病的犬,并且犬瘟热抗原胶体金检测试纸条为阳性。
1.1.2 主要试剂 高保真酶(2×Phanta Max Master Mix)、DH5α感受态细胞、TA/Blunt-Zero Cloning Kit,南京诺唯赞公司产品;核酸染料,北京聚合美公司产品;胶回收试剂盒和质粒小量提取试剂盒,Omega公司产品;AxyPrepTMBody Fluid Viral DNA/RNA Miniprep kit,康宁生命科学有限公司产品;反转录试剂盒,湖南艾科瑞生物工程有限公司产品。
1.1.3 主要仪器 离心机(5430R)、PCR仪、移液器,Eppendorf公司产品;电泳仪,Bio-RAD公司产品;凝胶成像系统(Tanon 2500),上海天能科技有限公司产品。
1.2 方法
1.2.1 病料处理 按收集到样品的先后顺序进行编号,依次编号为SD-01、SD-02、SD-03、SD-04、SD-05、SD-06、SD-07。将眼鼻分泌物拭子置于含有0.5 mL PBS的EP管中,置于冰上5 min,并不时搅拌使眼鼻分泌物充分溶解到PBS中,反复冻融3次。12 000 r/min离心10 min,吸取上清200 μL,置于-80 ℃保存备用。
1.2.2 样品RNA提取及反转录 将制备好的样品按照AxyPrepTMBody Fluid Viral DNA/RNA Miniprep Kit说明书进行提取。提取完成后按照Evo M-MLV RT for PCR Kit说明书进行反转录。
1.2.3 引物设计与合成 根据GenBank公布的CDV H基因序列信息,利用DNAMan软件设计引物如下,H-F:5`-ATGCTCTCTTACCAAGACAAG-3`;H-R:5`-TCAAGGTTTTGAACGGTT-3`。引物由北京诺赛基因公司进行合成。
1.2.4 H基因的扩增及克隆 首先PCR扩增CDV H基因,反应体系按2×Phanta Max Master Mix 推荐设计,具体如下:Mix 25 μL,上、下游引物各2 μL(10 mmol/L),反转录cDNA 4 μL,ddH2O 17 μL。PCR反应程序为:95 ℃预变性3 min;95 ℃ 15 s,55 ℃ 10 s,72 ℃ 2 min,共35个循环;72 ℃延伸7 min。PCR产物进行核酸凝胶电泳。参考TA/Blunt-Zero Cloning Kit说明书,连接至blunt-zero载体,转化至DH5α大肠埃希氏菌感受态细胞。涂布于含有氨苄青霉素的琼脂板,挑取单克隆菌落,送至北京诺赛基因公司进行测序。
1.2.5 H基因序列分析 利用Meg Align软件,将测序结果与NCBI上的CDV序列以及NCBI Blast分析近似序列进行同源性分析,并利用MEGA6软件根据氨基酸序列构建系统进化树,采用最大似然法、Bootstrap值(1 000)进行分析。利用NetNGlyc 1.0进行H基因潜在糖基化位点的预测,并与典型的毒株序列进行比对。利用Protein软件进行H基因抗原表位预测,并与常见疫苗株H基因抗原表位进行对比。
2 结果
2.1 CDV H基因扩增
反转录获得cDNA,以H-F、H-R为引物进行PCR扩增,目的片段长约1 824 bp,与预期相符(图1)。
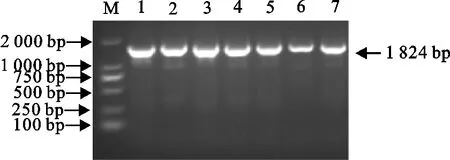
M.DNA 标准DL 2 000;1~7.随机采集临床样本SD01~SD07M.DNA Marker DL 2 000;1-7.Clinical samples SD01-SD07
2.2 CDV H基因同源性分析
利用DNA Star软件中的Meg Align进行同源性分析。结果显示,济南市犬瘟热H基因核苷酸、氨基酸同源性分别为98.7%~99.9%和98.7%~100%,而与疫苗株相比,核苷酸、氨基酸同源性分别为90.0%~90.9%和88.8%~91.4%(图2和图3)。
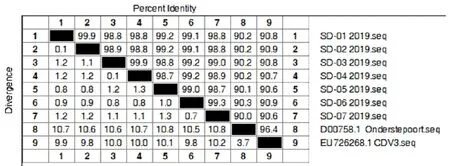
图2 济南市CDV与疫苗株核苷酸同源性分析
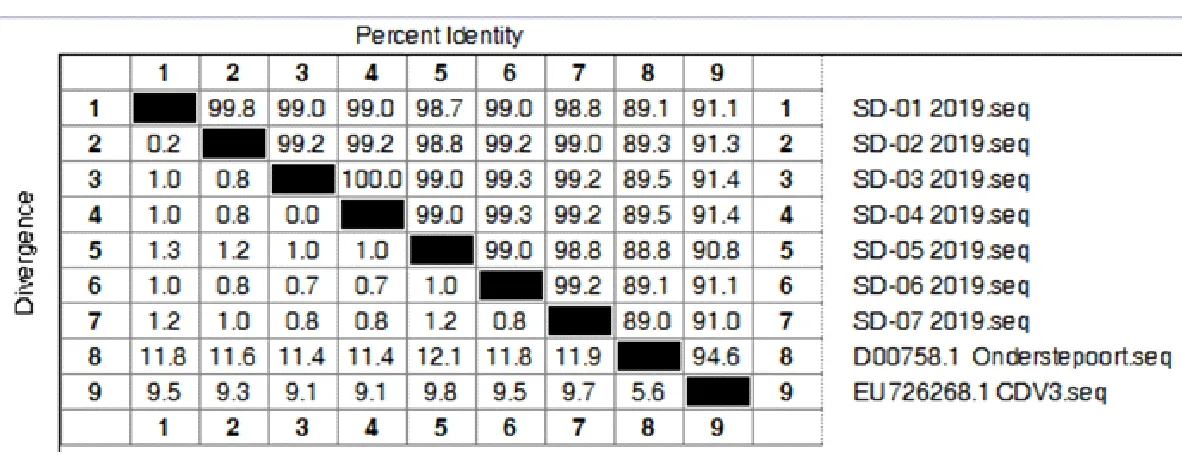
图3 济南市CDV与疫苗株氨基酸同源性分析
2.3 CDV H基因遗传进化树分析
参考NCBI部分参考毒株与7株检测毒株的H基因DNA序列,利用MEGA6软件,采用最大似然法构建系统进化树,结果显示,济南市7株毒株均属于Asia-Ⅰ型,均为强毒株,与疫苗株America-Ⅰ型遗传关系差异明显,其中SD06与北京分离株亲缘关系最近,SD-07与黑龙江分离株HRB-E8和HLJ-1-14亲缘关系最近,SD01、SD02与广东分离株GD1811和GD1810亲缘关系最近,SD-5形成一个相对独立的分支,介于广东分离株GD1810、GD1811与泰国分离株CDV6-TH/2014之间,SD03、SD04相对于其余5株形成一个相对独立的小分支,通过NCBI Blast分析也为匹配到相近的序列,可能是一个新的进化方向(图4)。
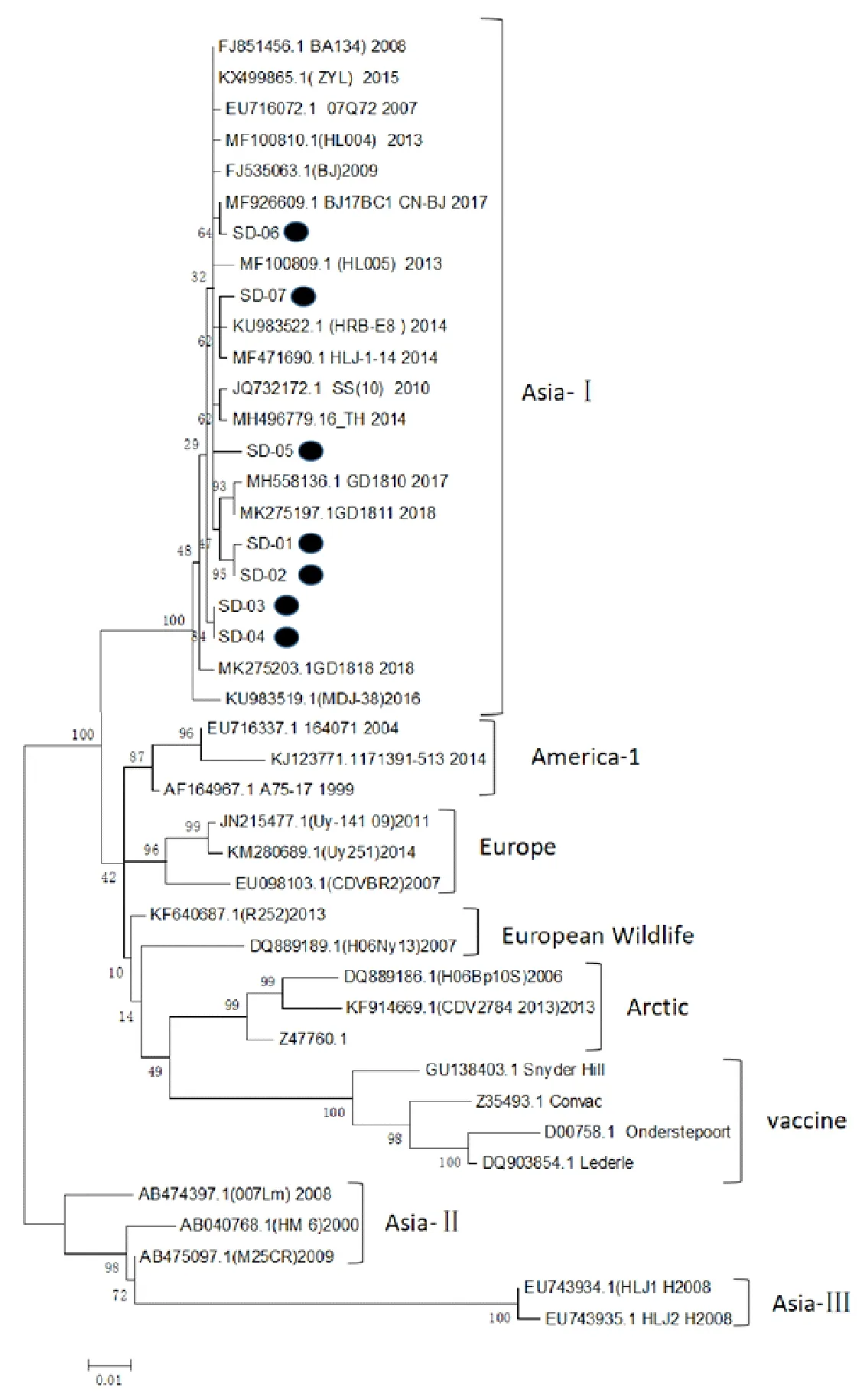
●表示本试验分离毒株●CDV strains in this study
2.4 CDV H基因主要氨基酸位点突变分析
由表1可知,Asia-Ⅰ型存在8个~9个潜在天冬酰胺糖基化位点,其中野毒株SD-07与MF100809.1相同,在309位缺失了潜在天冬酰胺糖基化位点。其余6株分离株均为9个潜在天冬酰胺糖基化位点。
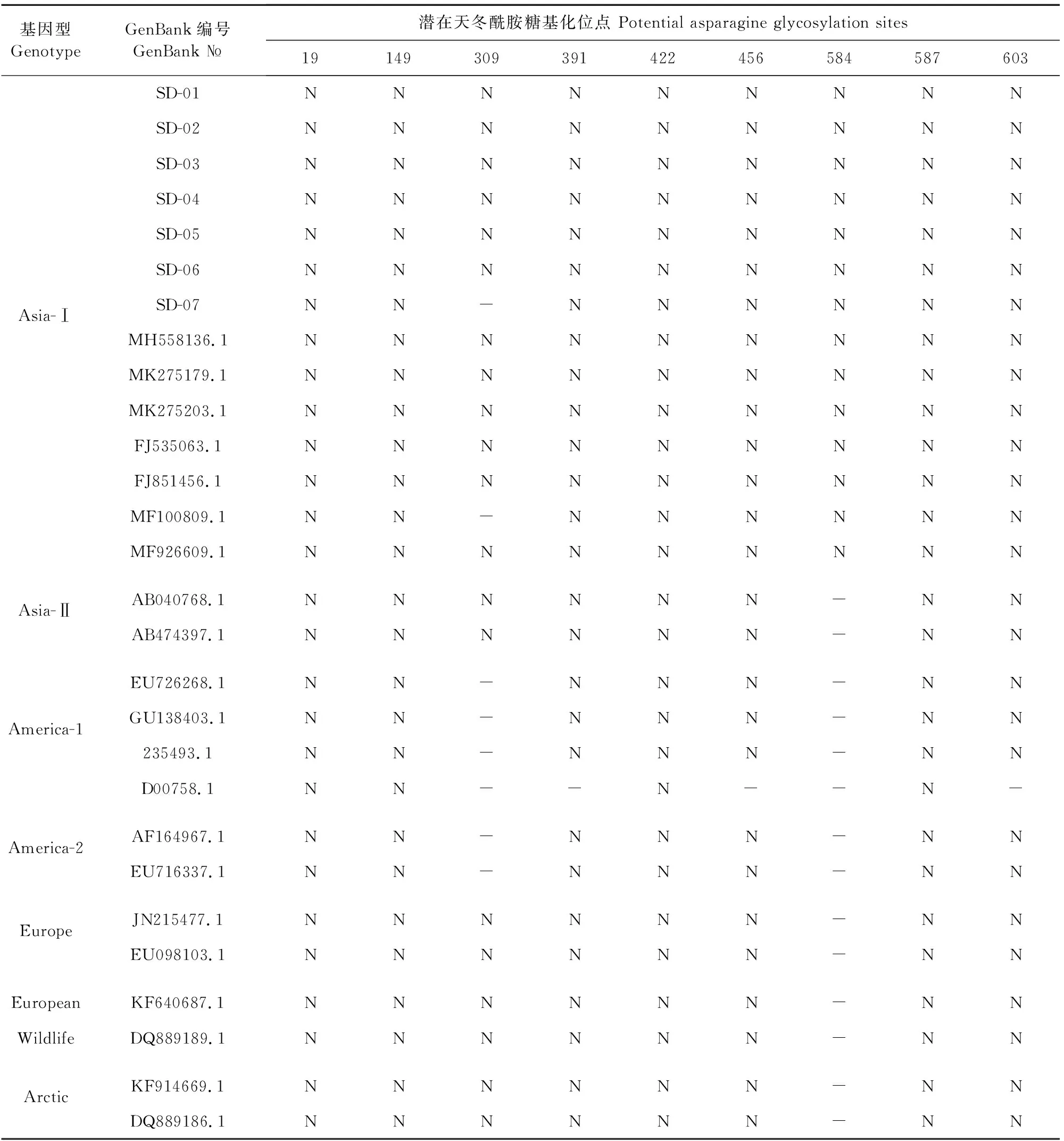
表1 不同基因型H基因的N-X-S/T位点分布情况
2.5 CDV H基因抗原表位预测分析
利用DNA Star protein软件对疫苗株及野毒株进行CDV H基因抗原表位预测[17-18]。结果表明,疫苗株Onderstepoort和CDV3与野毒株在20-30、180-200、230-250、390-410、440-460、575-595位存在明显的抗原表位差异,其中SD01-SD07在25、230-250位预测抗原表位与疫苗株Onderstepoort和CDV3差异最为明显,SD07在180-200、440-460位预测抗原表位与疫苗株Onderstepoort和CDV3差异最为明显,SD05在390-410、575-595预测表位抗原与疫苗株Onderstepoort和CDV3差异最为明显(图5)。
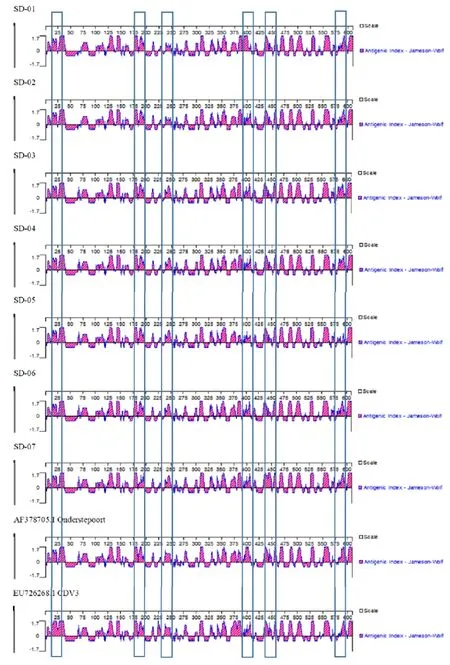
图5 CDV H基因抗原表位分析
3 讨论
近年来,犬瘟热病毒的宿主范围逐渐扩大,严重威胁犬及野生动物的健康[19]。引起犬瘟热的CDV可经呼吸道感染、通过患病犬的分泌物进行传播,该病毒对热敏感,故冬春季节多发。病毒血凝素(H)蛋白的突变,特别是与信号淋巴细胞活化分子(signaling lymphocyte activating molecules,SLAM)受体结合位点的突变是导致宿主范围扩大的原因之一[20]。因此,监测CDV H基因变异情况,具有一定的公共卫生意义。
预防犬瘟热行之有效的方法是接种CDV疫苗,但接种疫苗后感染仍时有报道[21]。目前市场上主要的CDV疫苗为Onderstepoort株和CDV3株[17],我国主要流行株为Asia-Ⅰ型。本试验通过预测比较7个野毒株与疫苗株 H基因核苷酸、氨基酸序列同源性,发现野毒株与疫苗株之间存在明显差异。7个野毒株的核苷酸序列同源性高达98.7%~99.9%,而与疫苗株相比,核苷酸同源性90.0%~90.9%。氨基酸序列分析显示,7个毒株之间的同源性为98.7%~100%,而与疫苗株的同源性为88.8%~91.4%,核苷酸序列和氨基酸序列同源性差异均较大。 H蛋白的氨基酸序列可用于系统进化树分析[22],因此本试验通过H基因DNA序列成功构建系统进化树,结果表明,7株CDV野毒株均属于Asia-Ⅰ。其中SD-6与BJ17BC1同源关系最近,SD-07株与HRB-E8、HLJ-1-14同处一个分支,SD-01、SD-02和GD1810、GD1811同处一个小的分支,值得注意的是SD-03和SD-04形成了一个单独的小分支,说明同一地区的CDV具有较高的遗传多样性,但基本遵循地理分布的原则[13]。糖基化是决定许多蛋白质抗原性的重要因素,潜在天冬酰胺糖基化位点主要与病毒的毒力、复制和抗原性有关[23]。犬瘟热疫苗株Onderstepoort、CDV3,分别有4个、7个潜在天冬酰胺糖基化位点,而检测的CDV H基因存在8个~9个潜在天冬酰胺糖基化位点,这可能是造成免疫失败的原因之一。进一步预测分析表明,野毒株与疫苗之间预测存在的明显差异的抗原表位,也可能是免疫失败的原因之一,二者在20-30、180-200、230-250、390-410、440-460、575-595等多个位点存在明显的预测抗原表位差异。
本文通过检测济南市CDV基因型,对CDV H基因进行遗传进化分析,可监测病毒遗传进化情况,从而为疫苗改进及疾病预防提供一定的数据支持。
