通肾颗粒的亚慢性毒性试验
2021-01-26王雅倩侯会霞边小利王虹雅陈胡羚张芬芳李引乾
王 军,王雅倩,侯会霞,边小利,王虹雅,陈胡羚,张芬芳,4,孙 蓉,李引乾*
(1.陕西汉中市动物疾病预防控制中心,陕西汉中 723000;2.西北农林科技大学动物医学院,陕西杨凌 712100;3.陕西省府谷县麻镇畜牧兽医工作站,陕西府谷 7194003;4.陕西省眉县畜牧兽医工作站,陕西眉县 722300)
肾炎(nephritis)是临床上以水肿、肾区疼痛、尿量改变、尿液含有多量上皮细胞和管型为特征的肾小球、肾小管或肾脏间质组织发生炎症的病理过程[1]。发病多与感染、毒物刺激和变态反应有关[2]。临床治疗以消炎利尿、抑制免疫反应和清热利湿、止血凉血为主[3-4]。通肾颗粒由黄芪、苦参、白茅根、金银花等中药组成,具有可清热燥湿,清热利尿和清热解毒之功效,临床上用于治疗以水肿、尿少、尿血、腰部疼痛等为主症的肾炎。为考察通肾颗粒的安全性,根据《兽药试验技术规范汇编》[5]中有关兽药亚慢性毒性试验的要求进行本试验,以评价通肾颗粒的安全性,为进一步制定临床试验给药方案提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠共100只,雌雄各半,初始体重200 g~240 g,购自成都达硕实验动物中心。动物于试验前均观察7 d,临床检查健康者即用于试验。
1.1.2 药品与试剂 通肾颗粒(主要成分为黄芪、苦参、白茅根和金银花等)(批号:20181011),河南惠通天下生物工程有限公司提供;二甲苯(批号:20171210),广东省化学试剂工程技术研究工发有限公司产品;无水乙醇(批号:20171028),广东光华化学厂有限公司产品;甲醛(批号:20171125),天津博迪化工股份有限公司产品;石蜡(批号:20171022),抚顺东科蜡业有限公司产品;苏木精(批号20170825)、伊红(批号:20171115),上海化学试剂站分装厂;丙酮(批号:20171125),天津博迪化工股份有限公司产品;真空血样采集容器(EDTA-K2)(批号:20180101),江苏康捷医疗器械有限公司产品;真空血样采集容器(肝素钠)(批号:20180201),江苏康捷医疗器械有限公司;生理盐水(批号:D161201121),山东科伦药业有限公司产品;尿素氮测定试剂盒(批号:339101)、肌酐测定试剂盒(批号:262609)、天门冬氨酸氨基转移酶测定试剂盒(批号:797231)、γ谷氨酰转移酶测定试剂盒(批号:654263)、葡萄糖测定试剂盒(批号:245460)、总蛋白测定试剂盒(批号:230433)、白蛋白测定试剂盒(批号:245621),日本富士胶片株式会社。
1.1.3 仪器设备 FUJIFILM DRI-CHEM4000ie干式生化分析仪,日本富士胶片株式会社产品;Sysmex XT-1800i全自动血细胞分析仪,日本东亚公司产品;TDZ5台式低速离心机,湖南赫西仪器装备有限公司产品;FA1204B电子天平,上海精科实业有限公司产品;精密旋转切片机,美国AO公司产品;XSZ-4U生物显微镜,重庆麦克光电仪器有限公司产品;MOTIC显微镜,麦克奥迪公司产品。
1.2 方法
1.2.1 试验分组 将100只SD大鼠随机分为4组,3个试验组和1个对照组,3个试验组分别为通肾颗粒高、中、低剂量组,对照组为生理盐水组[6]。
1.2.2 给药剂量及给药途径 现用现配,用温开水冲入通肾颗粒药中使其溶解,按试验组梯度及大鼠体重灌胃给药。试验组高、中、低剂量组的剂量分别为12、6、3 g/kg,根据大鼠体重以1 mL/100 g适量给药。对照组同样按体重使用等体积的生理盐水每日灌胃给予。试验期为6周,期间连续给药,每周定时早上7:00时称量体重1次,随大鼠体重变化适时当周调整给药剂量,停药后正常饲喂继续观察2周[7]。
1.2.3 观察指标
1.2.3.1 一般健康状况 试验期间,每日定时,间隔3 h~6 h观察大鼠的行为、精神状态、饮水量、采食量、粪便、发病及死亡等情况。若有大鼠死亡,及时记录并进行病理学检查[8-9]。
1.2.3.2 体重 分别于试验的第0、1、2、3、4、5、6周早晨空腹逐只称量体重,计算组间差异。
1.2.3.3 血液学指标和血清生化指标测定 参照文献[10],于末次给药后24 h和停药2周后分别每组各取10只大鼠(雌雄各5只),麻醉后,立即切开小鼠下腹部从下腔静脉采血于加有EDTA的抗凝管中,应用Sysmex XT-1800i全自动血细胞分析仪分析血液中的红细胞(RBC)、白细胞(WBC)和血红蛋白(Hb)。同时采集血液于离心管中,自然凝固,离心,分离血清,用血液生化分析仪测定以下血清生化指标:总蛋白(TP)、谷丙转氨酶(ALT)、尿素氮(BUN)、谷草转氨酶(AST)、肌酐(Cr)、总胆固醇(TC)、血糖(GLU)、白蛋白(ALB)。
1.2.3.4 脏器系数 参照文献[11],试验结束后,当日处死动物,称量大鼠体重,取心、肝、脾、肺、肾,并称取重量,计算脏器系数。脏器系数=脏器重量/体重×100。
1.2.3.5 病理学检查 大鼠采血后实施安乐死后进行剖检,观察主要脏器有无眼观可见的病理学变化,按常规方法制备记录结果。取心、肝、脾、肺、肾,各取保留特征区域的约拇指大小规则块,加以100 mL/mL中性福尔马林固定,进行常规石蜡包埋和切片,HE染色,光镜下观察[12-13]。
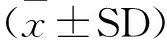
2 结果
2.1 体重变化结果
在6周试验期间,持续观察显示,试验组高、中、低剂量组与对照生理盐水组的大鼠无论雌雄均状态良好,精神正常,被毛整齐,活动自如,食欲旺盛,代谢正常,未出现中毒和死亡。各组大鼠体重变化见表1、表2。
由表1和表2可见,试验期间,每日持续灌服通肾颗粒,每周对大鼠体重进行称量,试验组大鼠与对照组大鼠体重表现出了不同的变化。雄性大鼠结果显示,通肾颗粒高剂量组在第4周开始直到第6周试验结束,体重与对照组存在差异,表现为差异显著(P<0.05)或极显著(P<0.01),而中剂量组从第4周开始,与生理盐水组相比差异极显著(P<0.01),而低剂量组在整个试验期间(6周)与生理盐水组差异均不显著(P>0.05)。雌性大鼠结果显示,高剂量和中剂量组在试验期间基本与对照生理盐水组差异不显著(P>0.05),低剂量组雌性大鼠从第2周开始与生理盐水组差异显著(P<0.05)。高、中剂量组通肾颗粒对雄性大鼠的生长有一定的抑制作用,高剂量组对雌性大鼠的生长有一定的抑制作用。
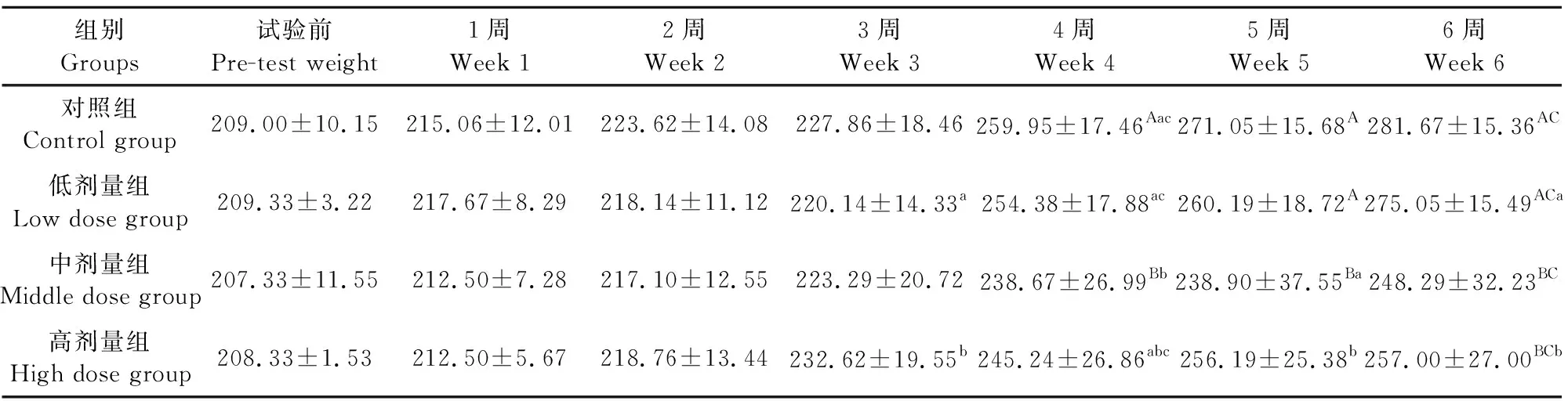
表1 试验期间各组雄性大鼠体重变化
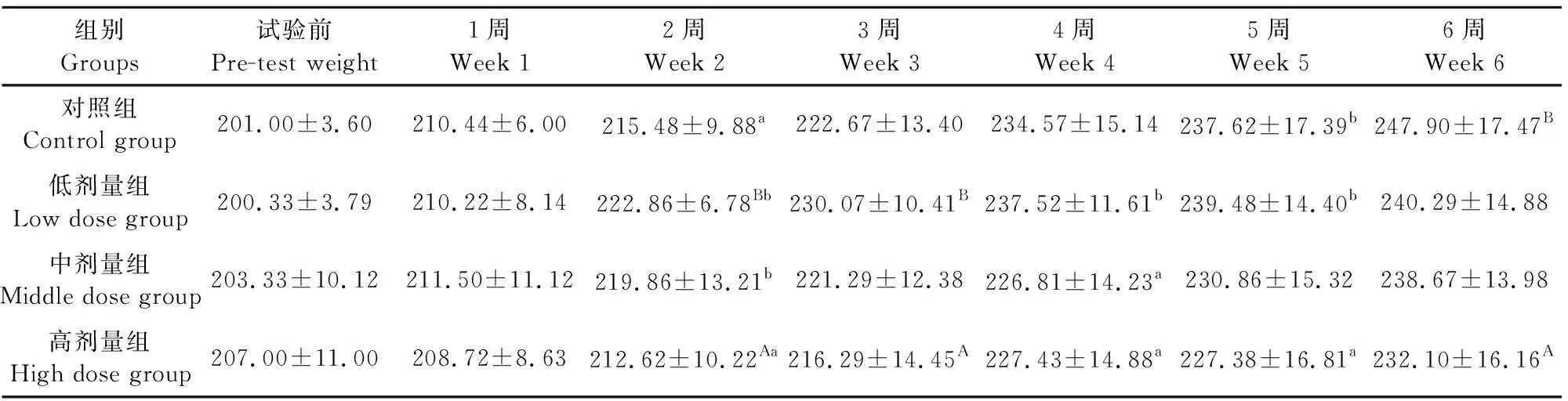
表2 试验期间各组雌性大鼠体重变化
2.2 血液学和生化指标测定结果
持续灌胃6周后得到血液学和生化指标测定结果见表3和表4。
由表3可见,通肾颗粒给药6周后对高、中、低和对照组雄性大鼠和雌性大鼠的红细胞数、血红蛋白含量和白细胞总数的差异均不显著(P>0.05)。
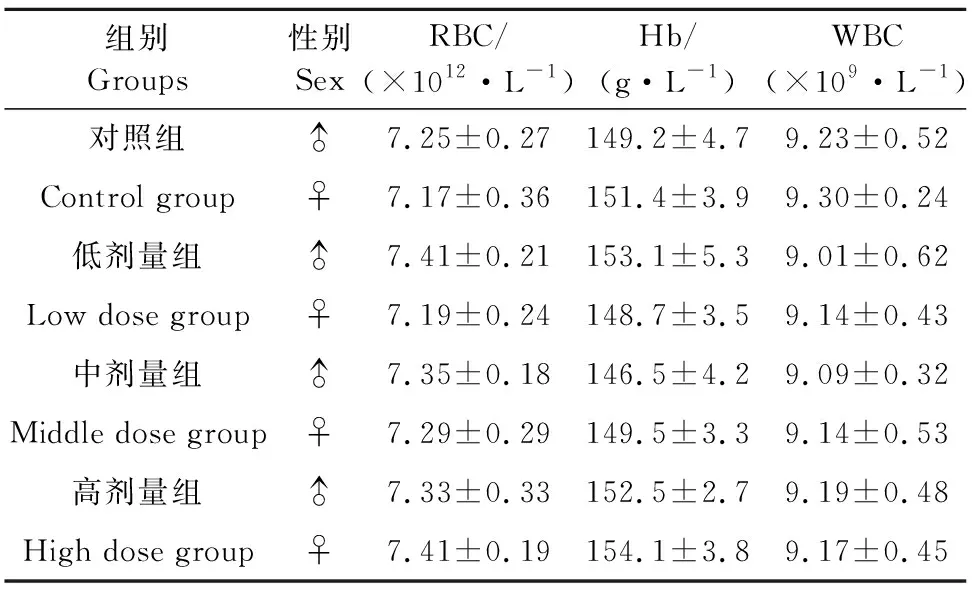
表3 给药6周后对各剂量组大鼠血液学指标的影响
由表4可见,通肾颗粒给药6周后对高、中、低剂量组和对照组雄性大鼠和雌性大鼠的TP、ALT、BUN、AST、Cr、GLU、ALB均差异不显著(P>0.05),无统计学意义。
停药2周后血液学和生化指标测定结果见表5和表6。
由表5可见,通肾颗粒停药2周后对高、中、低剂量组和对照组的雄性大鼠和雌性大鼠红细胞数、血红蛋白含量和白细胞总数均差异不显著(P>0.05)。
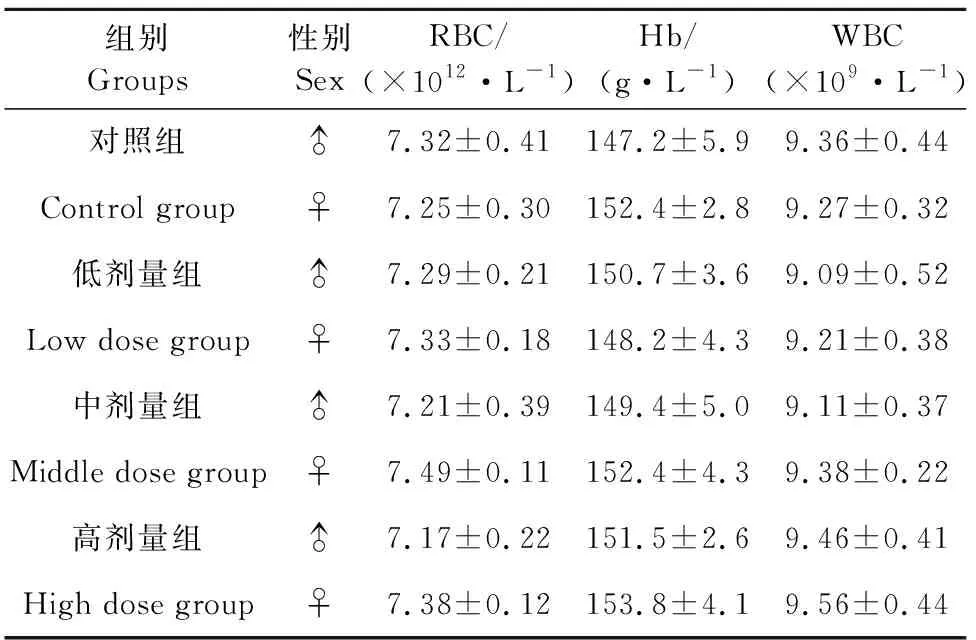
表5 停药2周后对各剂量组大鼠血液学指标的变化
由表6可见,通肾颗粒停药2周后高、中、低剂量组和对照组雄性大鼠和雌性大鼠的ALT、AST、GLU、TP、ALB、BUN、CR差异均不显著(P>0.05),无统计学意义。
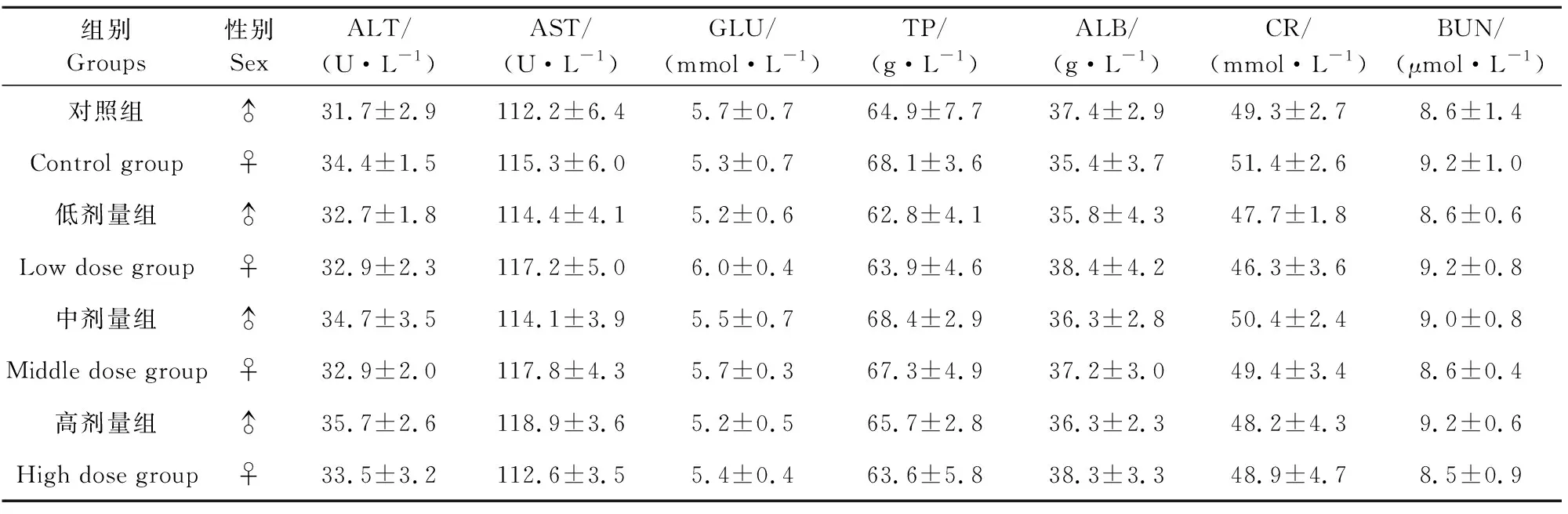
表6 停药2周后对各剂量组大鼠生化指标的影响
2.3 大鼠脏器系数测定结果
脏器系数试验结果见表7。由表7可见,为期6周的灌胃,并没有对大鼠的脏器系数造成影响。通肾颗粒对雄性与雌性大鼠的高、中、低剂量组、对照组的各个器官的脏器系数均没有显著差异(P>0.05),说明通肾颗粒在中长期试验中不会对大鼠的脏器产生负面作用。
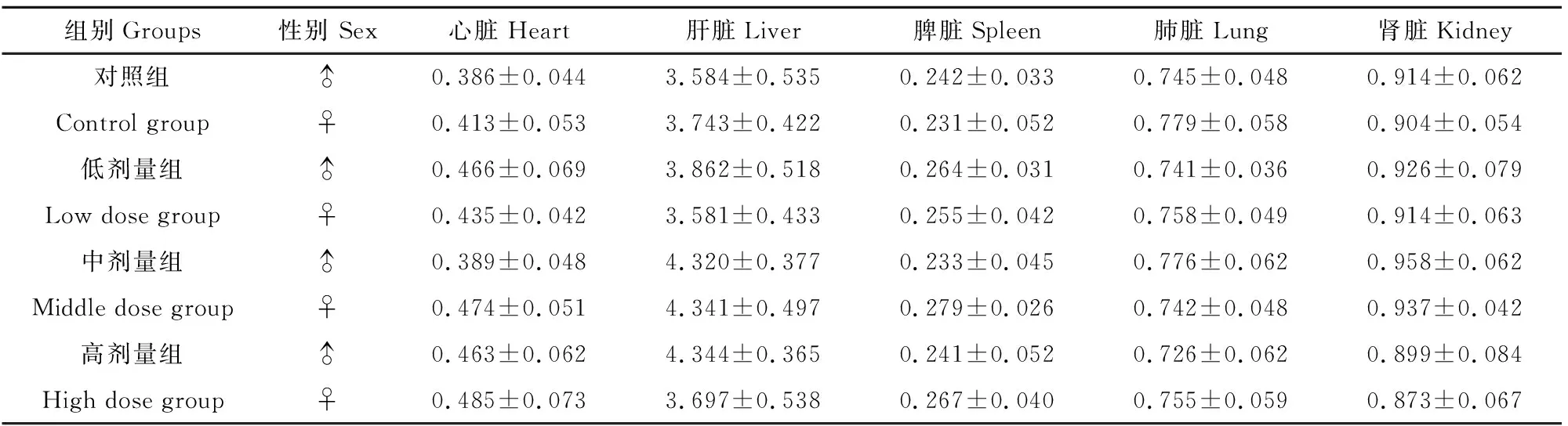
表7 通肾颗粒对各剂量大鼠脏器系数的影响
2.4 病理学检查结果
试验结束,对3个试验组和对照组大鼠剖检后,分离采集其主要脏器,包括心脏、肝脏、脾脏、肺脏、肾脏等器官,肉眼观察无明显的病理变化。分别取试验组和对照组中雌、雄大鼠心脏、肝脏、脾脏、肺脏、肾脏等器官特征性组织部位,制成切片,置于显微镜下观察,未发现各器官的病理变化。心肌纤维呈束,无断裂;肝细胞无明显肿大、坏死等变化;脾脏结构清晰,无组织病变;肺脏结构清楚,肺泡清晰可见;肾脏组织结构正常,肾小球和肾小管形态正常,且间质细胞未见增生现象(图1)。
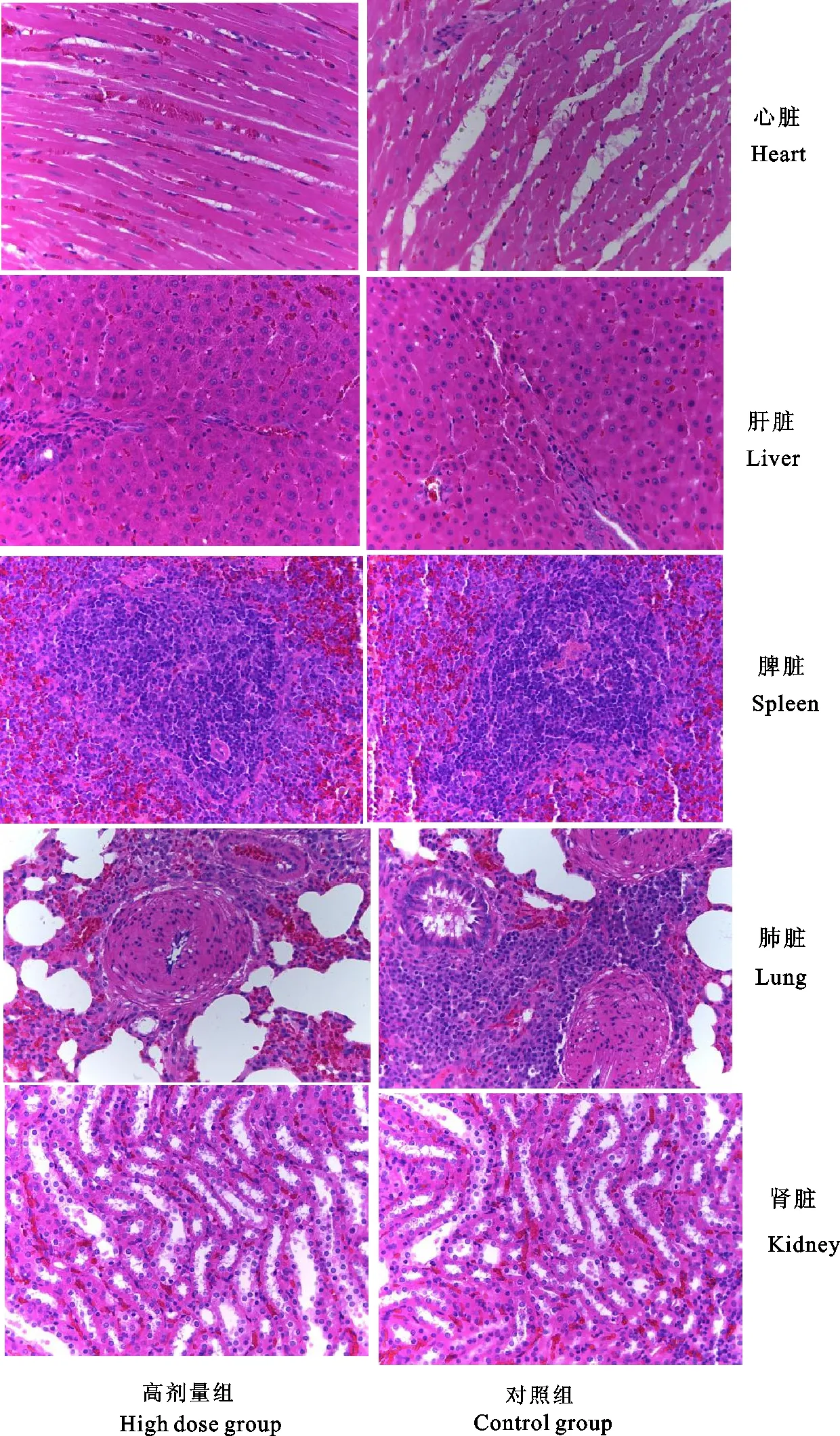
图1 大鼠病理组织学观察
3 讨论
亚慢性毒性是指人或动物连续较长时间接触较大剂量的化学物所出现的中毒效应,用以观察较长时期毒性作用性质和确定毒物的靶器官。本试验中,将通肾颗粒连续灌胃SD大鼠6周后,观察各组大鼠的一般性指标和生理生化指标,以及中毒症状、动物体重变化、生活规律观察、精神状态、血液指标与生化指标检测、尸检、脏器系数、器官组织学检查等。研究表明大鼠在持续服用通肾颗粒期间,生活规律、毛发、习惯、状态、尿液、粪便等一般性指标均无异常;血液指标与生化指标、体重变化、脏器系数的统计学分析结果为血常规、血液生化的数值各组差异不显著(P>0.05),试验组和对照组体重存在显著差异(P<0.01),脏器系数的数值各组差异不显著(P>0.05)。综合研究结果,表明通肾颗粒对大鼠的血液指标、生化指标和脏器无明显影响。但若长期大量使用,会对雄性、雌性大鼠的生长造成一定的抑制作用。
通肾颗粒亚慢性毒性试验结果显示,通肾颗粒对于SD大鼠的生活状态、血常规和生化指标以及内脏器官等均无影响。表明该药物毒性低,安全性高,在临床上具有一定的推广应用价值。
