露蕊乌头内生真菌的分离与鉴定
2021-01-26刘欣瑜黄恩霞张书航朱燕丽刘奕伶王敬龙宋润杰赵宝玉
刘欣瑜,黄恩霞,张书航,张 雨,朱燕丽,刘奕伶,王敬龙,孙 璐,宋润杰,赵宝玉,路 浩*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.西藏自治区青稞种质改良和牦牛繁育重点实验室,西藏拉萨 850000;3.西藏自治区农牧科学院草业科学研究所,西藏拉萨 850000)
乌头属植物在世界范围内大约有350种[1],主要分布在欧亚和北美等地区[2],其中我国物种资源最为丰富(约200种),主要分布于甘肃、西藏、青海及其邻近地区[3]。乌头是我国的传统药用植物,其在强心、抗炎镇痛、抗肿瘤、免疫调节及抗衰老等方面具有良好的药理作用[4]。乌头属植物含有生物碱约70种,主要为二萜类双酯型生物碱[5]。根据其化学结构可分为4大类,即C19、C20、C18-二萜生物碱和双二萜生物碱[5]。其中乌头碱、新乌头碱和次乌头碱为药用价值较高的3种成分,且都属于双酯型二萜生物碱[6]。研究表明,双酯型二萜生物碱均有剧毒,其中以乌头碱的毒性最强,是乌头的主要毒性成分[6]。各种动物误食乌头属有毒植物后,会表现以腹痛、腹泻、流涎、呕吐、瞳孔散大、呼吸困难和感觉麻痹等为主要特征的临床症状,动物最终因呼吸衰竭和心脏麻痹而死亡[7],对畜牧业造成较大经济损失,严重阻碍了我国草原畜牧业健康发展。
植物内生真菌指某一时期生活在健康植物组织器官内部或者细胞间隙中且不引起植物产生明显病症的一类真菌[8]。通过长期进化,这类真菌与被寄生的植物间形成了和谐的共生关系,植物可为内生真菌提供生长场所与营养物质,内生真菌能够产生并代谢与宿主相近的次生代谢产物,这有利于植物的生长[9]。自1993年Stierle A等[10]从短叶红豆杉中分离到1株产抗癌药物紫杉醇的内生真菌后,关于药用植物内生真菌的研究受到国内外众多学者的广泛关注。已有研究表明,乌头属植物中内生真菌种类丰富,如滇南黄草乌中分布有镰孢霉属、毛壳菌属等[11],川乌中有毛壳菌属、匐柄霉属等[12]。
露蕊乌头是毛莨科乌头属露蕊乌头亚属中的唯一一个植物品种[13],其为多年生草木植物,主要分布于甘肃南部、四川西部、青海及西藏等地[3],多生长于山地、草地和河边等地。露蕊乌头的全草可供药用,用于治疗风湿、关节疼痛等症状。目前,对露蕊乌头的研究主要集中在其药用成分的分离提取、药效及毒性等方面[14],而有关甘肃露蕊乌头内生真菌的种类与种群分布特点尚不清楚。鉴于此,本试验采用表面消毒法分离露蕊乌头内生真菌,运用形态学和ITS序列分析技术进行内生真菌的种属鉴定,研究结果可丰富乌头属内生真菌的种群多样性,并为后续露蕊乌头内生真菌次生代谢产物研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 试验所用露蕊乌头植物样本于2015年8月采自甘肃省天祝藏族自治县,对刚采集到的新鲜植物样本作干燥处理之后带回实验室保存备用,该植物样品包含根、茎、叶、花和种子。
1.1.2 主要试剂 次氯酸钠,广东光华科技股份有限公司产品;无水乙醇,成都市克隆化学品有限公司产品;琼脂粉,北京索莱宝生物科技有限公司产品;真菌通用引物ITS1和ITS4,西安热默尔生物科技有限公司产品;2×EsTaqMAsterMix(Dye)、DNA标准DL 2 000,TaKaRa公司产品;氯仿,西陇科学股份有限公司产品;异戊醇,西陇化工股份有限公司产品;混合酚,北京索莱宝生物科技有限公司产品;中性树胶,国药集团化学试剂有限公司产品。
1.1.3 主要仪器设备 超净工作台,苏州净化设备有限公司产品;霉菌培养箱,中仪国科科技有限公司产品;冷冻离心机,德国Sigma公司产品;TG16A台式高速离心机,上海卢湘产品;BG-Power 600通用电泳仪,北京天诚产品;压力蒸汽灭菌器,上海博讯产品;水平式电泳槽DYCZ-34A,上海全脉产品;凝胶成像分析系统,SYNGENE公司产品; PCR基因扩增仪,美国Biorad产品;XP基因扩增仪,杭州博日公司产品。
1.1.4 培养基 马铃薯葡萄糖琼脂培养基:琼脂20 g/L,马铃薯200 g/L,葡萄糖20 g/L。
1.2 方法
1.2.1 露蕊乌头植物样品的表面消毒 对提前采集并干燥保存处理过的露蕊乌头植物样品进行表面消毒,将其根、茎、叶、花和种子使用去离子水冲洗掉表面泥沙和尘土等污染物,再使用去离子水浸泡2 h左右后于无菌实验操作台上对整个植物组织进行表面消毒。消毒的程序:用750 mL/L的酒精漂洗30 s;用无菌水漂洗1 min;用20 g/L次氯酸钠漂洗2 min,由于次氯酸钠的消毒作用较强,因此将其消毒时间设置了不同梯度,并依据筛选出的最适消毒时间作适量调整;为洗去残留的消毒水用无菌水漂洗1 min,并重复4次。完成表面消毒后,需做组织印记检测,以此验证表面消毒的效果。组织印记检测的程序:将最后一次清洗得到的灭菌去离子水滴入PDA培养基表面,在真菌培养箱内培养1周左右,观察其培养基表面是否有其他微生物生长。
1.2.2 露蕊乌头内生真菌的分离 将已进行过表面消毒的植物组织用滤纸包裹好,吸干组织表面的水分后,用手术剪剪去样品断端的部分,再将根和茎剪成2 mm~5 mm,叶和花剪成3 mm×3 mm的小块,由于露蕊乌头的种子较小,故将其剪开保留其创面即可。在分离不同植物组织的过程中注意用酒精棉球进行消毒操作,避免不同组织内的真菌交叉。将剪好的组织块或新鲜创面用无菌镊子分别插入或紧贴PDA培养基内,放置于真菌恒温培育箱,置25℃培养。
1.2.3 露蕊乌头内生真菌的纯化 培养1周后,待组织切口的边缘长出具有明显菌落差异的真菌时,用尖端菌丝挑取法,挑取顶端形态不同的菌丝至新的PDA培养基再培养,反复纯化2次~3次,将得到的纯化菌株培养并编号,作分离率(isolation rate,IR)分析,此种分析用于衡量露蕊乌头各个组织部位(根、茎、叶、花、种子)受到内生真菌浸染的程度,然后将已纯化的菌株分别接种在PDA斜面培养基上,在25℃条件下培养,待菌落长成一定大小后,置于-20℃冰箱中保存备用。
1.2.4 露蕊乌头内生真菌形态学鉴定 密切观察内生真菌,并将已纯化好的内生真菌接种在PDA培养基上,每日在固定的时间内记录菌落的生长状况,包括菌落大小、颜色、形态等,同步将之前已纯化好的内生真菌接种于另一PDA培养基上,培养3 d~4 d,待菌落生长至一定阶段,将无菌盖玻片用消毒过的镊子以45°斜插入培养基内,观察几天待菌丝爬上盖玻片之后,及时取出并制作菌丝玻片,并在显微镜下观察菌丝的生长状况,孢子形态,产孢结构以及是否有分枝、横隔等微观特征。将观察和记录到的特征和结果,参考《真菌鉴定手册》[15]对内生真菌的菌株进行初步鉴定。
1.2.5 露蕊乌头内生真菌基因组DNA的提取与5.8S rDNA-ITS序列鉴定 采用改良CTAB法提取已纯化过的菌株DNA:将已纯化的菌株接种至PDA平板上,25 ℃培养,1周待菌丝长满平板后,小心刮取菌丝放置于研钵中,加入液氮20 mL,迅速研磨至粉末状;称取已研磨破壁的菌丝粉末50 mg置于1.5 mL的离心管中,加入600 μL已在65℃水浴锅中预热的20 g/L CTAB缓冲液,完全颠倒混匀后,置于65℃水浴锅中30 min,期间需重复混匀3次;将下述离心过程重复两次,直至两相液面无肉眼可见杂质:取600 μL混合液(在-20 ℃预冷的混酚、氯仿和异戊醇溶液按25∶24∶1的体积比配置),加入到已预热完的离心管内摇匀,置于室温孵育20 min, 4 000 r/min离心5 min,移液枪取上清液置于新的1.5 mL的离心管中,随后加入已配制好的氯仿、异戊醇混合液(氯仿∶异戊醇=24∶1,-20 ℃预冷),摇匀,室温孵育20 min,4 000 r/min 离心5 min;将上清液吸取至1.5 mL的离心管内,加入50 μL 3 mol/L NaAc溶液和1 000 μL无水乙醇(-20 ℃预冷)轻轻颠倒混匀后,4 ℃、10 000 r/min离心10 min,弃去上清液,用700 mL/L的乙醇溶液(-20 ℃预冷)清洗沉淀3次,倒置于滤纸以便滤干余液,放于室温将乙醇挥干取沉淀;最后加入10 μL~20 μL ddH2O溶解DNA,可置于65 ℃水浴锅中10 min,利于加快溶解和除去其中残留的DNA酶活性,将溶解后的DNA置-20 ℃冰箱中保存备用。
5.8S rDNA-ITS片段扩增采用15 μL的PCR体系,反应体系组分为:真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGC-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)各1 μL,DNA模版1 μL,2×EsTaqMaster Mix 4.5 μL,ddH2O 7.5 μL;该PCR的反应条件为:95 ℃ 5 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,4 ℃ 10 min,将PCR产物置于4 ℃冰箱内保存备用。
将保存的PCR产物使用移液枪吸取5 μL进行点样,吸取同等体积的DNA标准DL 2 000,小心倒入电泳液(1×TAE缓冲液)至刚刚没过电泳胶,连接正负极后,开通电泳仪,电泳条件为:电压120 V、电流500 A、30 min;电泳结束后,使用凝胶成像仪观察结果。若有明显的电泳条带,用移液枪吸取PCR产物20 μL至0.5 mL离心管中,标记后送至测序公司进行检测。
1.2.6 露蕊乌头内生真菌的系统进化分析 将测序结果与EZ biocloud的DNA数据库进行比对,选取比对结果中相似度100%或相似度最高(高于95%)并结合形态学观察确定菌株种属进行鉴定;查阅《真菌鉴定手册》[15]确定其所属科、目、属,再将所得露蕊乌头菌株种属作相对分离率(RF)分析,以此衡量不同组织不同菌属的内生真菌的优势度;使用MEGA5.05软件中的邻接法(Neighbor-Joining,NJ)构建系统发育树,其自展次数为1 000次,根据系统发育树判断菌株之间的亲缘关系,进行进化分析。
2 结果
2.1 露蕊乌头内生真菌分离结果
对露蕊乌头植物组织表面进行面消毒,以20 g/L次氯酸钠消毒时间作为时间梯度,分别接种平板后观察发现,消毒时间为1 min和1.25 min的印记对照平板均被其他微生物污染,但在1.5 min和2 min的消毒时间下分离到的内生真菌菌落总数最多,另据试验观察,经20 g/L次氯酸钠消毒2 min的菌落生长较快,因此将消毒时间选为2 min,在此消毒时间下进行分离纯化得到的菌株,据其形态合并成33株,并将所得数据结果作分离率分析如表1所示,可知叶的分离率最高,茎、花和根次之,分离率最低的是种子。
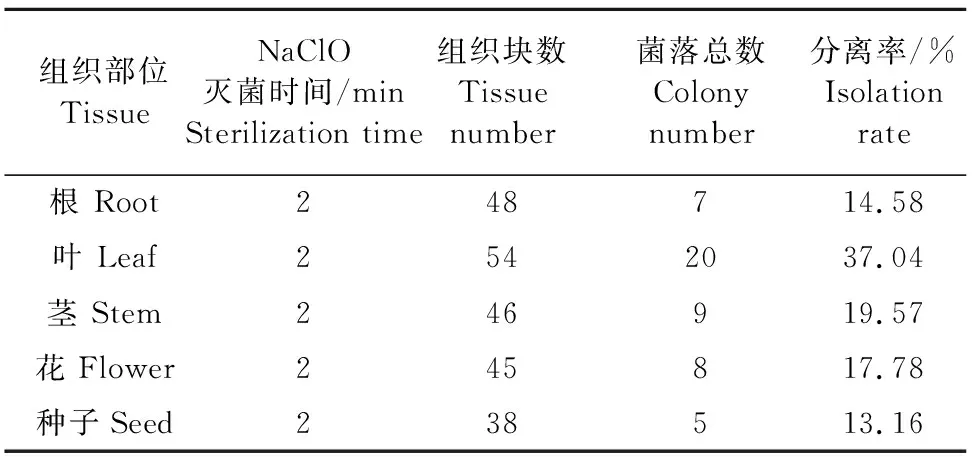
表1 露蕊乌头不同组织内生真菌分离结果
2.2 露蕊乌头内生真菌的形态特征
PDA培养基纯化菌落,在培养过程中记录下菌落的主要特征,观察制作好的切片记录显微镜下菌丝的结构,表2主要菌属代表的菌落形态学特征,将菌落形态学特征与《真菌鉴定手册》[15]进行比对后作初步鉴定。

表2 露蕊乌头优势内生真菌的形态学特征
2.3 露蕊乌头内生真菌的5.8S rDNA-ITS序列分析
将提取DNA后的PCR产物所得到的测序结果放在NCBI上进行Blast比对,相似度均高达96%上,结合形态学鉴定进一步确定后,得到分属于2纲、3目、3科、4属,共33种内生真菌(表3),其中有2种未命名。
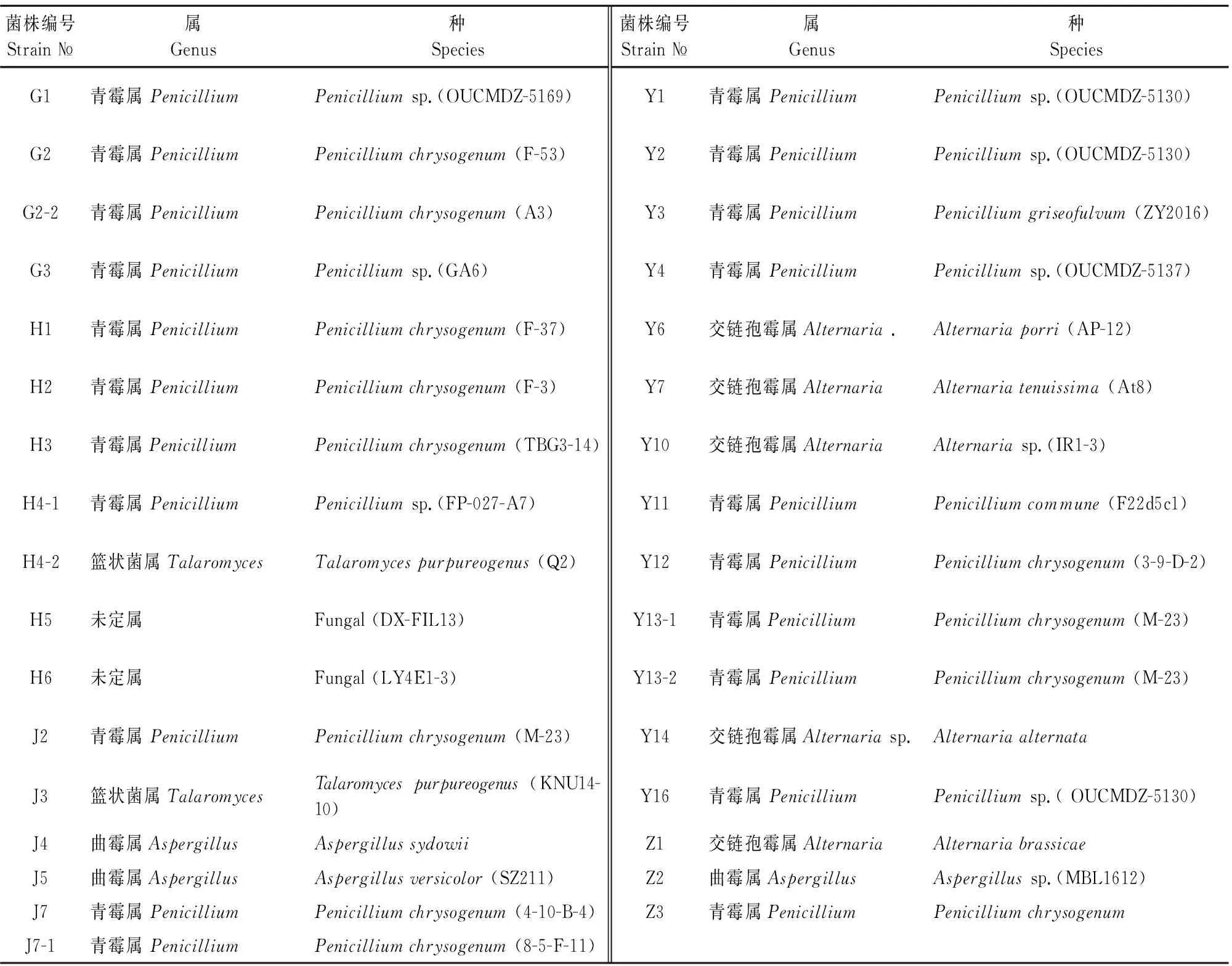
表3 露蕊乌头内生真菌鉴定结果
2.4 露蕊乌头内生真菌的组织分布特点
整理鉴定结果并计算不同菌属在不同组织的相对分离频率,如表4所示,露蕊乌头内生真菌总相对分离频率为93.94%。其中叶的内生真菌相对分离频率最高为39.39%,茎的内生真菌相对分离频率为18.18%,根的内生真菌相对分离频率为12.12%,花的内生真菌相对分离频率为15.15%,种子的内生真菌相对分离频率最低为9.09%。根据分离到的菌属,青霉属在露蕊乌头植株内的分离频率最高(63.64%),是露蕊乌头内生真菌的优势菌种,同时,青霉属(Penicilliumsp.)在5种组织内都存在,分布最广泛,部分菌属的菌落和菌丝形态如图1所示。
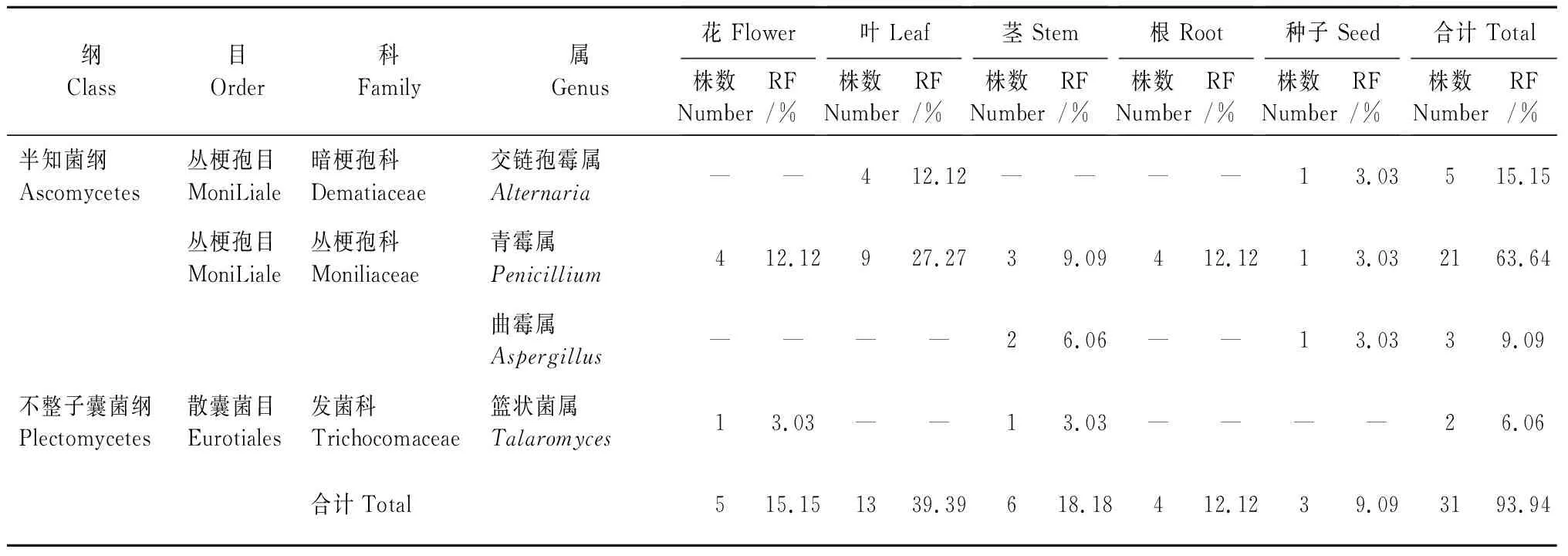
表4 露蕊乌头内生真菌菌属相对分离率

A.Y4的菌落;B.Y4的菌丝(400×);C.Y2的菌落;D.Y2的菌丝(400×);E.Y6的菌落;F.Y6的菌丝(400×);G.Z2的菌落;H.Y2的菌丝(400×)A.The colony of Y4;B.The hyphae of Y4(400×);C.The colony of Y2;D.The hyphae of Y2(400×);E.The colony of Y6;F.The hyphae of Y6(400×);G.The colony of Z2;H.The hyphae of Z2(400×)
2.5 露蕊乌头内生真菌系统发育分析
将所得菌株的测序序列用MEGA5.05软件构建系统发育树(图2)。33株菌株分属于不同的真菌,根据进化亲缘关系可分为种群Ⅰ、种群Ⅱ和种群Ⅲ,自检支持率分别为88%、96%和100%;根据亲缘关系远近,种群Ⅰ部分内生真菌亲缘关系较远可分为种群A和种群B,自检支持率为84%、60%;种群Ⅱ除去族外菌株Y7和Y10,可进一步分出种群C,自检支持率为66%;种群Ⅲ除去族外菌株H6,可进一步分出种群D,自检支持率为87%。种群A内除去族外菌株Z2,其余菌株为同一种群,自检支持率为89%。种群B可分为2个种群,自检支持率分别为97%和94%。种群D除去族外菌株H5,其余菌株为同一种群,自检支持率为88%;而种群C无下属的分支。

图2 基于5.8S rDNA-ITS序列由邻近法构建的系统发育树
3 讨论
采用表面消毒法对甘肃露蕊乌头植物组织样本消毒,使用消毒剂消毒时,其是由表面缓慢向里渗透的,故消毒的时间越长,植物组织里的内生真菌被杀灭的可能性越大,被分离出的内生真菌种类越少,但作用的时间太短又不能杀灭其组织表面的其他微生物,也就达不到消毒的效果,所以需要筛选最佳的消毒时间。由于20 g/L次氯酸钠的消毒作用较强且对内生真菌造成的影响较小,因此本试验以20 g/L次氯酸钠作为表面消毒浓度,并设置了不同的消毒时间梯度,需在印记检查中筛选出20 g/L次氯酸钠的最适消毒时间,结果显示20 g/L次氯酸钠消毒时间为1 min和1.25 min时,印记对照平板被其他微生物污染,而消毒时间为2.5 min时无菌落生长,因此,1.5 min和2 min为最佳消毒时间。路浩等[16]对急弯棘豆内生真菌分离时观察到的最佳消毒时间是2 min,表明不同属植物的最佳消毒时间基本一致。另据试验观察,经20 g/L次氯酸钠消毒2 min的菌落生长较快,进一步证实了消毒过程对内生真菌生长的影响。
本试验从露蕊乌头中一共分离到33株内生真菌,主要有青霉属(Penicilliumsp.)、交链孢霉属(Alternariasp.)、曲霉属(Aspergillussp.)和篮状菌属(Talaromycessp.)。李治滢等[12]从云南川乌中分离到的内生真菌有毛壳菌属(Chaetomiumsp.)、匐柄霉属(Stemphyliumsp.)等,表明乌头属植物的内生真菌分布种类存在差异。由表1可以看出,乌头不同组织的内生真菌种属分布情况明显不同,叶的分离率最高,其次是茎、花和根,种子内的分离率最低。杨凯等[17]从新疆白喉乌头内生真菌分离鉴定中发现其根受侵染频率最高。孙璐等[18]从毛序棘豆植物的茎中分离到的内生真菌最多,叶中分离到的较少,表明内生真菌浸染植物的组织部位较为广泛,不同环境不同植物所受内生真菌侵染的程度存在较大差异。
将露蕊乌头内生真菌鉴定后的结果进行分析后发现,青霉属在露蕊乌头组织内的分布最为广泛,是甘肃天祝露蕊乌头的优势菌属(相对分离频率为63.64%);而在滇南黄草乌中,镰孢霉属(Fusariumsp.)是茎部内生真菌的优势种类(占菌株数的18.92%),也是滇南黄草乌植物内生真菌优势属种,根部的优势属种是毛壳菌属(占根部内生真菌的20.00%)[11]。
此外,Yang K等[19]通过对新疆白喉乌头内生真菌代谢产物的检测,成功筛选出产乌头碱的菌株;李桂琼等[20]通过对碧江乌头内生真菌的次生代谢产物的研究,发现内生真菌可产生与其寄生植物组织相同或相似的活性成分,这为从露蕊乌头及其他药用植物内生真菌发酵液中寻找具有重要药理活性化合物提供了试验依据。
通过对露蕊乌头各组织内生真菌的分离与鉴定,共获得4属33种内生真菌;在露蕊乌头各组织种,内生真菌对叶的侵染频率最高,茎次之,种子最少。青霉属是露蕊乌头植株的优势菌属。
