外来物种海虱在口岸检疫中的筛查及鉴定技术
2021-01-26田城城兰文升温智清叶仕根史卫军
田城城,兰文升,吴 江,温智清,叶仕根,史卫军
(1.大连海洋大学水产与生命学院,辽宁大连 116023;2.深圳海关动植物检验检疫技术中心/深圳市检验检疫科学研究院, 广东深圳 518010)
海虱是一种以许多海洋鱼类为宿主的体外寄生虫,分类上属于桡足亚纲(Copepoda),鱼虱科(Caligidae)[1]。该寄生虫共有10个发育阶段,每个阶段都由一次退壳完成生长,包括2个浮游的无节幼体阶段,1个具有感染性的桡足类阶段,4个由额丝连接到宿主的甲壳阶段,2个成年前阶段和1个成年阶段[2-3]。海虱主要寄生在鲑科鱼类身上,这种寄生虫会影响宿主的生长、繁殖和生存,主要以宿主的黏液和表皮细胞为食,造成鱼体体表出血和溃疡、免疫力和应激能力下降、游动能力受损,严重时可以导致宿主死亡[4]。研究表明,最容易受到感染的动物是海鳟(S.trutta)和大西洋鲑(S.salar),其次是虹鳟(Oncorhynchusmykiss)、银大麻哈鱼(Oncorhynchuskisutch)和粉红三文鱼(O.gorbuscha)等[5-7],在海水养殖的大西洋鲑鱼,特别是高密度养殖,海虱是造成其他多种疫病暴发的一个原因。近年来,世界许多地区的鲑鱼养殖业受到严重影响,在全球养殖业中,由于海虱感染引起的直接和间接年度损失估计超过1亿美元[8],包括苏格兰、挪威、美国、加拿大等地。在我国沿海很多省开始在海岸线发展养殖大西洋鲑鱼产业,内陆地区也已经大规模淡水养殖虹鳟鱼,这些都是海虱的易感动物。目前,在我国还没有海虱感染养殖鱼的报道,但是,每年进口我国的大西洋鲑鱼超过3万吨,这些进口鲑鱼如果携带海虱,很容易对我国鲑科鱼养殖行业造成潜在经济损失,因此,入境口岸必须建立检验检疫程序,严格筛查和鉴定进口鲑鱼是否携带外来物种海虱,以便采取防止外来物种入侵的防控措施。
目前,对于海虱的鉴定主要侧重于形态学,鱼虱科的物种形态相似,其部分结构肉眼难以辨别,需要借助解剖镜或者电镜等工具,且个体形态还受到环境因子、种类个体变异、雌雄个体差异以及发育时期等因素的影响[9],虫卵和早期发育状态的幼虫无特定形态特征,单纯的形态特征难以检出鱼虱和判定物种类别。18S rDNA具有高度保守性的特点,该基因序列差异大小代表了物种差异大小,大量的研究表明18S rDNA在物种分类鉴定、系统进化关系等领域,广泛应用其来确定物种的分类地位[10]。而迄今为止海虱的分子生物学鉴定方面的研究较少,主要在单核苷酸多态性(single nucleotide polymorphism,SNP)、微卫星遗传标记[11-13]等方面有所报道。核酸体外扩增技术能够通过获得的遗传物质实现对检测对象的识别,PCR扩增18S rDNA,测序后比较物种间的差异,是病原学检测鉴定中的常用方法。实时荧光PCR则通过荧光基团标记的特异性探针,可以对PCR扩增过程实时监控以及对产物进行数字化分析,监测目标核酸扩增情况,该方法相比普通的PCR和常规形态学方法,具有耗时短的特点,良好的特异性和高灵敏度是病原筛查的优选技术,在物种鉴定领域有着广泛应用。本研究拟对进口大西洋鲑鱼携带的海虱成虫开展形态学研究,进一步做分子生物学分析,建立口岸检验检疫快速和实用的鉴定方法,严密监控外来海虱入侵我国。
1 材料与方法
1.1 材料
1.1.1 海虱 2017年1月-2019年8月,深圳海关病毒与免疫检验检疫实验室截获的347只海虱,均是从挪威进口的大西洋鲑鱼体上采集,并存放于-20℃待检。
1.1.2 试剂 DNA标准DL 2 000、Premix ExTaqTM(Probe qPCR)、T 载体、DNA 凝胶回收试剂盒、MiniBEST Plasmid Purification Kit等,宝生物工程(大连)有限公司产品;QIAamp DNA Mini Kit,Qiagen公司产品;琼脂糖H,Invitrogen公司产品。
1.1.3 仪器设备 M450C显微成像系统,德国蔡司公司产品;热循环PCR仪器、微量核酸蛋白浓度分析仪(Nanodrop 2000C),美国Thermo Fisher Scientific公司产品;实时荧光PCR仪(7500型),ABI公司产品;凝胶成像系统,Bio-Rad公司产品。
1.2 方法
1.2.1 形态学鉴定 海虱通常定植在大西洋鲑鱼的体表鳞片上或者鳃丝上,将从鱼体上采集的海虱置于培养皿中,加少量生理盐水,置于体视显微镜下,观察试验样本的外部形态特征,并使用M450C显微成像系统对其进行拍照记录,其形态学鉴定标准参考Johnson S C等[14]对海虱形态发育的描述。
1.2.2 PCR鉴定
1.2.2.1 目的基因的扩增及电泳分析 在NCBI上获取19种海虱的18S rDNA序列,通过多序列比对,在保守区域设计扩增引物。使用QIAamp DNA Mini Kit试剂盒提取所有海虱样品的基因组DNA,保存于-20 ℃。以样品的基因组DNA为模板,以SL18S-F和SL18S-R引物对海虱的18S rDNA进行PCR扩增。PCR反应体系包括2×PCR buffer 12.5 μL,20 μmol/L的SL18S-F、SL18S-R引物各1 μL,最后加DEPC水及模板补足25 μL。反应条件经优化后为:95 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 10 min。PCR扩增结束后,将反应产物进行10 g/L琼脂糖凝胶电泳,观察反应结果,将PCR产物送至华大基因公司进行测序。
1.2.2.2 序列比对 使用DNA Star对扩增的18S rDNA序列进行序列比对,一般认为序列同源性为99%以上认定为一种。并根据P-距离计算序列的变异程度,序列变异在1%以内,则认定为同一种。参考GenBank序列数据库(表1),通过序列的系统发育分析对寄生虫做确证鉴定。
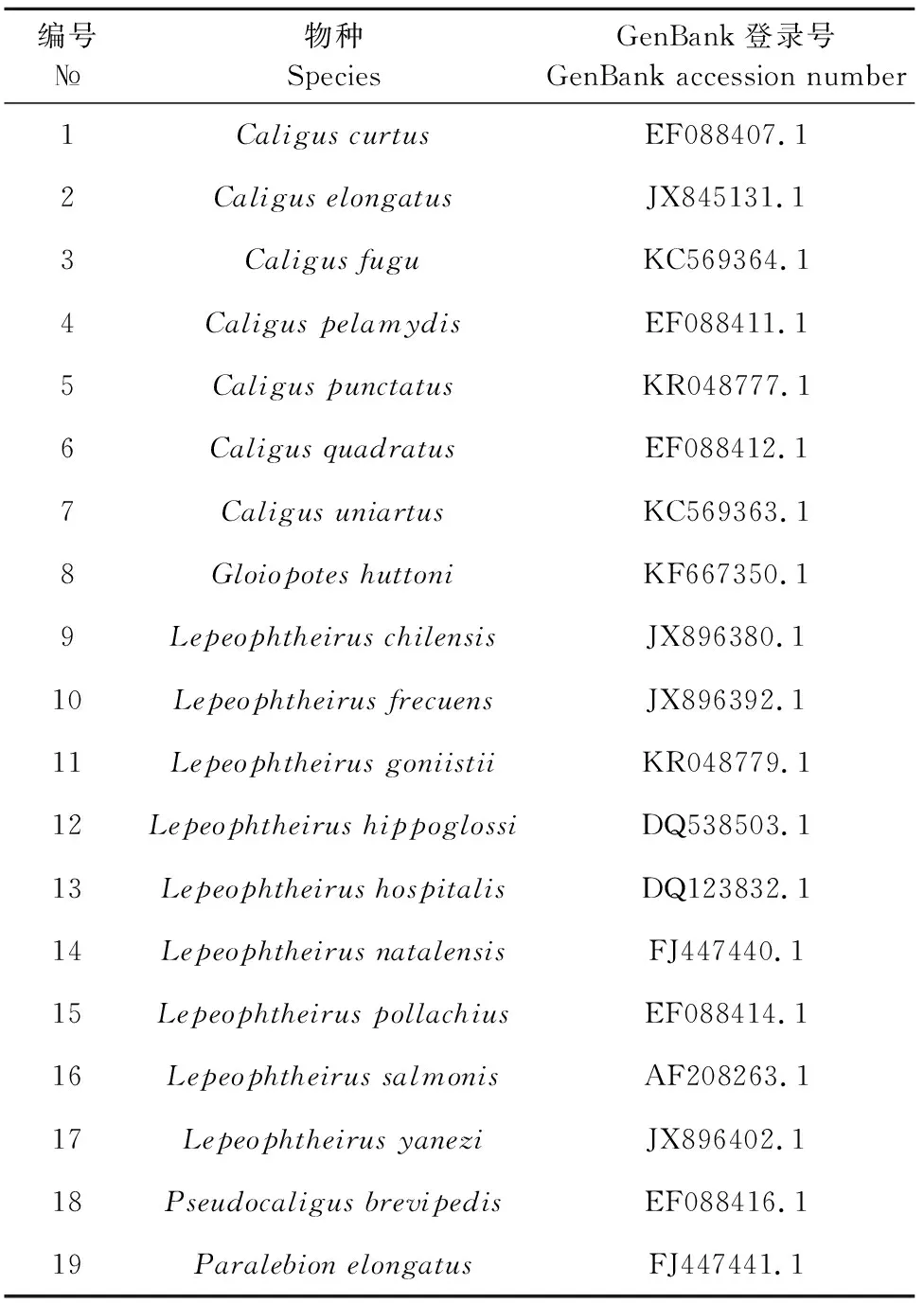
表1 PCR扩增引物设计和系统发育树构建参考序列
1.2.2.3 基于18S rDNA的系统发育分析 将样品测序后得到的样品的18S rDNA序列与19种已发表的分属于5个属的鱼虱科物种的18S rDNA基因序列一起构建分子系统发育树,并选取Anthosomacrassum为外类群。用MEGA7.0软件邻接法(Neighbor joining,NJ)基于Kimura2-Prameter方法计算遗传距离值,计算Bootstrap值,重复1 000次,构建基于18S rDNA序列的分子进化树。
1.2.3 实时荧光PCR鉴定
1.2.3.1 引物与探针的设计 通过对比海虱的18S rDNA基因序列,选取碱基序列差异较小的位点,利用Oligo软件设计一对特异性引物和一条探针,由华大基因生物有限公司合成(表2)。
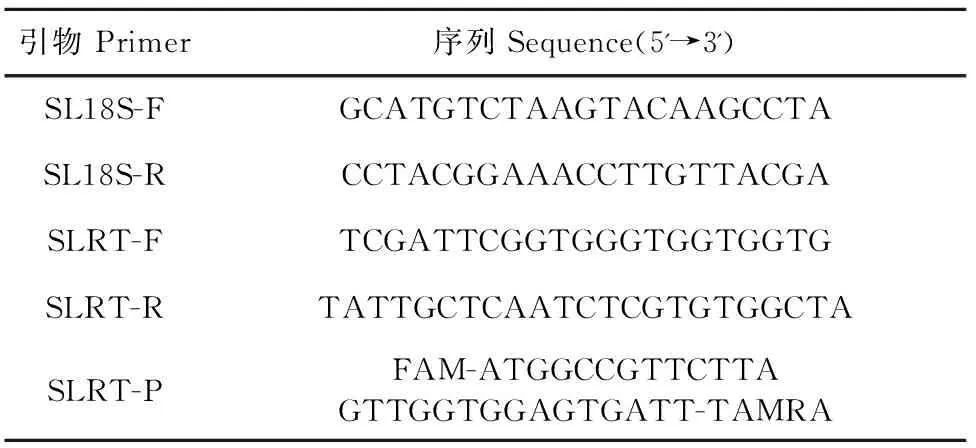
表2 本试验中所用的引物和探针序列
1.2.3.2 标准品的制备 以PCR扩增鲑疮痂鱼虱的18S DNA基因序列,将扩增产物的基因片段进行纯化回收,纯化产物与pMD18-T载体4 ℃连接过夜,转化入大肠埃希氏菌DH5α中,经鉴定后将阳性菌液送至金维智生物有限公司测序验证,测序正确的菌株用于提取质粒,制备质粒标准品。重组质粒浓度并按公式:模板拷贝浓度(拷贝/μL)=重组质粒质量浓度(mg/L)×6.02×1014/(660×重组质粒碱基数)。
1.2.3.3 标准曲线的建立 利用微量核酸蛋白浓度分析仪测定质粒标准品浓度,将其10倍梯度稀释,作为已知浓度的标准品进行实时荧光PCR反应绘制标准曲线。反应体系为2×premix ExTaq(Probe qPCR) 10 μL,20 μmol/L的上、下游引物各0.4 μL、探针0.8 μL,ROXⅡ 0.5 μL,加入模板和水补足25 μL。反应程序第一步:95 ℃ 30 s,1个循环;第二步:95 ℃ 10 s,60 ℃ 45 s,40个循环。同时做3个平行样,测定灵敏度并计算标准曲线。
1.2.3.4 海虱样品的实时荧光PCR鉴定 以1.2.1中保存的所有海虱核酸样品作为模板,按照前述反应体系和程序进行实时荧光PCR,用于检测该方法的实用性。
2 结果
2.1 海虱的形态学鉴定
从进口大西洋鲑鱼体上收集到347个海虱样品均为成虫形态,使用体视显微镜观察发现有如下特征:虫体大致可以分为头胸部、腹部和尾部3个部分(图1A~G)。

A.背部;B.腹部;C.雌性;D.雄性 ;E.头胸部的腹面;F.雄性的腹部和尾部;G.雌性的腹部和尾部;1.第一触角;2.第二触角;3.第一颚足;4.口器;5.胸叉;6.第四胸足;7.第二胸足;8.第五胸足;9.尾叉;10.尾刚毛;11.生殖节;12.卵串;13.卵A.Back;B.Abdomen;C.The female;D.The male;E.Ventral part of cephalothorax;F.Abdomen and tail of male;G.Abdomen and tail of female;1.First antenna;2.Second antenna;3.First maxilliped;4.Mouthpart;5.Chest fork;6.The fourth leg;7.The second leg;8.The fifth leg;9.Caudal rami;10.Caudal rami setae;11.Genital segment;12.Egg strings;13.Eggs
头胸部形态扁平,呈盾状,头与前3个胸节愈合并覆以胸甲,第4胸节没有覆盖胸甲,第1和第2触角具有鄂钩,并附有触毛;第1和第2颚足尖端似爪,具有抓握作用,能够牢固附着在鱼体,第4对胸足异常发达,协助虫体运动。腹部仅有一节且宽度和长度均小于头胸部,第5胸足与生殖节愈合。尾部具有一节,末端分为2个尾叉,每个尾叉有4根尾刚毛。成虫形态特征明显分两类,经鉴别为性别差异,雌性腹部生殖节呈圆柱形,长度和宽度相差不大,具有狭窄倾斜的前外侧边缘,部分个体还带有2条卵串(图1 C);雄性的腹部生殖节的宽度小于长度,呈卵圆型,第5对胸足有4根刚毛,位于节段中间靠近侧缘的位置(图1D)。所有样品总体符合鲑疮痂鱼虱发育阶段成虫时期的形态特征的描述,初步判断从大西洋鲑鱼所截获样品为典型的海虱。但是,除了上述显著特征差异,所截获的海虱在个体形态、发育阶段和色素沉积上仍然有一些较大的差异,所有样品是否属于同一类,形态学方法难以直接判断其种属,因此,需要借助分子生物学手段来进一步做类属分析。
2.2 PCR鉴定
2.2.1 PCR扩增 根据数据库中海虱的序列设计引物,进行PCR扩增,用10 g/L琼脂糖凝胶电泳检测扩增产物,进口大西洋鲑鱼携带的所有海虱样品均能扩增出1条明亮清晰大小约为1 700 bp的条带,与预计PCR产物大小一致,且条带单一(图2)。表明本试验所设计的引物能对采集样品的18S rDNA片段得到有效扩增,然后将所有扩增产物测序分析。
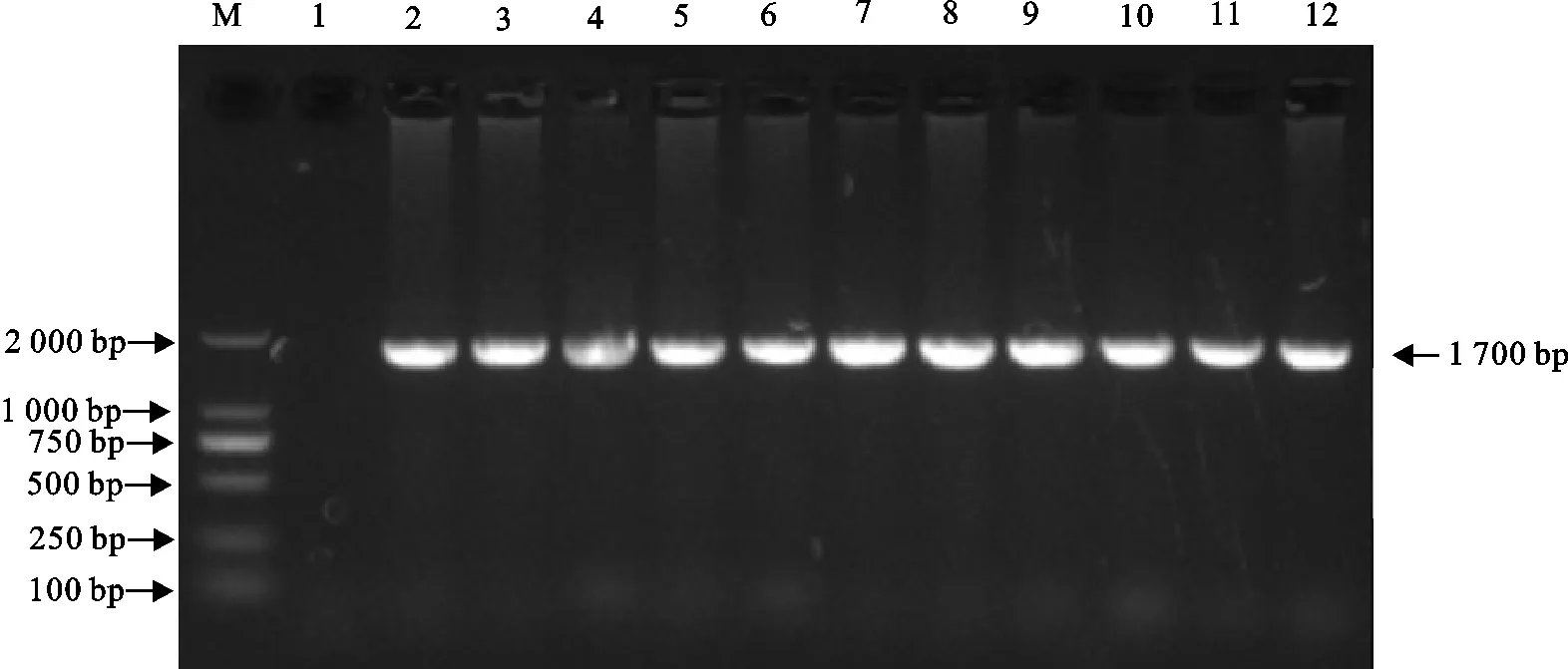
M.DNA 标准DL 2 000;1.阴性对照;2~11.部分海虱样品M.DNA Marker DL 2 000;1.Negative control;2-11.Partial samples of sea lice
2.2.2 多序列比对及Blast比对 使用MegAlign软件分别对347个样品获得的测序序列进行多序列比对。结果发现其中286个样品序列完全一致,其余61个样品序列完全一致,归类为序列1和序列2两类,其结果如图3所示,两类序列共有65个碱基变异位点,序列间总相似度为96.01%。分别将两类序列在GenBank进行Blast比对,结果显示,序列1和序列2分别与鲑疮痂鱼虱(Lepeophtheirussalmonis,LS)和长鱼虱(Caliguselongatus,CE)具有最高同源性。

阴影部分表示序列之间差异位点The shadow parts indicate the different sites between the sequences
2.2.3 基于18s rDNA序列的系统发育分析 将两类海虱的18S rDNA序列和在NCBI上获得的19种海虱的18S rDNA序列构建基于邻接法的系统发育树(图4)。结果表明,本研究通过PCR扩增获得的序列1和序列2的分别与鲑疮痂鱼虱(Lepeophtheirussalmonis)和长鱼虱(Caliguselongatus)聚为一簇,分属于鱼虱科的不同属。在进化树中属于同一科的物种聚于同一大支,每个科中同一属聚于同一分支,在进化树中可以体现出不同科、属的进化关系。表明来自于挪威的进口大西洋鲑鱼受到两种海虱的感染,主要是鲑疮痂鱼虱,占截获样品总数的82.42%,另一类病原为长鱼虱,占截获样品总数的17.58%。两类都是在我国没有报道的寄生虫类群,为典型的外来物种。
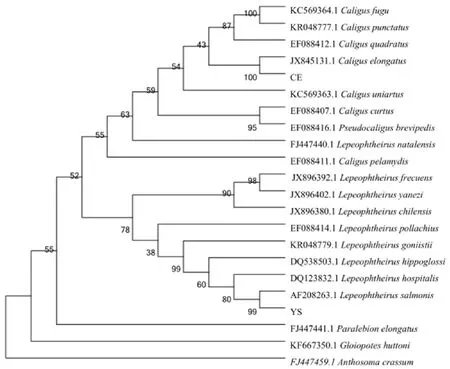
图4 基于18S rDNA序列的系统发育树
2.3 实时荧光PCR鉴定
重组标准品质粒通过公式计算得知浓度为3.2×107拷贝/μL,经10倍梯度稀释后,以2.94×100拷贝/μL~2.94×107拷贝/μL的重组质粒为扩增模板进行实时荧光PCR扩增,不同浓度梯度重组质粒的扩增曲线见图5,在40个循环内最低检出浓度为2.94拷贝/μL;以起始模板浓度的对数为横坐标,Ct值为纵坐标自动生成的标准曲线见图6,相关系数R2为0.998,呈现良好的线性关系,线性回归方程为:y=-3.33logx+35.38,由此可见,模板浓度与Ct值之间存在较好的线性关系,该方法具有良好的重复性和灵敏度。

1~8.2.94×107拷贝/μL的标准品质粒~2.94×100拷贝/μL的标准品质粒1-8.2.94×107 copy/μL-2.94×100 copy/μL
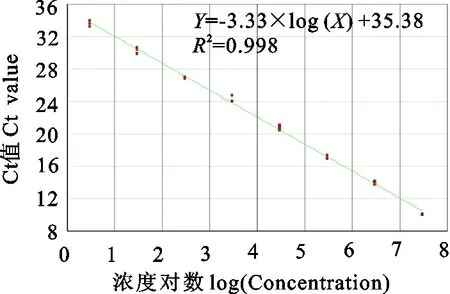
图6 标准品的标准曲线
用建立的实时荧光PCR对所有样品的核酸鉴定,无论鲑疮痂鱼虱还是长鱼虱样品均能够得到阳性结果(图7),与PCR鉴定结果一致,表明建立的快捷检测方法对两类海虱都能够有效检出。当样品为无明显形态特征的虫卵或者幼虫时,由于具有很高的灵敏性,有效降低漏检率,且整个过程操作简单,耗时短,仅需70 min即可完成,可以使用该方法作为初筛技术,检测结果为阳性的样品可以进一步做测序鉴定,是PCR的有效替代技术。
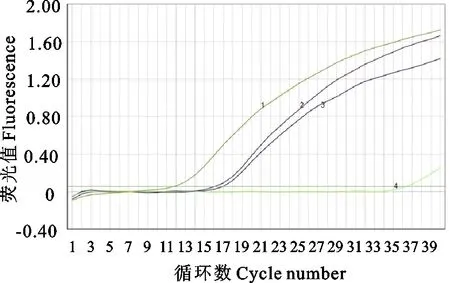
1.阳性对照;2.LS样品;3.CE样品;4.阴性对照1.Positive control; 2.LS sample; 3.CE sample; 4.Negative control
3 讨论
本研究首次报道进口大西洋鲑鱼有携带外来物种海虱入境的风险。海虱是一种桡足类海水动物寄生虫,主要分布于北大西洋和北太平洋的野生和养殖的大西洋鲑鱼上,尤其鲑疮痂鱼虱,给大西洋鲑鱼养殖场造成了巨大的经济损失。如何控制海虱感染鲑鱼已被水产养殖行业列为首要任务之一[15]。本研究鉴定了来自于挪威的大西鲑鱼上寄生的海虱,鉴定结果显示鱼体携带有两种海虱,分别是鲑疮痂鱼虱和长鱼虱,其中占比较高的物种是鲑疮痂鱼虱。且在18S DNA水平上,无论是鲑疮痂鱼虱还是长鱼虱都未出现分型,与基于CO1分型研究的结果一致[16]。Stone J等[17]报道了在挪威海域的确分布有这两个海虱,并且在苏格兰地区对这2种海虱开展过防治研究。根据Treasurer J W等[18]的描述,鲑疮痂鱼虱主要侵染大西洋鲑鱼的头部和背部,而长鱼虱主要在腹鳍和尾部有较高的比例,并不存在太大的寄生空间竞争,因此,这两个物种可以共同生存在同一个体上,并都可以对大西洋鲑造成相同的病情。本研究收集的进口鲑疮痂鱼虱在形态上与我国黄、渤海发现的5种疮痂鱼虱较为相似,它们之间是否有相同的感染性目前还未知。我国目前正在大量淡水养殖虹鳟,而且沿海也已经引种大西洋鲑,开始海洋养殖。虽然在国内养殖的虹鳟上还未见海虱感染报道,但是,有报道1990年在台湾的莫桑比克罗非鱼上发现了与长鱼虱同属Caligusepidemicus[19]的寄生虫感染,目前,来自于挪威大西洋鲑鱼携带的2种海虱存在感染国内养殖鲑鳟鱼的风险。根据时空分布特点和易感物种分析,海虱一旦侵入我国,将会对我国的海水鲑鱼养殖业造成损失,因此,识别和监控外来海虱入侵至关重要。
本研究获得的样品均为成虫,但海虱有10个发育阶段,每个阶段形态差异都较大,在成年前期Ⅰ,雌雄个体还有极大差别[2]。海虱虫体较小,成虫体长约为6 mm~11 mm,使用肉眼和普通显微镜难以辨识。在进口大西洋鲑鱼的鱼体上有可能携带虫卵或者正处于甲壳阶段的幼体,这些阶段的海虱个体小,形态差异大,如果仅用形态学方法筛查,存在遗漏的风险,本研究采用形态学鉴定和辅以分子生物学手段,能在基因水平筛查和鉴定海虱属种。本研究基于18S rDNA基因序列建立的实时荧光PCR方法,最低检测为2.94拷贝/μL,耗时短,仅需70 min即可完成检测,能够快捷地鉴定海虱,可以作为一种快速的初筛方法,设计的引物和探针对两种海虱有相同的扩增效率,可以同步筛查两种海虱。与Jonhard E等[20]基于圆鳍鱼(Cyclopteruslumpus)线粒体细胞色素氧化酶Ⅰ(COI)建立检测胃液中的鲑疮痂鱼虱实时荧光PCR相比,针对性更强,灵敏度更高。建立的PCR,配合测序技术,可以精准鉴定海虱的类属,为预警进口大西洋鲑鱼上携带的海虱入侵我国提供了实用的鉴定方法和技术支持。
