胰腺癌中GRP78表达及其对预后的影响
2021-01-22沈珊珊蒋廷页杨天宇张永胜曹志飞蔡为民
沈珊珊,蒋廷页,杨天宇,钮 慧,张永胜,曹志飞,蔡为民
胰腺癌是预后较差的恶性肿瘤之一,5年生存率为5%~8%,其发生、发展在分子水平上具有高度的异质性[1-2]。随着分子生物学技术的迅速发展,学者们对胰腺癌的基因特点有了更深入的认识,但缺乏早期发现和有效干预仍然是胰腺癌患者预后差和生存率低下的主要原因[3]。GRP78是一种普遍表达于内质网的伴侣蛋白,已有多项研究表明其在胃癌、肝细胞肝癌、乳腺癌等多种恶性肿瘤中过度表达,并且与患者预后不良有关,其机制可能与促进细胞增殖、侵袭和转移以及抑制肿瘤细胞凋亡有关[4-5]。目前,GRP78在胰腺癌中表达的相关报道较少[6]。本文旨在探讨GRP78在胰腺癌中的表达及预后意义,为探索新的诊断生物标志物和治疗靶点提供思路。
1 材料与方法
1.1 材料胰腺癌组织芯片(HPan-Ade180Sur-02)购自上海芯超公司。组织芯片含有胰腺癌组织100例,相应癌旁组织80例,每例有1个组织块。所有患者在术前均未接受过放、化疗或生物学治疗,且对参与的研究均知情同意。在手术标本中随机挑选20例新鲜胰腺癌组织及其对应癌旁正常胰腺组织-196 ℃液氮保存,用于qRT-PCR检测。
1.2 免疫组化石蜡标本4 μm厚切片,免疫组化染色采用EnVision法,DAB显色。GRP78(多克隆抗体,兔抗,克隆号:ab32618)购自Abcam公司。GRP78阳性定位于细胞质。按细胞着色强度计分:无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞所占百分比计分:阳性细胞数<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。两项计分结果相乘作为最终结果:0~4分为低表达,≥5分为高表达。
1.3 GEPIA数据库分析采用GEPIA数据库(http://gepia.cancer-pku.cn/)对GRP78 mRNA在171例正常胰腺组织与179例胰腺癌组织中的表达进行分析。
1.4 qRT-PCR采用TRIZOL试剂盒提取胰腺癌和癌旁正常组织总RNA,并逆转录成cDNA。利用qRT-PCR检测GRP78基因的表达。GRP78引物序列:上游5′-TGTTCAACCAATTATCAGCAAACTC-3′,下游5′-TTCTGCTGTATCCTCTTCACCAGT-3′。β-actin引物序列:上游5′-CACCATTGGCAATGAGCGGT TCC-3′,下游5′-GTAGTTTCGTGGATGCCACAGG-3′。PCR反应条件:95 ℃ 5 min、95 ℃ 10 s、63 ℃ 30 s,合计40个循环,PCR反应结束后分析溶解曲线,每个组织样本设3个复孔,按照2-ΔΔCt计算基因的相对表达量。
1.5 统计学分析所有数据应用SPSS 24.0软件进行统计学分析。计数资料率的比较采用χ2检验。Cox回归模型进行单因素及多因素分析。Kaplan-Meier法绘制生存曲线,Log-rank法比较组间生存差异。应用Prism 7.0软件绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征100例胰腺癌中男性63例,女性37例。患者年龄34~85岁,中位年龄61岁。肿瘤直径≤4 cm者61例、>4 cm者39例。肿瘤位于胰头62例、胰体尾37例。组织类型:导管腺癌91例、腺鳞癌6例、黏液腺癌3例。肿瘤病理分级:中分化68例、低分化32例。依据2009年美国癌症联合委员会(AJCC)第7版胰腺癌分期:Ⅰ期40例、Ⅱ期58例,Ⅲ期0例,Ⅳ期2例。
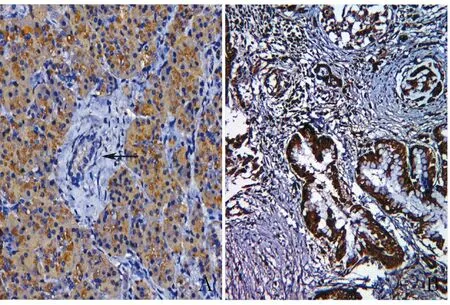
2.2 胰腺癌中GRP78的表达GEPIA数据库分析:GRP78 mRNA在179例胰腺癌组织中的表达水平显著高于171例癌旁正常组织(P<0.05,图1)。免疫组化检测100例胰腺癌组织中GRP78蛋白表达结果显示:35例(35%)低表达,65例(65%)高表达;GRP78蛋白在癌旁正常导管上皮中44例低表达(55%),36例(45%)高表达,两组相比差异有显著性(P=0.007,图2)。qRT-PCR检测20对胰腺癌组织和癌旁正常组织,结果显示:GRP78 mRNA相对表达量在胰腺癌组织中为(208.89±37.31)%,在癌旁正常组织中为(100.00±11.56)%,差异有统计学意义(P<0.05)。

图1 胰腺癌和癌旁组织中GRP78 mRNA的表达(GEPIA数据库)
AB
2.3 胰腺癌中GRP78蛋白表达与临床病理特征的关系癌组织中GRP78蛋白表达上调与肿瘤直径>4 cm(P=0.036)、分化程度低(P=0.019)及较高的T分期(P=0.017)密切相关,与患者性别、年龄、肿瘤部位、N分期及AJCC临床分期无明显相关性(表1)。
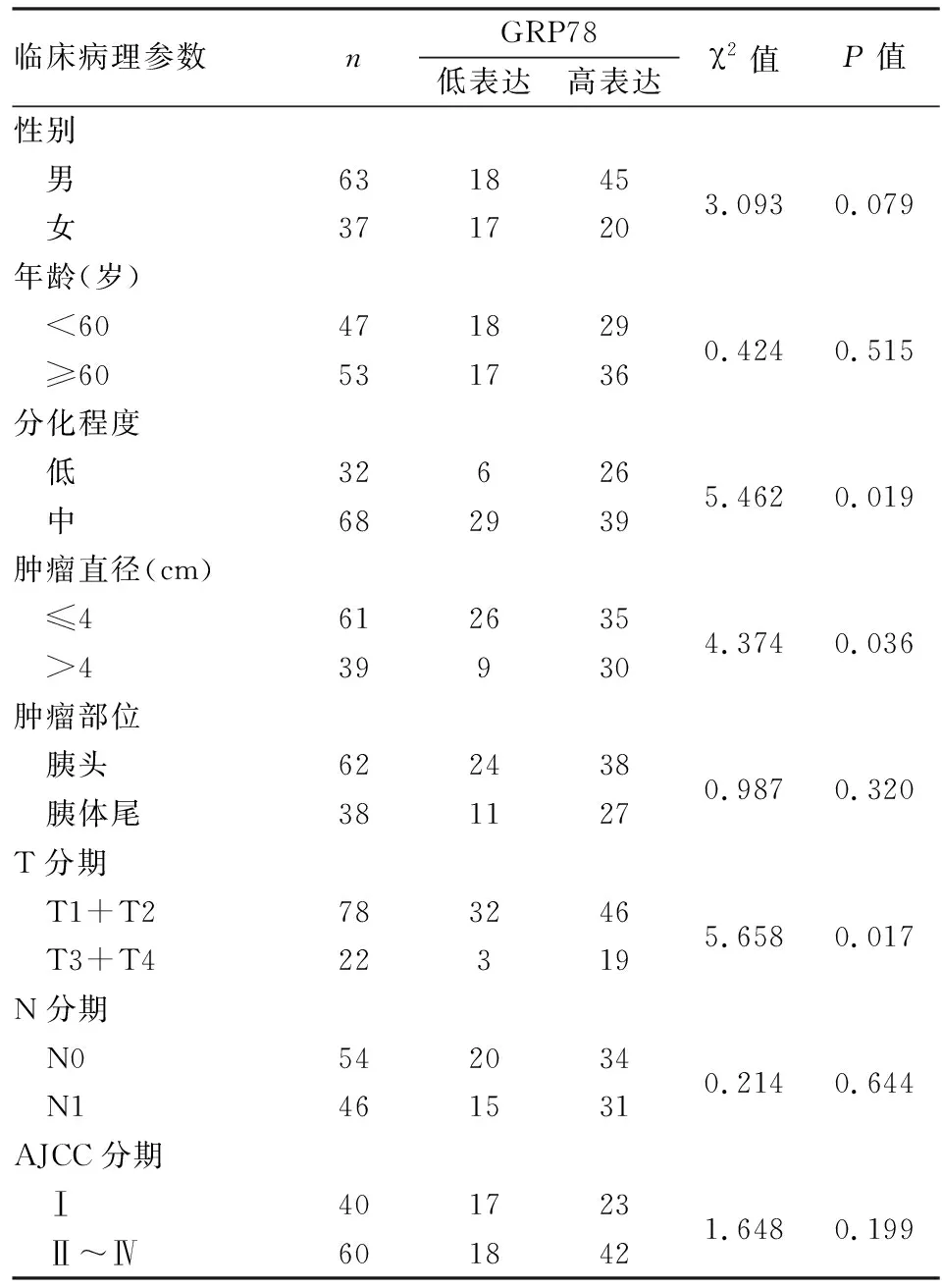
表1 胰腺癌中GRP78表达与临床病理特征的关系
2.4 预后分析单因素分析结果显示,肿瘤分化程度、N分期、AJCC分期及GRP78表达与胰腺癌患者预后相关(P<0.05,表2)。多因素分析结果显示,肿瘤分化程度是胰腺癌独立的预后因素(P=0.005,表3)。生存分析显示,癌组织中GRP78蛋白高表达组患者的总生存时间低于低表达组(P=0.010,图3)。
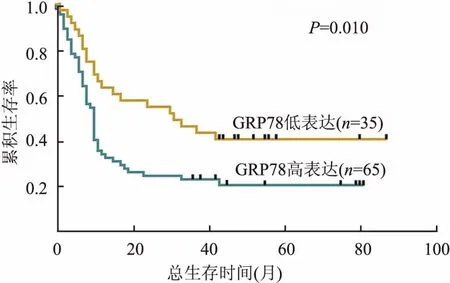
图3 胰腺癌组织中GRP78蛋白高表达组与低表达组患者生存曲线

表2 影响胰腺癌预后的单因素分析
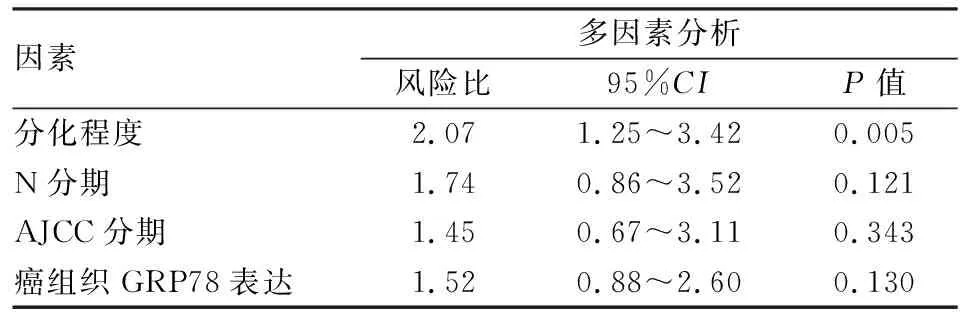
表3 影响胰腺癌预后的多因素分析
3 讨论
GRP78也称为免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein in pre-B cells, BiP),是一种分子伴侣,属于热休克蛋白70(heat shock protein 70, HSP70)家族[5]。GRP78蛋白主要分布在内质网,参与蛋白质折叠和组装,以及错误折叠蛋白质的蛋白酶体降解[7]。在实体肿瘤中,缺氧、葡萄糖或营养缺乏、乳酸酸中毒等肿瘤微环境触发内质网应激。GRP78蛋白是内质网应激转录激活的必要成分[8]。大量研究表明,GRP78蛋白高表达可以促进癌细胞的增殖、存活、抗凋亡、免疫逃逸、转移、血管生成和耐药[9]。相反,通过抗GRP78特异性抗体中和GRP78可以在体、内外抑制肿瘤的生长和转移[10]。因此,GRP78表达可以作为肿瘤生物学行为和治疗反应的生物学标志物,以及作为新疗法的潜在靶标。
GRP78蛋白作为内质网应激相关蛋白,其在多种恶性肿瘤中表达上调,如胃癌[8]、乳腺癌[4]、前列腺癌[11]、恶性黑色素瘤[12]等,促进肿瘤细胞的增殖、侵袭和转移,并且血清GRP78蛋白水平可以评估乳腺癌的治疗效果和预测预后[4]。Niu等[6]发现,与邻近非肿瘤组织正常胰腺导管上皮细胞相比,GRP78蛋白在胰腺癌细胞中表达更高,而且在肿瘤组织中表达上调与较高的T分期和较短的总生存期密切相关。本组通过GEPIA在线数据库和免疫组化检测分析GRP78基因和蛋白的表达,数据显示:与癌旁正常导管上皮细胞相比,GRP78 mRNA和蛋白在胰腺癌组织中表达上调。此外,本组实验发现GRP78蛋白上调与肿瘤直径>4 cm、分化程度低及较高的T分期显著相关,并且癌组织中GRP78蛋白高表达的患者总生存期较短,表明GRP78在胰腺癌的进展中起着至关重要的作用,并可作为胰腺癌患者早期有效诊断和术后预后评估的生物学标志物。GRP78在癌旁正常胰腺腺泡细胞中高表达,原因可能是癌旁的腺泡细胞受到慢性炎症刺激,诱发了内质网应激[6,13]。本实验也发现在癌旁胰腺腺泡细胞中GRP78蛋白高表达的现象。
GRP78蛋白在恶性肿瘤进展中的主要作用是促进肿瘤的增殖、侵袭和转移。研究表明,GRP78通过提高CyclinD1、CDK4和CDK6的表达促进胰腺癌细胞的增殖[6]。CyclinD1、CDK4和CDK6是控制细胞增殖G1期的关键蛋白,GRP78可能通过改变细胞周期来影响胰腺癌细胞的增殖[6]。GRP78蛋白过表达通过增加基质金属蛋白酶(matrix metallopeptidase, MMP)的分泌和活性以及调节细胞骨架的动力学来促进胰腺癌细胞的侵袭,FAK和JNK是GRP78诱导的胰腺癌细胞侵袭的关键下游信号传导。一项体外研究表明,GRP78通过诱导胰腺癌细胞上皮-间质转化促进癌细胞的侵袭和转移[14]。
总之,本实验结果显示胰腺癌组织中GRP78基因和蛋白表达水平上调,并且与较低的分化程度和较高的T分期有关,提示患者预后不良。GRP78蛋白在胰腺癌进展中具有重要作用,其生物学机制仍需要进一步分析,可能提高胰腺癌患者的早期诊断效率,有望成为靶向治疗的新靶点。
