头颈鳞状细胞癌中HSDL2的表达水平及临床意义
2021-01-22王艺璇王馨悦林贞花金爱花
王艺璇,王馨悦,林贞花,孙 洁,杨 洋,金爱花
头颈鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)是指由口腔、口咽、喉部和下咽的鳞状上皮细胞形成的一组恶性侵袭性肿瘤[1],其发病率占头颈部肿瘤总发病率的95%以上[2]。由于HNSCC发病的高隐匿性、高转移性以及缺乏有效的早期诊断标志物,患者的5年生存率仅40%~50%[3-4]。因此,探寻HNSCC的早期诊断标志物刻不容缓。人类羟基类固醇脱氢酶样蛋白2(hydroxysteroid dehydrogenase like 2, HSDL2)作为短链脱氢酶/还原酶(SDR)超家族中的成员之一,在乳腺癌[5]、甲状腺乳头样癌[6]、卵巢癌[7]和胃癌[8]等多种恶性肿瘤中异常表达且发挥重要作用。目前,关于HSDL2在HNSCC中的表达尚未见报道。本文旨在探讨HSDL2在HNSCC中的表达及临床意义,为筛选HNSCC的早期诊断标志物和药物治疗靶点提供可能的分子生物学指标。
1 材料与方法
1.1 材料
1.1.1临床资料 组织芯片购自西安艾丽娜公司,包括61例HNSCC组织标本和11例癌旁正常组织标本。61例HNSCC中男性51例,女性10例;年龄<60岁者34例,≥60岁者27例;有淋巴结转移者19例,无淋巴结转移者42例;组织分化程度:高分化16例,中分化32例,低分化13例;临床分期:Ⅰ+Ⅱ期28例,Ⅲ+Ⅳ期33例。
1.1.2主要试剂 HSDL2抗体购自美国Proteintech公司(15631-1-AP),免疫组化SP两步法试剂盒、柠檬酸缓冲液、PBS缓冲液、DAB显色剂和苏木精染料,均购自北京中杉金桥公司。
1.2 方法
1.2.1生信分析 应用UALCAN数据库(http://ualcan.path.uab.edu/index.html)[9]分析HNSCC组织和正常组织中HSDL2 mRNA的表达及其与临床病理特征的关系;应用HPA数据库(https://www. proteinatlas.org/)[10]分析HSDL2蛋白(抗体编号HPA050453)在HNSCC组织和癌旁正常组织中的表达水平及其与患者总生存期的关系;应用STRING数据库(https://string-db.org)[11]分析HSDL2的蛋白互作网络及其可能参与的生物学进程。
1.2.2免疫组化 采用免疫组化SP两步法检测HSDL2蛋白的表达水平,60 ℃烤片45 min,常规脱蜡,梯度乙醇水化,热柠檬酸盐缓冲液水浴30 min进行抗原修复,滴加一抗HSDL2(稀释浓度为1 ∶200),4 ℃孵育过夜;次日,辣根过氧化物酶标记二抗,DAB显色,苏木精复染,中性树胶封固。以PBS缓冲液代替一抗作为阴性对照组。
1.3 结果判断以细胞质内出现棕褐色颗粒为HSDL2蛋白阳性染色。(1)根据细胞染色强度计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(2)根据阳性细胞所占百分比计分:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项评分相乘作为最终得分:0分为(-),1~4分为(+),5~8分为(),9~12分为()。其中≤4分为低表达,>4分为高表达。
1.4 统计学分析所有数据使用SPSS 25.0软件进行分析,HSDL2表达与临床病理特征的相关性分析,采用χ2检验或Fisher精确检验法。以P<0.05为差异有统计学意义。
2 结果
2.1 HNSCC组织中HSDL2 mRNA的表达通过UALCAN数据库分析520例HNSCC组织和44例正常组织中HSDL2 mRNA的表达水平,结果显示:与正常组织相比,HSDL2 mRNA的表达水平在HNSCC中显著降低(P<0.01,图1A)。进一步分析HSDL2 mRNA的表达水平与临床病理特征的关系,发现其与HNSCC临床分期和淋巴结转移密切相关(P<0.05):HSDL2 mRNA在临床分期Ⅰ~Ⅳ期HNSCC组织中的表达水平显著低于正常组织(图1B);HSDL2 mRNA表达水平从淋巴结转移的N1~N3期呈逐渐降低趋势(P<0.05,图1C)。本组HPV阴性HNSCC组织中,HSDL2 mRNA表达水平亦显著低于正常组织和HPV阳性HNSCC组织(P<0.01,图1D),提示HSDL2与HNSCC的恶性演进密切相关。

图1 UALCAN数据库检索HSDL2 mRNA的表达:A.HSDL2 mRNA在正常组织和头颈鳞状细胞癌组织中的表达;B.HSDL2 mRNA表达水平与临床分期的关系;C.HSDL2 mRNA表达水平与淋巴结转移N分期的关系;D.HSDL2 mRNA表达水平与HPV感染的关系
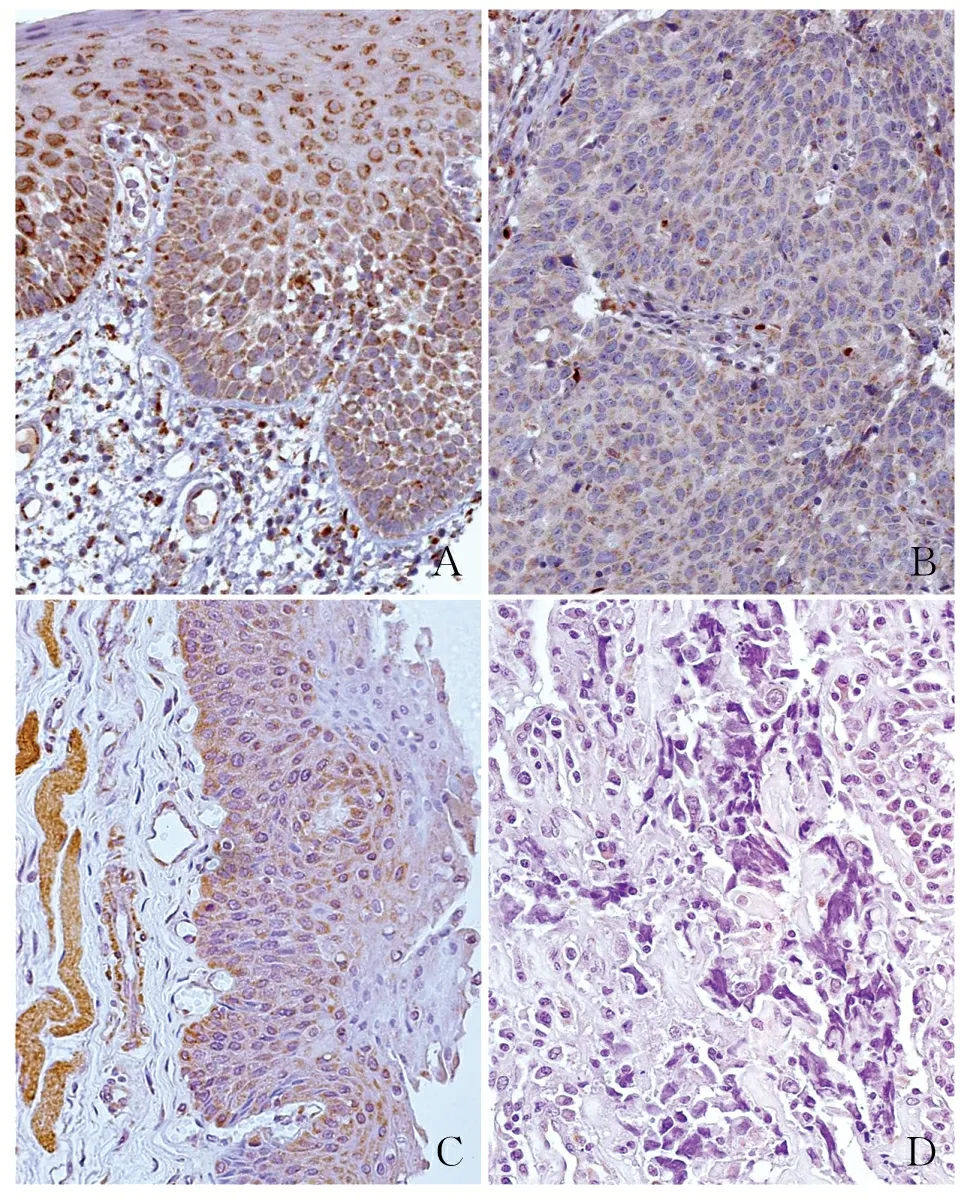
2.2 HNSCC组织中HSDL2蛋白的表达应用HPA数据库分析HSDL2蛋白在HNSCC组织和正常组织中的表达,结果发现HSDL2蛋白主要定位于细胞质,少量表达于细胞核,在正常口腔组织中高表达(图2A),在HNSCC组织中低表达(图2B),提示HSDL2表达下调与HNSCC发生的高风险密切相关。免疫组化结果显示HSDL2蛋白表达及定位与HPA数据库检索结果一致,即HSDL2蛋白在正常组织中高表达,且主要表达于细胞质(图2C),在HNSCC组织中低表达(图2D)。61例HNSCC组织中,HSDL2蛋白的阳性率(57.4%,35/61)和强阳性率(34.4%,21/61)均显著低于癌旁正常组织(阳性率90.9%,强阳性率81.8%),且差异有显著性(P<0.05,表1)。
ABCD

表1 正常组织和头颈鳞状细胞癌组织中HSDL2蛋白的表达
2.3 HNSCC组织中HSDL2蛋白表达与临床病理特征的关系通过分析HSDL2蛋白表达与HNSCC临床病理特征的关系发现:HSDL2蛋白低表达与HNSCC患者性别、年龄及分化程度无关,与临床分期(P<0.01)和淋巴结转移(P<0.05)密切相关(表2,图3)。HSDL2蛋白在临床分期Ⅲ+Ⅳ期HNSCC组织中的强阳性率(5/33,15.2%)明显低于Ⅰ+Ⅱ期HNSCC组织(16/28,57.1%)(P=0.001);HSDL2蛋白在有淋巴结转移HNSCC组织中的强阳性率(3/19,15.8%)明显低于无淋巴结转移HNSCC组织(18/42,42.9%)(P=0.047);提示HSDL2蛋白可能参与HNSCC的发生、发展。

ABCD

表2 头颈鳞状细胞癌中HSDL2蛋白表达与临床病理特征的关系[n(%)]
2.4 HSDL2蛋白与HNSCC患者预后的关系应用HPA数据库分析HSDL2蛋白表达与HNSCC患者预后的关系,结果发现HSDL2蛋白低表达组患者(n=393)的生存期低于高表达组患者(n=106),差异有统计学意义(P=0.014,图4);提示HSDL2蛋白低表达HNSCC的患者预后不良。

图4 HSDL2表达与HNSCC患者生存期的关系
2.5 HSDL2参与的生物学进程及蛋白互作网络应用STRING数据库分析HSDL2参与的生物学进程及蛋白互作网络。GO富集分析结果显示,HSDL2主要参与调控脂肪酸分解代谢、脂肪酸氧化、靶向调控过氧化物酶体、蛋白质的转运等生物学进程(图5A)。蛋白网络分析的结果显示,与HSDL2互作的蛋白主要包括ACSF2、ALDH3A2等(图5B,表3)。

图5 STRING数据库分析HSDL2可能参与的生物学进程及互作蛋白:A.HSDL2可能参与的生物学进程(GO富集分析);B.HSDL2互作蛋白网络图

表3 HSDL2 互作蛋白参与的生物学进程
3 讨论
HNSCC具有病情进展隐匿、早期临床症状不典型的特点,多数患者诊断时已发生淋巴结转移,致使HNSCC的发病率和病死率在全球范围内逐年升高[12-13]。由于HNSCC复杂的异质性,其机制尚未完全阐明;因此亟需进一步探索HNSCC中的分子标志物明确其可能的分子机制。
HSDL2最初鉴别于人胎脑组织的cDNA文库中,定位于染色体9q32位点,编码HSDL2蛋白[14]。该蛋白由418个氨基酸组成,包含N-端SDR结构域,C-端SCP-2结构域和过氧化物酶体靶向信号ARL[15],对糖、类固醇和脂肪酸的能量代谢具有重要作用[16]。HSDL2作为类固醇脱氢酶家族成员之一,不仅与过氧化物酶体结合,而且还能够与辅酶NADPH相互作用形成复合体[15],进而调控胆固醇代谢[17-18]。近年研究显示,HSDL2作为脂代谢中有效的调节因子在多种肿瘤中异常表达。Ruokun等[19]研究发现,HSDL2在人脑胶质瘤组织中异常高表达,且可正向调控胶质瘤细胞的增殖、周期阻滞和凋亡。Shi等[20]研究亦证实,下调HSDL2表达不仅可体外抑制肺腺癌细胞的增殖、侵袭和迁移,还可降低体内荷瘤的形成率及转移率。然而,HSDL2在HNSCC发生、发展中的作用尚未见报道。
本组通过UALCAN数据库分析发现,HSDL2 mRNA表达在HNSCC中显著降低,其低表达与临床分期、淋巴结转移密切相关(P<0.05)。HPV作为HNSCC的预后标志物之一,可预示患者的转归。HPV阳性HNSCC患者具有更长的总生存期和无瘤生存期,且与治疗模式无关[21]。本组通过数据库分析亦发现,HSDL2在HPV阴性HNSCC组织中的表达水平低于正常组织和HPV阳性HNSCC组织(P<0.01),因此HSDL2低表达提示HNSCC不良预后可能与HPV感染有关,但仍需深入分析。免疫组化染色结果显示,HSDL2蛋白在HNSCC组织中的表达显著低于正常癌旁组织(P<0.05)。该结果与HPA数据库一致,HSDL2蛋白在正常组织中呈中~高表达,在HNSCC组织中呈低表达。进一步分析发现,HSDL2蛋白表达与HNSCC临床分期(P=0.001)、淋巴结转移(P=0.047)呈负相关;提示HSDL2可能是作为抑癌基因在HNSCC的恶性演进中发挥作用,与Zhang等[22]在胆管癌中的研究结果相符。进一步通过HPA数据库对HSDL2蛋白表达与HNSCC患者预后的相关性进行分析,发现HSDL2蛋白低表达患者的生存期更低,提示HSDL2蛋白低表达可能是判断HNSCC不良预后的潜在分子标志物。
此外,通过STRING数据库分析发现,HSDL2参与调控蛋白转运和脂质代谢过程。这可能与HSDL2的特异性结构域有关。研究发现,HSDL2可通过C-端结构域中包含的PTS1特异性靶向过氧化物酶体,参与脂肪酸的过氧化物酶体的氧化过程[17]。同时,蛋白互作网络分析结果显示,HSDL2可与过氧化物酶体活化相关蛋白ECH1[23]、调节脂肪酸β-氧化过程的ALDH3A2[24]相互作用。上述结果说明,HSDL2调控蛋白转运和脂质代谢可能涉及多种生物学途径,其具体分子机制有待进一步分析。
近年多项研究证实HSDL2在肿瘤中扮演的角色具有“双重性”[5-8,22],但HSDL2的所有研究仅局限在细胞表型和分子标志物,具体调控机制尚未见报道。因此,推测HSDL2的“双重性”可能与以下几个方面有关:(1)HSDL2在不同肿瘤细胞中的定位不同,导致其参与的生物学过程以及信号通路不同;(2)不同肿瘤的组织特异性也可导致HSDL2的差异表达;(3)不同肿瘤细胞的微环境也可导致HSDL2的基因双重性;(4)相关的致癌/抑癌基因也可影响HSDL2的生物学作用。总之,HSDL2的“双重性”取决于肿瘤细胞类型、微环境、相关基因等因素,是HSDL2未来研究的重点。
综上所述,HSDL2在HNSCC中的表达有不同程度的下调或缺失,其低表达提示肿瘤有较强的恶性程度和转移潜能,对HNSCC的早期诊断和预后评估具有一定的指导意义。
