实时荧光定量PCR是检测结直肠癌BRAF V600E突变的理想方法
2021-01-22王丛阳郭文文王家俊
王丛阳,郭文文,王家俊,熊 林,金 宁,王 焱
结直肠癌是消化道常见的恶性肿瘤之一,约有15%发生BRAF基因突变,而BRAF基因突变约90%为BRAF V600E突变。目前对BRAF V600E突变的检测手段有两种:免疫组化和分子检测,分子检测目前应用较多的是荧光定量PCR技术。本实验应用免疫组化和实时荧光定量PCR(real-time fluorescence quantitative PCR, qRT-PCR)技术对结直肠癌标本BRAF V600E突变状况进行检测,并对这两种检测方法结果进行分析,以期评价这两种方法在结直肠癌中的应用价值。
1 材料与方法
1.1 临床资料收集2018年1月~2019年12月南京医科大学第二附属医院病理科存档的结直肠癌标本113例,其中男性65例,女性48例,平均年龄69岁。113例结直肠癌标本均同时行免疫组化和qRT-PCR检测BRAF V600E的突变状况。
1.2 试剂(1)免疫组化试剂:BRAF V600E鼠单克隆抗体(克隆号VE1)、Opti View DAB免疫组化检测试剂盒、苏木精染液、返蓝染液均购自美国Roche公司。(2)qRT-PCR试剂:核酸提取试剂盒、人类BRAF V600E突变检测试剂盒均购自厦门艾德生物公司。
1.3 方法
1.3.1免疫组化 手术标本均经10%中性福尔马林固定12~48 h,常规全自动脱水机脱水,石蜡包埋,经全自动切片机3~4 μm厚切片,60 ℃烤片1 h,Ventana全自动免疫组化仪上机检测。BRAF V600E检测全自动免疫组化的设置流程:脱蜡76 ℃ 16 min;修复100 ℃ 64 min;一抗孵育37 ℃ 24 min;苏木精37 ℃ 8 min;返蓝37 ℃ 4 min。全自动染色结束后,将染色后的玻片放在加入洗涤剂的水中清洗,以去除玻片上的油膜,常规脱水、透明、封片,显微镜下观察。结果判读:BRAF V600E蛋白阳性细胞胞质呈棕黄色。
1.3.2qRT-PCR (1)DNA提取:经显微镜下观察,挑选肿瘤细胞占比>50%的组织蜡块,刮取6~8 μm厚组织4~5片至离心管中,二甲苯脱蜡后按照核酸提取试剂盒说明书提取基因组DNA,提取的DNA经紫外分光光度计测定其浓度和纯度,以确保OD260/OD280在1.8~2.0之间。检测步骤:严格依据试剂盒要求进行上样检测,DNA的上样量为10 ng,每次检测均设置阳性质控品和阴性对照,阳性质控品为BRAF V600E突变合成模板,阴性对照为纯水。PCR的过程设置为3个阶段:95 ℃ 5 min,1个循环;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,31个循环,在第三个阶段60 ℃时开始收集突变FAM信号和内控HEX信号。突变判读:首先观察样品的内控HEX信号应有明显的扩增曲线,且Ct值在13~21之间,以确定PCR扩增反应成功。如突变FAM信号无明显的扩增曲线或其Ct值≥28,则判读为BRAF V600E突变阴性;如突变FAM信号Ct值<28,则判读为BRAF V600E突变阳性。
1.3.3测序 将提取的DNA琼脂糖凝胶电泳割胶纯化后进行测序,测序用上游引物序列5′-CTT CATAATGCTTGCTCTG-3′,下游引物序列5′-GTA ACTCAGCAGCATCTCAG-3′。
2 结果
2.1 结直肠癌中BRAF V600E的表达免疫组化结果显示,113例结直肠癌中19例为BRAF V600E阳性,阳性细胞胞质呈不同程度的棕黄色着色(图1)。
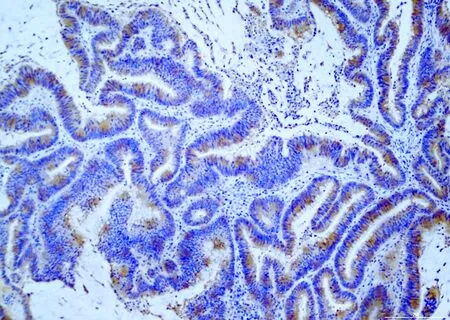
图1 BRAF V600E在结直肠癌中呈阳性,EnVision法
2.2 结直肠癌中BRAF V600E突变情况qRT-PCR检测结果显示,113例结直肠癌中BRAF V600E突变阳性7例,突变样本FAM信号Ct值均<28(图2)。
2.3 测序结果检测chr7:140753213-140753458共246 bp,双向测序结果经软件分析和人工审查确认突变情况(图3),突变阳性者7例。
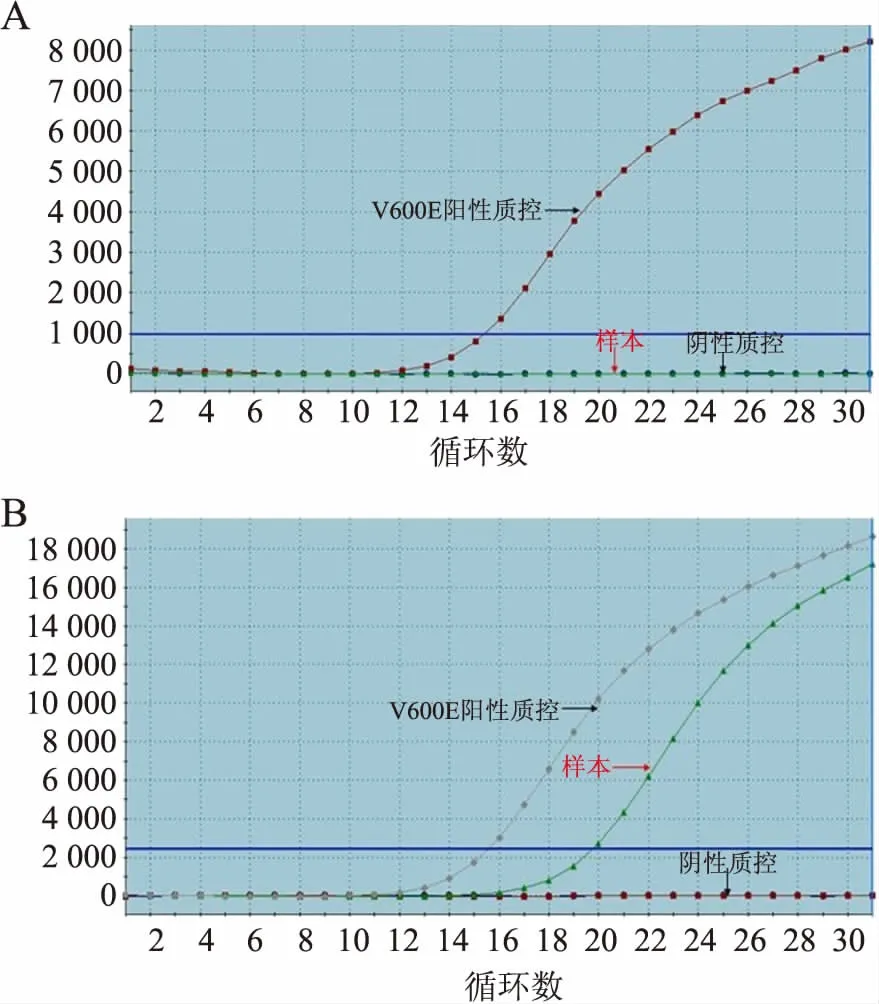
图2 qRT-PCR检测:A.BRAF V600E突变阴性扩增;B.BRAF V600E突变阳性扩增
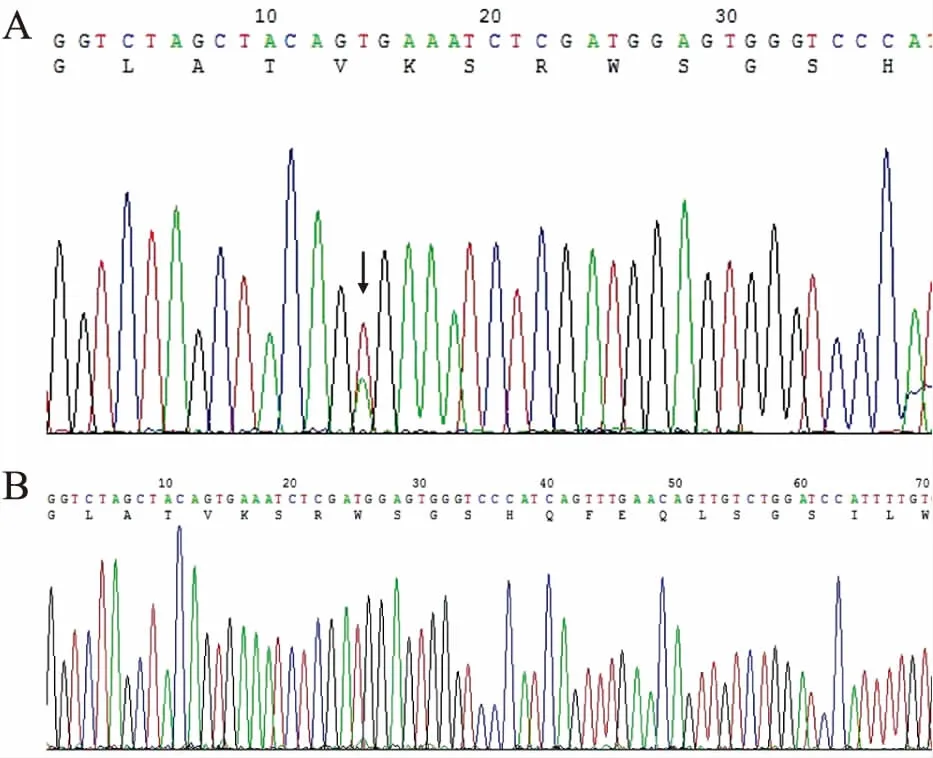
图3 结直肠癌BRAF V600E的测序结果:A.BRAF V600E突变阳性;B.BRAF V600E突变阴性
2.4 免疫组化和qRT-PCR结果113例结直肠癌标本同时应用免疫组化和qRT-PCR技术进行BRAF V600E检测,其中免疫组化检测BRAF V600E蛋白表达结果为不确定12例,阴性82例,阳性19例。不确定诊断例数占10.62%(12/113),其中1例经qRT-PCR检测为BRAF V600E突变,11例检测为未突变;免疫组化阴性检出率为72.57%(82/113),免疫组化阳性检出率为16.81%(19/113),其中有6例阳性病例经qRT-PCR检测为BRAF V600E突变,13例检测为未突变。在113例结直肠癌标本中,qRT-PCR检测BRAF V600E突变合计7例,未突变106例,无不确定例数。qRT-PCR阴性检出率为93.8%(106/113),阳性检出率为6.19%(7/113)(表1)。
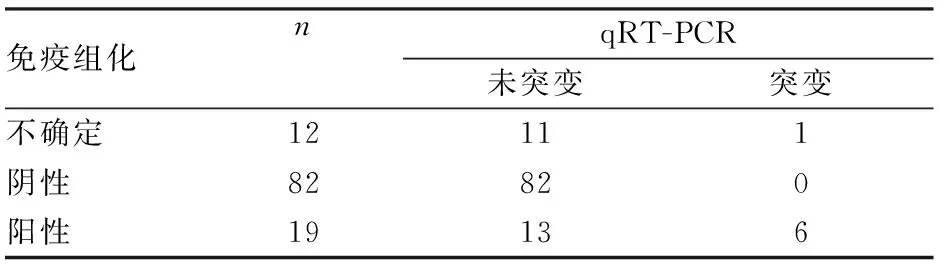
表1 免疫组化和qRT-PCR检测113例结直肠癌标本BRAF V600E结果
2.5 免疫组化和qRT-PCR检测结果比较以测序为金标准,对113例结直肠癌标本同时进行测序,免疫组化检测12例不确定诊断病例中,经测序检测BRAF V600E突变1例,未突变11例,测序结果与qRT-PCR结果一致;免疫组化检测82例阴性标本中,经测序检测结果均为未突变,与qRT-PCR结果一致;免疫组化检测19例阳性标本中,经测序检测13例为BRAF V600E未突变,6例为BRAF V600E突变,测序结果与qRT-PCR结果一致。qRT-PCR检测同测序检测结果的一致性为100%,免疫组化阴性结果同qRT-PCR、测序结果的一致性为100%,免疫组化阳性结果同qRT-PCR、测序结果的一致性为31.57%(6/19)(表2)。
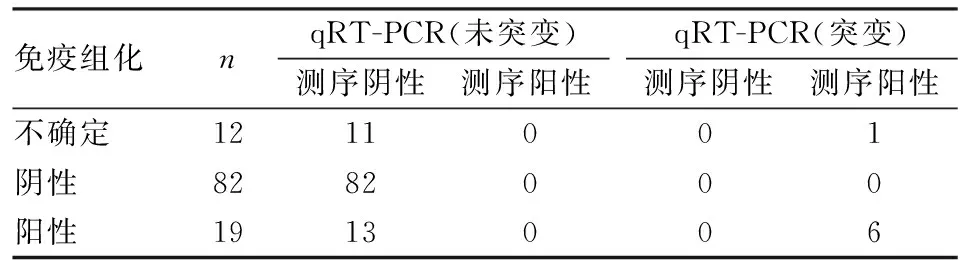
表2 免疫组化和qRT-PCR检测BRAF V600E结果比较
2.6 免疫组化、qRT-PCR检测BRAF V600E应用价值比较以测序为金标准,对113例结直肠癌标本的免疫组化BRAF V600E蛋白表达结果进行统计,免疫组化的灵敏度、特异度、阳性预测值、阴性预测值、假阴性率、假阳性率、准确率分别是100%、86.32%、31.58%、100%、0、13.68%、87.13%;qRT-PCR检测的灵敏度、特异度、阳性预测值、阴性预测值、假阴性率、假阳性率、准确率分别是100%、100%、100%、100%、0、0、100%(表3)。采用配对资料χ2检验比较免疫组化和qRT-PCR两种方法检测结直肠癌标本BRAF V600E突变阴阳性的差别,两者差异有显著性(χ2=22.17,P<0.000 01,表4)。

表3 以测序为金标准,免疫组化和qRT-PCR检测BRAF V600E应用价值比较
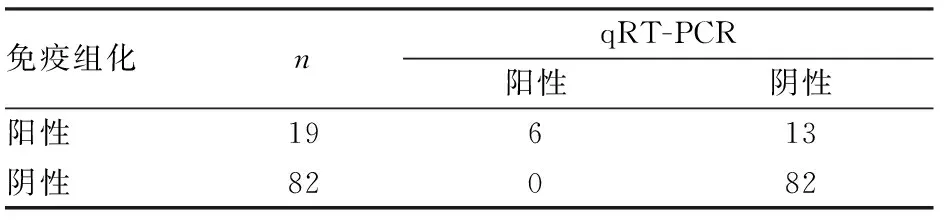
表4 免疫组化和qRT-PCR检测101例结直肠癌标本BRAF V600E突变阴阳性结果
3 讨论
BRAF V600E突变发生于第600号密码子,位于第1 799位的胸腺嘧啶突变为腺嘌呤(T突变为A),致使缬氨酸由谷氨酸替代(V600E),该突变通过激活MAPK信号通路,对肿瘤的发生、发展有重要影响[1]。有研究显示,BRAF V600E突变型结直肠癌患者可以从一线强化疗联合贝伐珠单抗中获益[2-3],应用BRAF抑制剂可提高BRAF V600E突变型结直肠癌患者对抗表皮生长因子受体(epithelial growth factor receptor, EGFR)单克隆抗体的敏感性[4]。有学者通过RNA干扰技术抑制BRAF基因,发现BRAF V600E突变型结直肠癌患者其癌细胞生长明显被抑制,肿瘤细胞的凋亡也增加[5],这从另一方面证明除外EGFR抑制剂,BRAF V600E突变型是分子靶向药物更好的治疗对象,突变型相对于野生型而言,可能对靶向药物治疗有更高的敏感性[5-7]。另外有文献报道BRAF V600E突变与微卫星不稳定(microsatellite instability, MSI)密切相关,因此,BRAF V600E突变型结直肠癌患者可从免疫抑制治疗中获益[8-9]。目前BRAF V600E的突变状态是鉴别Lynch综合征最有效的手段,BRAF V600E突变可排除Lynch综合征,提示为散发型结直肠癌,无BRAF V600E突变则提示Lynch综合征的可能[10-11]。有研究表明BRAF V600E突变与预后不良明显相关(P<0.001),提示BRAF V600E突变结直肠癌患者有更低的总体生存期[12-13]。了解BRAF V600E的突变状态,有利于对结直肠癌患者进行用药指导、鉴别诊断和预后管理。
本组中113例结直肠癌标本同时行免疫组化和qRT-PCR检测BRAF V600E突变,其中免疫组化阴性检出率为72.57%,明显低于qRT-PCR(93.8%)。免疫组化检测阳性率为16.81%,qRT-PCR检测阳性率为6.19%,这与以往报道结果较一致(5%~15%)[14-15]。本组免疫组化检测的19例阳性标本中,经测序证实,仅6例存在BRAF V600E突变,其余13例为假阳性;而qRT-PCR检测阳性病例,经测序证实均为BRAF V600E突变。与qRT-PCR检测相比,免疫组化检测存在较高的假阳性。另外,免疫组化应用于BRAF V600E检测在诊断中存在较高的不确定病例(10.62%),而应用qRT-PCR无不确定诊断病例。通过本实验结果对比分析,应用免疫组化和qRT-PCR这两种技术检测BRAF V600E,qRT-PCR较免疫组化在特异度、阳性预测值、准确率方面存在明显的优势,且qRT-PCR检测假阳性率也明显低于免疫组化。经过配对χ2检验,两种检测方法差异有显著性(P<0.000 01)。但由于本组病例数的局限,所取得的数据有待进一步完善,结果还待增加样本例数进一步证明。
qRT-PCR技术是一种在PCR反应体系中加入荧光基团,通过荧光信号的累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。每次产物扩增都有对应的荧光信号产生,两者形成线性关系,通过荧光信号的采集可直接对产物进行定量,因此,此方法准确性高,敏感度达1%[16-17]。另外,qRT-PCR是利用靶向引物和荧光探针进行双重控制,且全封闭单管扩增,无扩增后的处理操作,降低了扩增产物的污染,从而有效降低假阳性的发生。同时检测设立了阴性、阳性的内外对照,可有效避免假阴性、假阳性现象[18-19]。但qRT-PCR技术对操作人员技术要求较高,需要经过专门的PCR培训及拥有相关的分子生物学知识,实验条件也更严格,需要在标准的PCR实验室才能进行相关检测。目前利用qRT-PCR技术检测BRAF V600E突变在大医院实施较普遍,而基层医院因为条件限制,对BRAF V600E的检测多采用免疫组化技术。
免疫组化检测结直肠癌中BRAF V600E的表达,其敏感度、特异度、阴性预测值、假阴性率分别为100%、86.32%、100%、0,免疫组化的实验条件要求相对简单,省时,而且价格相对低廉,对样本的要求相比较不严格,操作也较容易,对于一般条件的医院如果做好质控,可以作为BRAF V600E突变状态的初筛。但由于肿瘤的异质性,在肿瘤内部及同一患者不同部位的肿瘤其蛋白表达存在差异,还存在非BRAF V600E蛋白的表达,BRAF基因其他部位的突变,抗体本身含有某些成分与人体发生的交叉反应,以及免疫组化操作过程中抗体浓度过高、过度修复、显色时间过长、漂洗不严格等因素,均可导致假阳性的发生。另外,有些标本免疫组化结果介于阴性和阳性之间,这可能与标本自身含有BRAF V600E蛋白水平较低,或抗体灵敏度低,以及免疫组化操作过程不规范有关,导致判读不能确定。因此,免疫组化由于自身技术的限制和操作原因,导致在结直肠癌BRAF V600E检测中假阳性和不确定病例较高。经本组实验比较发现,qRT-PCR技术发生假阳性现象明显低于免疫组化,且其特异性和准确率明显高于免疫组化,qRT-PCR技术检测结直肠癌BRAF V600E基因突变优于免疫组化。因此qRT-PCR技术是目前结直肠癌标本检测BRAF V600E突变的理想方法。
