原发性第四脑室印戒细胞型室管膜瘤1例并文献复习
2021-01-22李仔峰余英豪
李仔峰,王 婷,余英豪
室管膜瘤是一类起源于脑室和脊髓中央管内室管膜下区多能神经干细胞即放射状胶质细胞分化的少见肿瘤[1-2],除常见的3种室管膜瘤和RELA融合基因阳性独特分子亚型外[3],还包括多种特殊亚型。印戒细胞型室管膜瘤(signet-ring cell ependymoma, SRCE)是其一罕见特殊亚型,瘤细胞形态呈印戒样,极易与转移性胃肠道等部位的印戒细胞癌混淆。国内外病例报道甚少,迄今该肿瘤生物学行为及预后尚不明确。本文现报道1例SRCE,结合相关文献对其病理学特征、免疫表型及鉴别诊断等进行探讨,旨在提高对其的认识水平。
1 材料与方法
1.1 临床资料患者男性,34岁,2年前无明显诱因出现头晕,卧床时加重,半年后出现视物模糊,无头痛、恶心。查体:头颅大小正常,双侧视力粗试下降,视野无缺损,眼球无凹陷或突出,眼球各方向运动正常。双侧瞳孔等大等圆,对光反应灵敏。头颅CT+三维重建示:小脑蚓部及第四脑室占位,大小2.4 cm×2.3 cm×2.1 cm,周围小脑受压,可见斑片状低密度影,边界欠清,第三脑室及双侧脑室稍增宽(图1)。术中见:肿瘤主体位于小脑蚓部及其腹侧,呈灰白色,质软,向前突入第四脑室,与脑干粘连紧密。肿瘤周围血运丰富,与周围脑组织界限欠清。
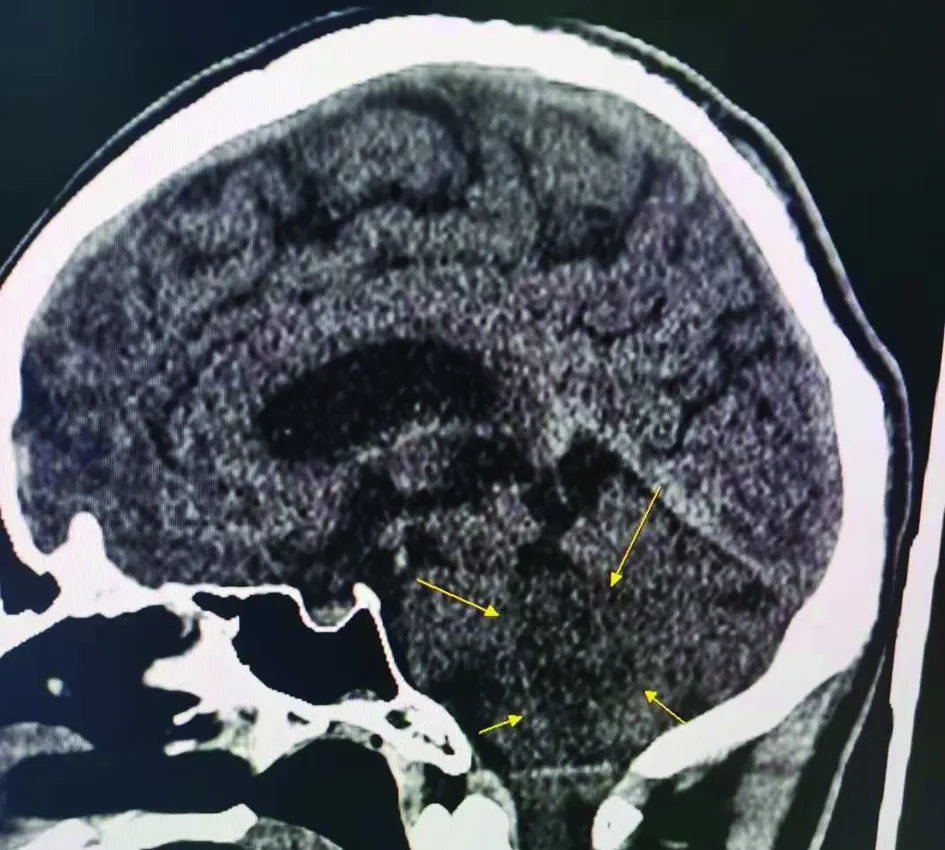
图1 轴位CT示第四脑室低密度影肿物(箭头),边界欠清
1.2 方法手术标本经10%中性福尔马林固定,常规脱水、石蜡包埋、切片,行HE、免疫组化染色和糖原染色(D-PAS、AB/PAS)。免疫组化染色采用EliVision两步法、DAB显色,所用一抗包括EMA、GFAP、S-100、PR、CK(AE1/AE3)、CK7、CK20、TTF-1、CDX-2、Villin、vimentin、Ki-67、Syn、Olig-2、NeuN均购自福州迈新公司。
2 结果
2.1 眼观灰白色碎组织数块,总体积3 cm×2 cm×1 cm,切面灰黄、质软。
2.2 镜检镜下肿瘤细胞密度中等,似上皮样形态,围绕血管疏密不均匀分布(图2),局部形成具有胶质纤维间质背景。瘤细胞形态较温和,主要由两类细胞组成:印戒样细胞和圆形或卵形细胞。印戒样细胞广泛分布,胞质圆而空亮,细胞核被挤向一侧呈新月状或印戒样,胞界不清。肿瘤内未见经典室管膜瘤的血管周假菊形团和室管膜菊形,但部分区域可见肿瘤细胞围绕胶质纤维血管为轴心呈放射状排列,似假菊形团外观,血管与肿瘤细胞间细胞稀疏或无细胞区(图3);散在区域可见肿瘤细胞呈柱状或立方状围绕中央圆形或狭长无细胞腔结构(图4)。肿瘤周边可见乳头状室管膜瘤结构。瘤细胞核分裂象不易见,未见肿瘤性坏死。
2.3 免疫表型瘤细胞S-100及vimentin弥漫弱至中等阳性(图5),CK(AE1/AE3)局部中等阳性,GFAP着重背景胶质纤维及部分瘤细胞呈放射状强阳性着色(图6),EMA散在多灶呈胞膜环状和胞质点状弱至中等阳性(图7),PR约50%核阳性,Ki-67增殖指数低(图8)。肿瘤细胞Olig-2、Syn、Neun、villin、CDX-2、TTF-1、CK7、CK20、CD45、CD20、HMB-45均阴性。D-PAS和AB/PAS特殊染色印戒样瘤细胞胞质内均未见黏液和糖原。
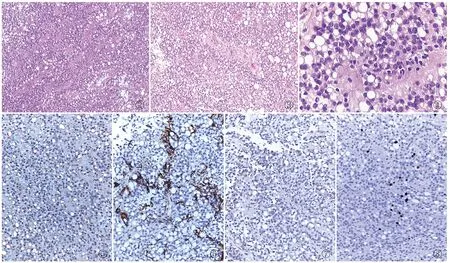
②③④⑤⑥⑦⑧
2.4 病理诊断SRCE(WHO Ⅱ级)。
2.5 随访患者术后随访31个月,未见肿瘤复发及转移。
3 讨论
3.1 临床特征室管膜瘤亚型种类多样,SRCE罕见。Gessi等[4]曾评估过往16年室管膜瘤中SRCE的发病率仅为0.23%。1994年Zuppan等[5]首次报道2例,分别发生于左侧脑室和第四脑室。检索文献已报道SRCE 9例[6-7],其中男性2例,女性7例,年龄12~64岁,中位年龄44岁,平均41岁。发生部位:第四脑室2例、脊髓3例、左侧脑室1例、左小脑半球1例、左侧额叶1例和延髓1例。临床症状以头痛头晕、恶心呕吐、视觉障碍等为主诉。所有病例术前均行MRI检查,增强扫描示肿瘤边界较清楚,呈中度至明显强化或环形强化影,表现为结节状或囊实性,常伴有脑室或脑干移位及脑积水。大体见肿瘤似有包膜,切开呈实性或囊实性,个别病例伴陈旧性出血[8]。
3.2 病理特征9例SRCE镜下组织形态多呈低级别神经上皮肿瘤形态,除Salazar等[6]报道的1例局部伴核分裂象增多、微血管增生等间变特征外,其余8例均为WHO Ⅱ级。SRCE呈中等细胞密度,所有病例均以瘤细胞胞质透亮伴核偏位呈印戒状为显著特征。部分病例[7]清晰可见室管膜瘤菊形团和血管周假菊形团结构,有力提示为室管膜瘤可能。其他特征包括肿瘤细胞形成狭长空腔似室管膜瘤裂隙及局灶钙化和纤维化[6]。免疫组化具有非常重要辅助诊断意义,GFAP除瘤细胞表达外,且肿瘤背景呈纤维丝样分布着色,尤以假菊形团结构处较突出。亦表达S-100和vimentin。EMA在常见室管膜瘤亚型和SRCE中表达模式一致,瘤细胞胞质环状和点状着色;但其在SRCE中阳性表达不一,有的甚至表达缺失[6]。此时透射电镜下观察瘤细胞超微结构具有确诊意义。通常印戒细胞指由于分泌产物、代谢物或细胞器过度增生等伴细胞核移位的气球状生长细胞。而电镜下观察SRCE瘤细胞内可见单空泡或多空泡,未发现与内质网或其他细胞器有关联,周边附着鞭毛小体,形成“拉链状”中间链接。胞质内形成大量微绒毛排列的腺样腔,腔内纤毛散乱,基底结构完整。从超微结构上证实印戒细胞形态的瘤细胞具有室管膜细胞特征[4,7-8]。
3.3 鉴别诊断SRCE的诊断需排除其他原发或转移性肿瘤,确诊需结合组织病理学特征、免疫表型和影像学特征,与其他具有印戒细胞形态的肿瘤进行鉴别。(1)转移性印戒细胞癌:消化道、乳腺等部位低黏附性癌的印戒细胞癌脑转移,其多个上皮性免疫组化标记和特定部位标志物多呈阳性,如加做Villin、CDX-2、CK20、CK7、GATA-3可鉴别。特殊染色D-PAS及AB/PAS印戒瘤细胞胞质内可见黏液或糖原,而S-100、vimentin和GFAP均阴性,EMA未呈胞膜环状阳性。本例SRCE中CK(AE1/AE3)呈中度阳性,易在上皮标志物选择不充分情况下误诊为转移性癌。Vege等[9]曾回顾性评估52例不同室管膜瘤亚型的免疫标志物表达情况,CK(AE1/AE3)阳性率可达98%,其他角蛋白标志物亦可不同比率阳性。因此只选用单一角蛋白上皮标记时易误诊。(2)透明细胞型室管膜瘤:瘤细胞胞核居中,因糖原聚集似少突胶质细胞瘤样伴核周空晕,胞质透亮,可见典型室管膜瘤结构。(3)印戒细胞型淋巴瘤:几乎均发生于B细胞淋巴瘤,指在滤泡性淋巴瘤或弥漫大B细胞淋巴瘤中有10%~15%瘤细胞呈印戒样。瘤细胞胞质内因免疫球蛋白聚积或异常质膜循环而成印戒样,免疫组化标记CD20、CD45弥漫阳性,GFAP、S-100、EMA阴性。(4)室管膜瘤伴脂肪/空泡化生:多见于颅后窝室管膜瘤,脂肪样或空泡状细胞形态,细胞核位于空泡边缘,病变常为灶性,罕见广泛病变[10]。新鲜肿瘤组织用脂溶性染料可加以证实该亚型。脂肪和(或)空泡化生具体机制不清,当病变广泛,形态与SRCE亦难以区分。(5)印戒细胞型黑色素瘤:颅内恶性黑色素瘤起源于软脑膜,组织学特征多为弥漫性或腺样分布,瘤细胞核受胞质内物质作用被挤压至一侧呈印戒样,核仁结构不清,瘤组织内可见黑色素颗粒沉积[11]。免疫组化标记S-100、HMB-45和Melan-A均阳性。(6)颅内脂肪瘤:一种颅内罕见中枢神经组织发育异常所致的良性肿瘤,好发于中线部位,以胼胝体区最多见[12]。肿瘤外观呈黄色、伴油腻感团块物,镜下由被纤维组织分隔的成熟脂肪细胞组成,不可见血管周围假菊形团结构,免疫组化标记GFAP和EMA均阴性。(7)伴印戒细胞样分化的胶质母细胞瘤:Figurelli等[13]和涂媛等[14]各报道1例中枢神经系统胶质母细胞瘤伴印戒细胞样分化,患者均为青年人,肿瘤光镜下主要由胶质分化的细胞组成,肿瘤细胞异型性显著、核深染,可见栅栏状坏死,部分区域肿瘤细胞呈印戒样和神经节样细胞分化。(8)中枢神经细胞瘤:由形态一致伴神经元分化的圆形细胞构成,其亦可形成无核区,但背景为神经纤维,可见神经毡分化,免疫组化标记Syn和NeuN阳性,而GFAP和EMA阴性。
3.4 治疗及预后目前为止SRCE的生物学行为和预后尚不明确,手术最大程度切除肿瘤为首选且最有效的治疗手段。根治性切除对于次全切除术和术后放疗后复发的SRCE治疗有效[15]。辅助放疗通常用于局部伴高级别室管膜瘤完全切除后或怀疑术后肿瘤残留,亦可采用以铂为基础的化疗[7]。文献报道9例和本例SRCE均以手术切除或2次术后未予以放、化疗,随访时间2~31个月,未见肿瘤复发和转移。
SRCE的诊断存在误诊风险,尤其是在小活检或冷冻病理切片时。缺乏室管膜瘤典型组织学特征时,这类罕见变异亚型通常难以诊断。建议对标本进行全面鉴别,并行免疫组化标记加以确认,以排除潜在的形似肿瘤。反之,当发生于年轻人脑室系统或脊髓肿瘤,边界尚清,镜下见广泛印戒细胞分布时亦勿忘记该特殊亚型室管膜瘤。
