口腔鳞状细胞癌中NFATc2的表达和定位
2021-01-22王元杰彭宏峰梁永强张瑾瑾
王元杰,彭宏峰,董 伟,梁永强,董 青,张瑾瑾,马 冬
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是口腔科最常见的恶性肿瘤,其发病年轻化、预后差、复发风险高,5年生存率仍较低[1-3],提示早期诊断十分重要。饮酒、嚼槟榔和吸烟是OSCC发生的主要因素[4]。本课题组前期研究发现[5],受体型蛋白酪氨酸磷酸酶(receptor protein tyrosine phosphatase-K, PTPRK)的表达受DNA甲基化的影响并与OSCC相关,但是其表达下调所影响的下游分子仍不清楚。OSCC的发生、发展与炎症相关[6-7],已有报道炎症可诱导活化T细胞核因子c2蛋白(nuclear factor of activated T cells c2, NFATc2)的表达和入核,进而通过调控炎症相关因子的转录(如IL-6和IL-11等)促进胃癌细胞的增殖、迁移和侵袭[8];在鼻型自然杀伤细胞/T细胞淋巴瘤中,PTPRK表达下调与NFATc2表达升高相关[9],以及NFATc2通过上调原癌基因ETS1的表达促进乳腺癌细胞的侵袭[10]。尽管目前在口腔癌的遗传多态性[11]和细胞水平上已有转录因子NFATc2方面的研究报道[12],但是NFATc2与PTPRK的关系及其临床意义的研究仍显不足。因此,本实验采用生物信息学预测、OSCC临床样本、人正常口腔上皮细胞系HIOEC和OSCC细胞系SCC25进行实验,探讨NFATc2在OSCC中的表达和作用,为OSCC的早期诊断和治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1一般资料 选取2013年1月~2015年6月华北理工大学附属医院口腔科收治的57例OSCC患者,均经病理诊断明确。其中男性34例,女性23例,年龄43~67岁,中位年龄(54.21±9.79)岁;TNM分期:Ⅰ+Ⅱ期19例、Ⅲ+Ⅳ期38例。另收集癌旁正常口腔黏膜组织标本41例作为对照组。两组标本在采集完成后迅速用生理盐水清洗血渍,并用4%多聚甲醛固定和石蜡组织包埋以及部分样本进行液氮冻存。
1.1.2细胞系 人正常口腔上皮细胞系HIOEC和人OSCC细胞系SCC25,购自中国科学院上海细胞库。采用含10%胎牛血清的DMEM培养基,并加链霉素(100 μg/mL)和青霉素(100 U/mL),5%CO237 ℃培养。
1.2 方法
1.2.1生物信息学预测 DNA采用在线GeneMANIA网站预测与PTPRK关联度高的基因(http://genemania.org/search/homo-sapiens/PTPRK/)。
1.2.2免疫组化 所有标本均经4%多聚甲醛固定,石蜡包埋,4 μm厚切片。免疫组化染色采用SP法,染色步骤严格按试剂说明书进行。随机选取5个癌巢内的视野,通过Image-Pro Plus 6.0软件(美国MEDIA CYBERNETIC图像技术公司)分析棕色颗粒在整个视野内所占百分比。
1.2.3细胞免疫荧光染色 培养人正常口腔上皮细胞系HIOEC和OSCC细胞系SCC25细胞爬片,4%多聚甲醛固定8 min,0.5%Triton PBS通透2 min,10%山羊血清封闭,应用鼠单克隆抗体NFATc2(1 ∶50,sc-7296,Santa Cruz公司)稀释液4 ℃孵育过夜,Fluorescein标记的抗兔二抗(anti-PTPRK,1 ∶100稀释,红色)室温孵育45 min,DAPI染核,细胞核呈蓝色。荧光显微镜下观察人正常口腔上皮细胞系HIOEC和OSCC细胞系SCC25中NFATc2表达的荧光强度和核定位情况,采用Image Pro-Plus 6.0软件定量分析NFATc2的表达水平。结果判定:NFATc2蛋白在OSCC中的表达水平高于配对对照组织中的表达定义为高表达;在OSCC组织中的表达低于配对对照组织的表达定义为低表达。
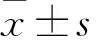
2 结果
2.1 OSCC组织中NFATc2的表达采用GeneMANIA网站在线预测与PTPRK基因表达在分子互作、共表达、共定位和分子通路等方面相关的基因结果显示,PTPRK与NFATc2基因关联度高,主要表现在分子通路关系(图1);采用免疫组化实验进一步证实了预测结果,在OSCC组织中NFATc2表达显著升高(P<0.01),且其表达主要定位于细胞核(图2)。

图1 GeneMANIA网站预测与PTPRK基因表达相关的基因:圆圈大小代表关联度大小,红色线代表相互作用,蓝色线代表分子通路

图2 口腔鳞状细胞癌和正常对照组织中NFATc2的表达:A. 免疫组化检测NFATc2的表达,SP法;B. 柱状图显示NFATc2的表达;与对照组相比,**P<0.01
2.2 OSCC组织中PTPRK与NFATc2表达的关系免疫组化检测OSCC组织中PTPRK的表达,其中PTPRK高表达21例,低表达36例;并将PTPRK高表达和低表达OSCC组织样本中的NFATc2阳性细胞数进行统计分析,在PTPRK高表达OSCC组织中NFATc2表达减少;相反,PTPRK低表达OSCC组织中NFATc2表达明显升高[(14.8±3.2)%vs(55.9±4.4)%,P<0.01,图3]。
图3 口腔鳞状细胞癌组织中PTPRK与NFATc2的表达:A. 免疫组化检测,SP法;B. 柱状图显示PTPRK与NFATc2的表达;与PTPRK高表达组相比,**P<0.01
2.3 NFATc2在人正常口腔上皮细胞系HIOEC和OSCC细胞系SCC25中的表达和定位采用免疫荧光染色证实NFATc2在人正常口腔上皮细胞系HIOEC和OSCC细胞系SCC25中的表达和定位,结果显示在HIOEC中,NFATc2表达较少且定位于细胞质中,而在SCC25中其表达升高1.89倍(P<0.001),且其表达核定位显著增加,提示在OSCC中NFATc2表达明显升高,且在细胞核中发挥生物学功能(图4)。
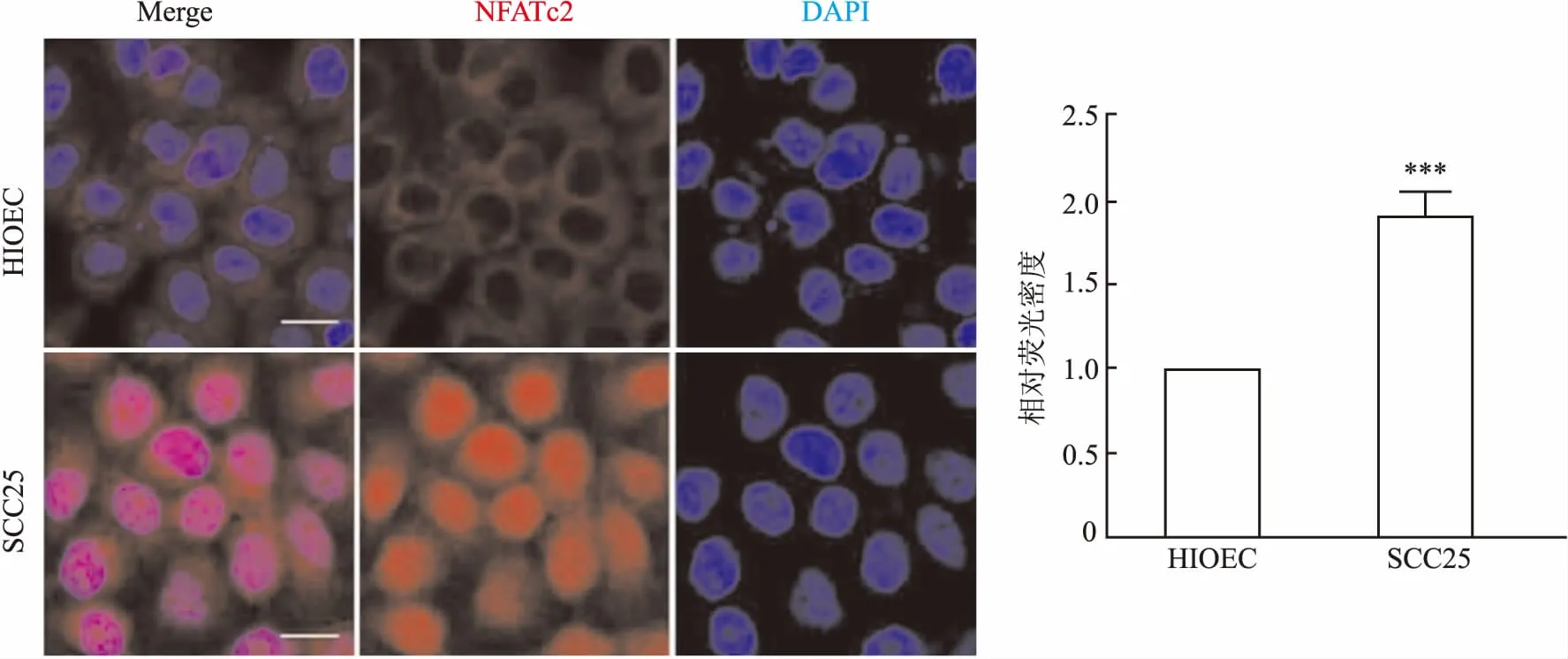
图4 人正常口腔上皮细胞系HIOEC和口腔鳞状细胞癌细胞系SCC25中NFATc2的细胞免疫荧光染色结果:A. 红色代表NFATc2染色结果,蓝色代表DAPI细胞核染色结果; B. 柱状图显示各细胞系中NFATc2的表达;与HIOEC相比,***P<0.001
2.4 NFATc2表达与OSCC临床病理特征的关系OSCC中NFATc2表达与患者性别、年龄和淋巴结转移无关(P均>0.05);而与TNM分期和分化程度有关(P均<0.05,表1)。

表1 口腔鳞状细胞癌中NFATc2表达与临床病理特征的关系
3 讨论
NFAT家族蛋白最初在活化的T细胞中作为IL2的转录激活蛋白而鉴定得到,包含一个高度保守的REL同源区域(REL-homology domain, RHD),与DNA结合来调控下游基因的转录,其不仅调控T细胞的发育和分化,而且还促进肿瘤细胞的生长、增殖、迁移、侵袭和新生血管形成[13-14]。目前已有报道NFATc2表达能够促进胃癌[8]、肺癌[15]、黑色素瘤[16]、食管癌[17]和肉瘤[18]的发生、发展。
本组前期实验发现[5],PTPRK基因启动子DNA高甲基化导致其表达减少在OSCC中具有重要临床意义。本实验通过生物信息学预测和OSCC临床样本及细胞系实验验证发现,PTPRK与NFATc2表达在分子通路上具有相反的关系,此结果与在胃癌和淋巴瘤中的研究结果一致。STAT3信号异常激活与OSCC的发生、发展密切相关[19]。Qi等[8]在表观遗传学变化促进胃癌进展的机制研究中发现,STAT3信号通过组蛋白H3的丝氨酸磷酸化异常激活丝裂原和应激激活蛋白1(mitogen-and stress-activated protein kinase 1, MSK1)表达,共同形成正反馈环复合物并结合于NFATc2启动子上激活其转录表达,进而NFATc2蛋白表达入核并转录上调炎症相关因子,即STAT3/MSK1/NFATc2信号轴在促进炎症和胃癌的发生、发展中发挥重要作用。与此同时,Chen等[9]在鼻型自然杀伤细胞/T细胞淋巴瘤的研究中发现,PTPRK的DNA甲基化抑制其表达,解除了对STAT3的去磷酸化修饰和信号激活的抑制。因此推测,DNA甲基化介导的PTPRK-STAT3-NFATc2信号轴在OSCC发展进程中具有重要作用,有望成为治疗靶点。
通常状态下,NFATc2以高度磷酸化修饰存在于胞质中,当细胞受到异常刺激作用时,NFATc2作为钙调磷酸酶的底物去磷酸化,随后入核发挥其转录调控炎症相关因子的作用[20]。尽管本实验并没有检测其磷酸化修饰状态,但是其磷酸化修饰后的入核现象在OSCC组织和SCC25细胞系中均已被证实,表明其主要在细胞核中发挥炎症调节的功能并促进肿瘤的发生。另外,该研究结果提示,NFATc2去磷酸化修饰的钙调磷酸酶抑制剂的应用,如他克莫司(tacrolimus, FK506)或环孢素A(cyclosporine A)是否在OSCC中具有抑制肿瘤的治疗作用将是本课题组今后的研究方向。最后,本实验从临床角度证实了PTPRK下游NFATc2的表达上调和入核增加与OSCC病理分期和分化程度相关,提示该基因在OSCC的诊断和治疗方面具有重要意义,其相关分子机制研究是课题组下一步的工作重点。
