赤芍总苷对脊髓损伤大鼠脊髓细胞凋亡的影响及机制
2021-01-22岳宗进刘汝银于露王新立冯仲锴王西彬李云朋许大勇
岳宗进,刘汝银,于露,王新立,冯仲锴,王西彬,李云朋,许大勇
河南省中医院脊柱科,郑州 450000
脊髓损伤(spinal cord injury,SCI)是指由高处坠落、车祸、手术等因素直接或间接引起的脊髓结构和功能受损的临床病症[1],可引起多种失调反应,并可能导致永久性的神经功能缺陷,给患者生活造成显著影响[2]。SCI后的病理进程受多种因素影响,包括炎症反应、钙离子超载、微循环改变、细胞凋亡等,其中细胞凋亡是影响SCI进程的重要因素[3]。赤芍是毛茛科植物芍药的干燥根,主要活性成分为芍药内酯苷、羟基芍药苷、芍药苷和苯甲酰芍药苷等,总称为赤芍总苷(total paeony glycoside,TPG)[4]。研究表明,赤芍可应用于动脉粥样硬化、肿瘤、SCI等疾病的治疗,具有抗肿瘤、抗炎以及调控细胞凋亡等作用[5-6]。目前关于赤芍在SCI中的治疗作用报道较少,本研究通过建立SCI大鼠模型,探讨TPG对SCI大鼠脊髓细胞凋亡的影响及其机制,以期为赤芍用于SCI的临床治疗提供理论 依据。
1 材料与方法
1.1 实验分组及SCI大鼠模型制备 健康SD大鼠18只,雌雄不限,体重220~300 g,由河南省中医院实验动物中心提供。标准饲料,分笼室温饲养。随机分为对照组、SCI组与TPG组,每组6只。采用Allen法制备SCI大鼠模型:大鼠用1.5%戊巴比妥钠腹腔注射麻醉(45 mg/kg),以背部T9为中心,纵向切开棘突并切除T9椎板,将脊髓暴露。在脊髓上放置0.3 cm×0.4 cm垫片,用10 g冲击棒从5 cm高处自由坠落损伤脊髓,随后缝合伤口。对照组大鼠切除椎板后,不予以脊髓打击直接缝合。术后每日注射青霉素和生理盐水进行抗菌以及体液补充。TPG组在SCI模型建立成功后每24 h腹腔注射25 mg/kg TPG,SCI组和对照组腹腔注射同体积的生理盐水,共28 d。动物过程符合国家和单位有关实验动物的管理和使用规定。
1.2 大鼠行为学评分 分别于伤后1、7、14、21、28 d,采用Basso-Beattie-Bresnahan (BBB)评分法对大鼠进行行为学评分。
1.3 流式细胞术检测脊髓细胞凋亡情况 各组大鼠处理28 d后,麻醉开胸,暴露脊髓损伤点,以损伤点为中心切取脊髓2 cm。将脊髓加入预冷的蒸馏水制成组织匀浆,加入胰酶消化并收集脊髓细胞;加入1 ml 1×Annexin V结合缓冲液,800 r/min离心5 min,弃上清,用200 μl结合缓冲液重悬细胞;加入10 μl Annexin V-FITC(5 mg/L)和5 μl PI,混匀后置于37 ℃避光环境中孵育30 min。采用流式细胞仪检测脊髓细胞凋亡情况(激发波长488 nm,发射波长530 nm)。
1.4 Western blotting检测脊髓细胞凋亡蛋白cleaved caspase-3和cleaved caspase-9的表达 取大鼠脊髓细胞,用PBS缓冲液洗涤3次。加入RIPA细胞蛋白裂解液后,用SDS-PAGE电泳分离蛋白,转膜,5%脱脂牛奶室温下封闭1 h。加入兔抗鼠cleaved caspase-3、cleaved caspase-3抗体(美国Cell Signaling Technology公司,1:1000)4 ℃孵育过夜,PBS缓冲液洗涤,加入羊抗兔二抗(美国Cell Signaling Technology公司,1:1000)室温孵育1 h,ECL曝光显影,用ImageJ软件分析各条带光密度值。
1.5 脊髓组织中丙二醛(maleic dialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、乳酸脱氢酶(lactic dehydrogenase,LDH)含量测定 取大鼠脊髓组织匀浆,3500 r/min离心20 min,取上清,按照MDA、SOD和LDH检测试剂盒(南京建成生物工程研究所)说明书步骤测定MDA、SOD和LDH的含量。取上清,加入20%三氯乙酸(TCA)孵育20 min,加入0.67%硫代巴比妥酸(TBA)和0.1 mol/L盐酸(HCl),95 ℃水浴孵育1 h,采用酶标仪检测532 nm波长处的吸光度(OD)值,计算MDA含量。取上清,加入酶工作液及水溶性四氮唑盐(WST)工作液,37 ℃环境下反应20 min,采用酶标仪检测540 nm波长处的OD值,计算SOD含量。取上清,按照LDH检测试剂盒说明书步骤检测LDH含量。
1.6 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料以±s表示,实验数据采用单因素方差分析,进一步两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TPG对SCI大鼠BBB运动功能评分的影响 对照组大鼠无明显功能缺失症状,BBB评分稳定。SCI组和TPG组大鼠BBB评分随时间延长呈增高趋势,且TPG组大鼠BBB评分高于SCI组,差异有统计学意义(P<0.05,表1)。
2.2 TPG对SCI大鼠脊髓细胞凋亡的影响 流式细胞仪检测结果显示,SCI组脊髓细胞凋亡率明显高于对照组[(26.1%±3.2%) vs. (18.8%±1.6%),P<0.05],TPG组脊髓细胞凋亡率(21.3%±2.3%)明显低于SCI组(P<0.05,图1)。
2.3 TPG对SCI大鼠脊髓细胞凋亡蛋白表达的影响 Western blotting检测结果显示,与对照组比较,SCI组大鼠脊髓细胞凋亡蛋白cleaved caspase-3和cleaved caspase-9的表达水平明显增高(P<0.05)。与SCI组比较,TPG组大鼠脊髓细胞凋亡蛋白cleaved caspase-3和cleaved caspase-9的表达水平明显降低(P<0.05,图2)。
表1 脊髓伤后不同时间各组大鼠BBB评分比较(±s,n=6)Tab.1 Comparison of BBB scores in each group of rats after spinal cord injury (±s, n=6)
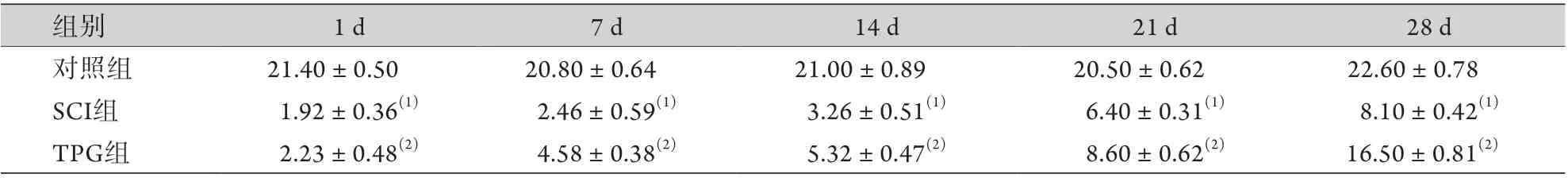
表1 脊髓伤后不同时间各组大鼠BBB评分比较(±s,n=6)Tab.1 Comparison of BBB scores in each group of rats after spinal cord injury (±s, n=6)
与对照组比较,(1)P<0.05;与SCI组比较,(2)P<0.05。
组别 1 d 7 d 14 d 21 d 28 d对照组 21.40±0.50 20.80±0.64 21.00±0.89 20.50±0.62 22.60±0.78 SCI组 1.92±0.36(1) 2.46±0.59(1) 3.26±0.51(1) 6.40±0.31(1) 8.10±0.42(1)TPG组 2.23±0.48(2) 4.58±0.38(2) 5.32±0.47(2) 8.60±0.62(2) 16.50±0.81(2)
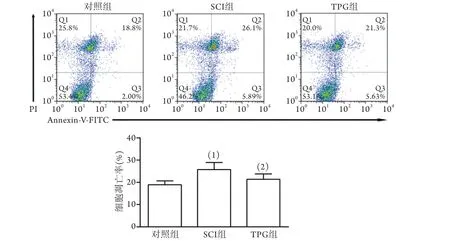
图1 各组大鼠脊髓细胞凋亡率比较Fig.1 Comparison of apoptosis rate of spinal cord cells in each group of rats with spinal cord injury
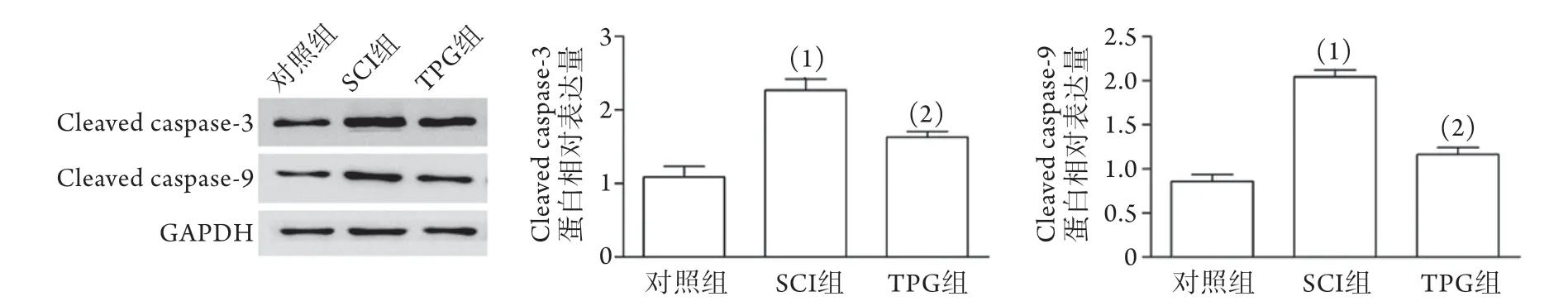
图2 各组大鼠脊髓细胞凋亡蛋白的表达水平比较Fig.2 Comparison of the expression level of apoptotic proteins of spinal cord cells in each group of rats with spinal cord injury
2.4 TPG对SCI大鼠脊髓组织中MDA、SOD和LDH含量的影响 与对照组比较,SCI组大鼠脊髓组织中MDA、LDH含量明显升高,SOD含量明显降低(P<0.05)。与SCI组比较,用TPG处理的SCI大鼠脊髓组织中MDA、LDH含量明显降低,SOD含量明显升高,差异均有统计学意义(P<0.05,表2)。
3 讨 论
SCI临床较为常见,且近年来发病率逐渐升高,致残率居高不下[7]。目前脊椎损伤的治疗方法多样,包括手术、针灸、细胞移植及中药等,但是治疗效果并不理想,且可能引起不同程度的并发症[8]。 因此,采用新型药物或方法治疗SCI已成为脊柱外科的研究热点之一。
表2 各组大鼠脊髓组织中MDA、SOD、LDH含量比较(±s,n=6)Tab.2 Comparison of MDA, SOD and LDH content in each group of rats with spinal cord injury (±s, n=6)
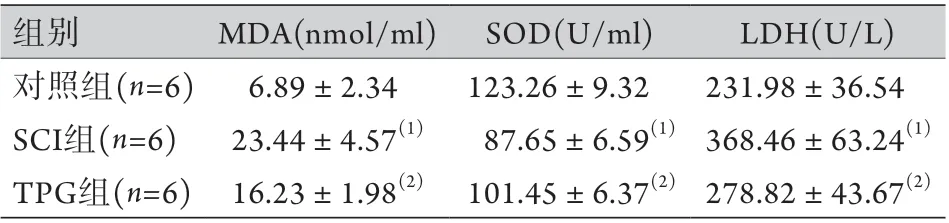
表2 各组大鼠脊髓组织中MDA、SOD、LDH含量比较(±s,n=6)Tab.2 Comparison of MDA, SOD and LDH content in each group of rats with spinal cord injury (±s, n=6)
与对照组比较,(1)P<0.05;与SCI组比较,(2)P<0.05。
组别 MDA(nmol/ml) SOD(U/ml) LDH(U/L)对照组(n=6) 6.89±2.34 123.26±9.32 231.98±36.54 SCI组(n=6) 23.44±4.57(1) 87.65±6.59(1) 368.46±63.24(1)TPG组(n=6) 16.23±1.98(2) 101.45±6.37(2) 278.82±43.67(2)
赤芍是一种传统中药,临床使用方便,不良反应少,具有多种药理作用,如抗凝、抗血栓、抗内毒素、抗氧化等[9]。对于赤芍药理作用机制的研究主要集中于TPG。已有研究表明,赤芍可用于SCI的中药治疗[5]。本研究采用Allen法构建SCI大鼠模型,腹腔注射TPG观察其对损伤大鼠的治疗效果及影响机制,结果显示,SCI组BBB评分明显降低,与卜志勇等[10]研究中SCI大鼠的表现相同,表明SCI动物模型构建成功。本研究发现,与SCI模型大鼠相比,TPG组大鼠BBB评分在1个月的治疗过程中均明显增高,表明TPG对SCI确有明显的治疗作用。
SCI的发展过程包括原发性损伤和继发性损伤。前者是被动地发生在短时间内的不可逆损伤,后者是在脊髓受损一段时间之后继续发展的损伤,具有可逆性和可控性[11]。脊髓细胞凋亡在原发性损伤和继发性损伤的发生中均发挥作用。在脊髓损伤中心区域,大多数细胞会表现凋亡现象,其凋亡过程与caspase-3途径的激活有关[12]。Cleaved caspase-3是caspase-3的活化形式,能够更准确地反映细胞的凋亡程度[13]。本研究发现,TPG对SCI大鼠脊髓细胞凋亡有明显的抑制作用,同时明显抑制了SCI大鼠凋亡蛋白cleaved caspase-3和cleaved caspase-9的表达,表明TPG对SCI所致脊髓细胞凋亡具有保护作用。
过度的氧化应激能够诱导细胞凋亡,在SCI的发生和发展过程中起着关键作用[14]。本研究选择MDA、SOD及LDH作为氧化应激的代表性指标,其中SOD是细胞内主要的自由基清除剂和抗氧化酶,其含量高低能够反映细胞对氧自由基损伤抵抗能力的强弱[15];MDA和LDH含量的高低是细胞氧化损伤的重要标志[16]。本研究发现,SCI大鼠脊髓组织中MDA和LDH含量升高,SOD含量降低,而在TPG腹腔注射后SCI大鼠以上指标均有改善,表明TPG可以减轻SCI大鼠中过度的氧化应激反应。
综上所述,TPG腹腔注射对SCI大鼠具有保护作用,其机制可能是减轻损伤大鼠的氧化应激反应,从而抑制脊髓细胞凋亡,提示TPG可成为治疗SCI的有效药物,但临床上单方或者作为辅助药剂对赤芍的使用仍需进一步研究,以更加安全有效地对SCI进行治疗。
