胎盘间充质干细胞对重症急性胰腺炎大鼠肺损伤的保护 作用及机制
2021-01-22李帅黄启林王冰原小惠孙红玉汤礼军
李帅,黄启林,王冰,原小惠,孙红玉,3*,汤礼军*
1西南交通大学医学院,成都 610031;2西部战区总医院全军普外科中心/四川省胰腺损伤与修复重点实验室,成都 610083;3西部战区总医院基础医学实验室,成都 610083
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种由胰腺局部病变诱发机体瀑布式炎症级联反应的炎症性疾病,发病急、病情重、病死率高[1]。 急性肺损伤(acute lung injury,ALI)是SAP最为常见的并发症,也是导致SAP高病死率的主要原因之一[2]。 SAP时,机体免疫失衡所致的级联炎症反应是引发ALI的重要原因,其中肺巨噬细胞极化失衡在ALI发生、发展中发挥着重要作用[3],然而现有的治疗策略不能有效纠正机体免疫失衡。因此,寻找可重塑机体免疫平衡的治疗策略对减轻SAP相关性肺损伤具有重要意义。间充质干细胞(mesenchymal stem cells,MSCs)具有较强的抗炎与免疫调节能力,被广泛应用于炎症性疾病的治疗与研究。近年来,通过MSCs调控炎症微环境中巨噬细胞极化状态以减轻组织炎性损伤已成为研究热点。有研究发现,骨髓与脐带来源的MSCs可有效减轻急性胰腺炎大鼠的胰腺损伤和全身炎症反应[4-7], 但目前关于胎盘间充质干细胞(placental-derived mesenchymal stem cells,P-MSCs)与SAP大鼠肺损伤的研究鲜少报道。本研究旨在探讨外源性P-MSCs移植对SAP大鼠肺损伤的保护作用及机制。
1 材料与方法
1.1 主要试剂及仪器 MSCs无血清培养基购自友康恒业生物科技(北京)有限公司;牛磺胆酸钠购自美国Sigma公司;白介素(interleukin,IL)-1β、IL-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、淀粉酶、脂肪酶检测试剂盒购自上海江莱生物科技有限公司;髓过氧化物酶(MPO)检测试剂盒购自南京建成生物工程研究所;One-step SYBR PrimerScript RT-PCR Kit Ⅱ购自日本TaKaRa公司;小鼠抗大鼠抗体CD68购自美国Proteintech公司;兔抗大鼠抗体CD163和iNOS购自武汉赛维尔生物科技有限公司。动物麻醉机及异氟烷购自深圳市瑞沃德生命科技有限公司。
1.2 方法
1.2.1 P-MSCs的分离培养 P-MSCs由本课题组前期研究分离培养所得[8],选取第3~5代细胞用于本研究。
1.2.2 动物分组及SAP大鼠模型制备 SPF级健康成年雄性SD大鼠36只,购自成都达硕实验动物有限公司,体重200~240 g,采用随机数字表法分为对照组、SAP组与P-MSCs组,每组12只,给予12 h昼夜交替光照。采用4%牛磺胆酸钠胆胰管逆行注射法构建SAP大鼠模型。大鼠术前12 h禁水,术后禁食,自由饮水。对照组大鼠经异氟烷麻醉后,开腹翻动胰腺数次然后关闭腹腔,术后6 h经尾静脉注射1 ml PBS溶液。SAP组大鼠麻醉后开腹,采用微量注射泵经胆胰管注入4%牛磺胆酸钠(0.1 ml/100 g),术后6 h经尾静脉注射1 ml PBS溶液制备SAP大鼠模型。P-MSCs组大鼠造模结束后6 h,经尾静脉注射P-MSCs(1×106个/100 g,2×106个/ml)。所有大鼠在P-MSCs输注后12 h和24 h处死,收集血清、胰腺组织及肺组织备用。实验过程符合国家和单位有关实验动物管理和使用的规定。
1.2.3 肺湿干重比测定 取部分右肺组织,用滤纸将表面水分沾干后称量湿重,然后置于60 ℃恒温烤箱中烘烤72 h,称量干重,计算肺湿干重比。
1.2.4 支气管肺泡灌洗液标本处理及检测 取出左肺后,将灌洗针插入气管,用生理盐水反复灌洗,收集支气管肺泡灌洗液,离心,用200 μl PBS重悬。取10 μl细胞悬液滴在盖玻片上,行Wright-Giemsa染色。显微镜下随机选择8个100倍视野计数200个细胞,计数中性粒细胞、白细胞和巨噬细胞。
1.2.5 胰腺组织与肺组织病理学观察及病理评分 取胰腺组织与肺组织,用4%多聚甲醛固定24 h,脱水、石蜡包埋、切片,行HE染色,显微镜下观察胰腺组织及肺组织的病理学变化。依据Schmidt等[9]报道的标准,对胰腺水肿、腺泡细胞坏死、出血、炎性细胞浸润等进行评分,计算10个独立视野,取平均分作为每张胰腺切片的最终评分。参照Shen等[10]报道的肺组织损伤病理评分标准,对肺脏水肿、肺泡细胞破坏、肺泡间隙增宽、炎性细胞浸润进行评分,计算10个独立视野,取平均分作为每张肺脏切片的最终评分。
1.2.6 ELISA法检测血清炎性因子、淀粉酶、脂肪酶浓度 采用ELISA法检测血清炎性因子(IL-1β、IL-6、TNF-α、IL-10)、淀粉酶、脂肪酶浓度,每个样本独立重复3次,操作按照试剂盒说明书步骤进行,采用全自动酶标仪测定450 nm处的吸光度(OD)值。
1.2.7 胰腺组织及肺组织中M P O 活性测定 取-80 ℃冻存的肺组织及胰腺组织,超声波匀浆,离心收集上清,按照试剂盒说明书步骤操作,测定胰腺组织及肺组织中MPO的活性。
1.2.8 RT-qPCR检测肺组织中IL-1β、TNF-α mRNA的表达水平 称取相同重量的肺组织,用Trizol提取总RNA,反转录为cDNA,采用RT-qPCR检测肺组织中IL-1β、TNF-α mRNA的表达水平。IL-1β、TNF-α、GAPDH引物由上海生工生物工程有限公司设计并合成,引物序列如表1所示。

表1 RT-qPCR引物序列Tab.1 Primer sequences for RT-qPCR
1.2.9 免疫荧光染色观察肺巨噬细胞极化表型的变化 肺组织石蜡切片脱蜡、抗原修复、封闭、一抗[小鼠抗大鼠抗体CD68(1:500)、兔抗大鼠抗体iNOS与CD163(1:1000)]孵育、二抗[山羊抗兔与山羊抗小鼠(1:500)]孵育、DAPI复染核,显微镜下观察M1型巨噬细胞(CD68+iNOS+)与M2型巨噬细胞(CD68+CD163+)浸润情况。
1.3 统计学处理 采用SPSS 18.0软件进行统计分析。符合正态分布的计量资料以±s表示,方差齐时,多组间比较采用两因素方差分析,进一步两两比较采用LSD-t检验;方差不齐时,多组间比较采用非参数检验(Kruskal-Wallis检验),进一步两两比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 P-MSCs可有效减轻SAP大鼠胰腺病理损伤 HE染色结果显示,对照组胰腺组织形态未见明显异常;SAP组可见胰腺间质水肿,腺泡细胞坏死,大量炎性细胞浸润与红细胞渗出;与SAP组比较,P-MSCs组胰腺损伤明显减轻,仅部分胰腺水肿,腺泡细胞少量坏死,炎性细胞浸润与红细胞渗出减少(图1A)。
胰腺组织病理评分结果显示,与对照组比较,SAP组胰腺水肿、腺泡细胞坏死、出血及炎性细胞浸润评分明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组胰腺水肿、腺泡细胞坏死、出血及炎性细胞浸润评分明显降低,差异有统计学意义(P<0.001,图1B-E)。
ELISA检测结果显示,与对照组比较,SAP组血清淀粉酶与脂肪酶浓度明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组血清淀粉酶与脂肪酶浓度明显降低,差异有统计学意义(P<0.001,图1F、G)。MPO活性测定结果显示,与对照组比较,SAP组胰腺组织中MPO活性明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组胰腺组织中MPO活性明显降低,差异有统计学意义(P<0.001,图1H)。
2.2 P-MSCs可有效减轻SAP大鼠肺组织病理损伤 HE染色结果显示,对照组大鼠肺组织结构清晰,无明显形态学变化;SAP组大鼠肺组织可见明显的形态学异常,如大量炎性细胞浸润、肺泡间隔明显增宽、严重的间质水肿等;而P-MSCs组大鼠肺组织损伤严重程度较SAP组明显减轻,仅见少量炎性细胞浸润,间质水肿与肺泡间隔增宽均显著改善(图2A)。
肺组织病理评分结果显示,与对照组比较,SAP组肺组织病理评分明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组肺组织病理评分明显降低,差异有统计学意义(P<0.001, 图2B)。

图1 重症急性胰腺炎大鼠胰腺病理损伤严重程度评估Fig.1 Severity assessment of pancreatic pathological injury of rats with severe acute pancreatitis
2.3 P-MSCs可有效减轻SAP大鼠肺组织局部炎症反应 肺湿干重比测定结果显示,与对照组比较,SAP组大鼠肺湿干重比明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组大鼠肺湿干重比明显下降,差异有统计学意义(P<0.001, 图3A)。MPO活性测定结果显示,与对照组比较,SAP组大鼠肺组织MPO活性明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组大鼠肺组织MPO活性明显降低,差异有统计学意义(P<0.001,图3B)。肺泡灌洗液中有核细胞计数结果显示,与对照组比较,SAP组中性粒细胞、白细胞与巨噬细胞数均明显增多,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组中性粒细胞、白细胞与巨噬细胞数均明显减少,差异有统计学意义(P<0.001,图3C、D、E)。RT-qPCR检测结果显示,与对照组比较,SAP组肺组织中TNF-α、 IL-1β mRNA的表达水平明显升高,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组肺组织中TNF-α、IL-1β mRNA的表达水平明显降低,差异有统计学意义(P<0.001,图3F、G)。
2.4 P-MSCs可有效减轻SAP大鼠全身炎症反应 ELISA检测结果显示,与对照组比较,SAP组大鼠血清中促炎因子IL-1β、IL-6与TNF-α水平明显升高,抗炎因子IL-10水平明显降低,差异有统计学意义(P<0.001);与SAP组比较,P-MSCs组大鼠血清中促炎因子IL-1β、IL-6与TNF-α水平明显降低,抗炎因子IL-10水平明显升高,差异有统计学意义(P<0.001,图4)。
2.5 P-MSCs可调控肺巨噬细胞M1型向M2型极化 免疫荧光染色结果显示,与对照组比较,SAP组肺组织中大量巨噬细胞浸润,且高表达iNOS,低表达CD163(P<0.001,图5),表明在SAP发生过程中,肺巨噬细胞发生了明显的M1极化。与SAP组比较,P-MSCs组肺组织中iNOS表达明显降低,CD163表达明显升高(P<0.001,图5),表明P-MSCs在SAP大鼠的治疗中可有效诱导肺巨噬细胞向M2型极化。
3 讨 论
近年来大量研究表明,MSCs可通过免疫调节作用来减轻组织炎性损伤,加速组织修复,进而发挥治疗作用[11-13]。然而,目前关于MSCs与SAP相关性肺损伤的报道较少,且主要集中于骨髓源性MSCs(bone marrow-derived MSCs,BM-MSCs)对SAP相关肺损伤的治疗作用,而关于P-MSCs与SAP相关肺损伤的研究鲜见报道[14-15]。相较于BM-MSCs,P-MSCs的分离过程具有较高的细胞获得率和较低的病毒污染率。此外,P-MSCs具有更强的增殖能力和免疫调节能力[16-17]。因此,本研究探讨P-MSCs在SAP大鼠肺损伤治疗中的有效性。
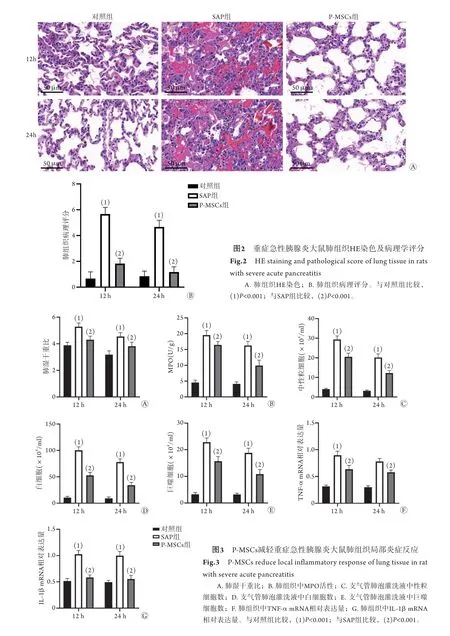
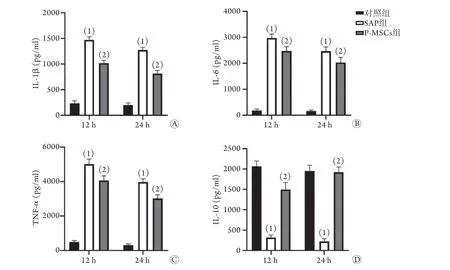
图4 各组重症急性胰腺炎大鼠血清炎性因子水平比较Fig.4 Comparison of levels of serum inflammatory factors in each group of rats with severe acute pancreatitis

图5 各组重症急性胰腺炎大鼠肺组织中巨噬细胞极化表型比较Fig.5 Comparison of polarization phenotype of macrophages in lung tissues of rats with severe acute pancreatitis
本研究结果显示,相比SAP组,P-MSCs组胰腺水肿、出血、腺泡细胞坏死、炎性细胞浸润明显减轻,血清淀粉酶与脂肪酶浓度明显降低,肺水肿、肺泡细胞破坏、炎性细胞浸润明显减轻,肺湿干重比明显降低,支气管肺泡灌洗液中中性粒细胞、白细胞与巨噬细胞数明显减少,肺组织中TNF-α、 IL-1β mRNA的表达水平明显降低,表明P-MSCs可有效减轻胰腺组织与肺组织的病理损伤及炎症反应,有利于组织修复。
MPO为中性粒细胞特有的还原酶,主要存在于细胞的嗜天青颗粒中,其活性可反映组织中性粒细胞浸润情况。本研究结果显示,相比SAP组,P-MSCs组肺组织中MPO活性明显降低,表明P-MSCs可减轻SAP大鼠肺组织中性粒细胞浸润,有利于促进炎症消退。
除肺损伤外,SAP还伴有严重的全身炎症反应。若评估P-MSCs对大鼠SAP相关性肺损伤的治疗效果,必须同时评估其对全身炎症反应的影响。全身炎症反应的严重程度常通过测定血清中促炎因子与抗炎因子水平来间接反映。本研究结果显示,相比SAP组,P-MSCs组大鼠血清中促炎因子IL-1β、IL-6、TNF-α水平明显降低,抗炎因子IL-10水平明显升高,表明P-MSCs可有效减轻SAP大鼠的全身炎症反应。
巨噬细胞具有较强的可塑性,可根据局部微环境的变化调整表型以适应其功能特性,在SAP的发生、发展过程中发挥着重要作用[18]。在炎症初期,巨噬细胞感受到炎性因子的刺激后主要表现为M1型,通过分泌大量IL-1、TNF-α等促炎因子参与炎症的发生和发展。而M2巨噬细胞可分泌IL-4、IL-10及转化生长因子-β(transforming growth factor-β,TGF-β)等抗炎因子,抑制过度活化的炎症反应,促进组织修复[19]。因此,如果能在炎症初期调节巨噬细胞的极化状态,诱导其向M2型极化,或许可有效减轻组织的炎性损伤。
大量研究证实,肺巨噬细胞在SAP相关性肺损伤中发挥着极其重要的作用,因此探讨P-MSCs移植对SAP大鼠肺巨噬细胞极化的影响具有重要意义。本研究免疫荧光染色结果显示,相比对照组,SAP组大鼠肺组织中有大量巨噬细胞浸润,且高表达iNOS,低表达CD163;相比SAP组,P-MSCs组大鼠肺组织中iNOS表达明显降低,CD163表达明显升高,提示P-MSCs可有效诱导SAP大鼠肺巨噬细胞向M2型极化。
综上所述,本研究结果表明,P-MSCs可有效减轻SAP大鼠肺组织的炎性损伤,其机制可能与诱导肺巨噬细胞向M2型极化有关,但P-MSCs调控肺巨噬细胞向M2型极化的具体路径尚不清楚,有待进一步研究。
