腹腔穿刺引流对重症急性胰腺炎大鼠肠道TLR4表达的影响及意义
2021-01-22黄尚卿文艺王冰李帅原小惠孙红玉汤礼军
黄尚卿,文艺,王冰,李帅,原小惠,孙红玉,汤礼军*
1西南交通大学医学院,成都 610031;2西部战区总医院全军普通外科中心/四川省胰腺损伤与修复重点实验室,成都 610083;3西部战区总医院基础医学实验室,成都 610083
重症急性胰腺炎(severe acute pancreatitis,SAP)是以胰腺广泛炎症反应伴组织坏死为主要特征,且病情进展迅速的急症,病死率高达15%~25%[1]。在S A P 早期,失控的全身炎症反应所造成的多器官损伤是患者死亡的主要病理生理基础,其中胰腺炎相关肠道损伤(pancreatitis-associated intestinal injury,PAII)是SAP早期病程中最常见的胰外并发症,与SAP的严重程度密切相关[2]。 据报道,肠道尤其是小肠不仅是SAP进程中的受累器官,更是全身炎症反应发生的助推器[3]。因此,积极预防PAII的发生或减轻其损伤程度是SAP治疗的重要环节。本课题组前期研究证实,早期实施腹腔穿刺引流(abdominal paracentesis drainage,APD)排出含有多种毒性物质的胰腺炎相关腹水(pancreatitis associated ascite fluid,PAAF)能明显减轻全身炎症反应程度,改善肠屏障功能[4-5],但目前该肠道保护作用的机制认识仍十分有限,亟待进一步研究。Toll样受体4(Toll-like receptor 4,TLR4)是哺乳动物体内模式识别受体家族的重要成员,也是传递细胞外抗原信息并触发炎症反应的关键跨膜蛋白。近期研究表明,TLR4在SAP炎症反应的启动和器官损伤中均发挥着重要作用,可通过依赖髓样分化因子88(myeloid differentiation factor,MyD88)途径激活NF-κB炎症信号通路,从而参与PAII的发生与发展[6]。基于此,本研究探讨早期实施APD对肠道TLR4表达的影响及意义,以期为进一步深入了解APD的作用机制提供新的依据。
1 材料与方法
1.1 主要试剂及仪器 95%纯度牛磺胆酸钠购自美国Sigma公司;ELISA试剂盒、紫外比色法试剂盒购自南京建成生物工程研究所;TUNEL试剂盒、SP免疫组化试剂盒购自武汉博士德生物工程有限公司;鲎试剂盒购自厦门鲎试剂生物科技股份有限公司;RNA提取试剂、全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;一步法PCR试剂盒购自日本TaKaRa公司;兔抗大鼠TLR4多克隆抗体、兔抗大鼠Bcl-2单克隆抗体购自英国GeneTex公司;兔抗大鼠Myd88、NF-κB p65、Bax单克隆抗体购自美国Abcam公司;兔抗大鼠caspase-3单克隆抗体购自德国Cell Signaling Technology公司;小鼠抗大鼠GAPDH单克隆抗体、山羊抗兔和抗小鼠二抗购自武汉Proteintech公司。动物麻醉机及动物用异氟烷购自深圳市瑞沃德生命科技有限公司。
1.2 实验分组及模型制备 SPF级雄性SD大鼠45只,8~9周龄,体重190~210 g,购自成都达硕实验动物有限公司。大鼠适应性喂养1周后,禁食12 h,禁饮6 h,随机分为假手术(Sham)组、SAP组与APD组,每组15只。按照本团队既往报道的方法[7]建立SAP大鼠模型,即大鼠麻醉后,开腹寻找十二指肠降段,充分暴露胆胰管开口,将1 ml注射器针头在成功穿刺进入胰胆管后用动脉夹固定。采用微量输液泵向胆胰管输入5%牛磺胆酸钠溶液,剂量0.1 ml/100 g,输注速率12 ml/h,压力维持时间10 min,完成后腹腔注射头孢唑林钠(山东鲁抗医药股份有限公司,剂量50 mg/kg)并关腹。Sham组大鼠在麻醉后开腹找到胰腺组织,翻动数次后关腹。APD组大鼠在成功制备SAP模型后,于右下腹接入引流管并固定于腹壁,外套金属弹簧圈,引流管外接负压吸引球。所有大鼠在建模后均于背部皮下多点注射温生理盐水(5 ml/100 g),禁食不禁水。建模后24 h处死大鼠,采集血样、胰腺和小肠组织(末段回肠)。本研究经西部战区总医院动物伦理委员会审核批准,实验过程符合国家动物实验指导原则的相关规定。
1.3 小肠和胰腺组织病理学检测 小肠和胰腺组织经4%多聚甲醛溶液固定24 h后,梯度脱水、透明、石蜡包埋、切片,厚度4 μm,行HE染色。由两位病理科医师在光镜下观察小肠和胰腺组织病理学变化,并采用双盲法进行病理评分。胰腺组织病理评分参照Schmidt等[8]的方法,小肠组织病理评分参照Chiu等[9]的方法。
1.4 血清淀粉酶、脂肪酶活性及肠道损伤相关指标、血清和小肠组织炎性因子水平检测 血清淀粉酶、脂肪酶活性采用深圳迈瑞生物兽用全自动生化分析仪检测;血清二胺氧化酶(DAO)活性采用紫外比色法检测,血清D-乳酸、内毒素以及血清和小肠组织TNF-α、IL-6水平采用ELISA法测定,均严格按照说明书步骤操作。
1.5 TUNEL法检测肠黏膜上皮细胞凋亡情况 小肠组织石蜡切片经梯度脱蜡水化后,采用TUNEL法检测肠黏膜上皮细胞凋亡情况,严格按照说明书步骤操作。荧光显微镜下观察并计算细胞凋亡指数(apoptosis index,AI)。AI(%)=凋亡细胞数/细胞总数×100%。
1.6 RT-PCR检测小肠组织TLR4 mRNA的表达水平 采用TRIzol法提取小肠组织总RNA,并用分光光度仪检测RNA的含量和纯度,A260/A280比值在1.8~2.1的样本符合实验要求。按照一步法RT-PCR试剂盒要求配制25 μl反应体系进行目标序列扩增,采用Bio-Rad CFX软件分析TLR4 mRNA的表达水平变化。引物序列由上海生物工程有限公司合成 (表1)。

表1 PCR引物序列及反应条件Tab.1 Primer sequences and reaction conditions used in PCR
1.7 免疫组化法检测小肠组织TLR4蛋白的表达 小肠组织石蜡切片经梯度脱蜡水化后,经抗原修复、兔抗大鼠TLR4多克隆抗体(1:400)和山羊抗兔二抗(1:1000)孵育后,用免疫组化试剂盒进行染色,严格按照说明书步骤操作。采用Image-Pro Plus软件进行光密度值分析。
1.8 Western blotting检测小肠组织TLR4信号通路关键蛋白及凋亡相关蛋白的表达 按照试剂盒说明书操作,提取小肠组织总蛋白并测定总浓度,经常规电泳、转膜、封闭后,分别加入抗TLR4(1:500)、MyD88(1∶2000)、p65(1:1000)、p-p65(1:1000)、Bax(1:2000)、Bcl-2(1:1000)、caspase-3(1:1000)和GAPDH(1:5000)一抗,4 ℃杂交过夜,次日加入二抗(1:5000),经化学发光后,应用UVP BioSpectrum 410成像系统曝光并分析目的条带光密度值。
1.9 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析(Tukey法),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 APD对胰腺组织病理损伤和胰腺炎血清指标的影响 HE染色结果显示,建模后24 h,Sham组大鼠胰腺组织大体结构正常;SAP组胰腺组织水肿,腺小叶结构紊乱,出现大片边界不清的溶解坏死灶,炎性细胞浸润明显,病理评分明显升高(P<0.05);与SAP组比较,APD组胰腺组织病理改变明显减轻,胰腺小叶大体结构清晰,仅出现散在的点状坏死灶,病理评分显著降低(P<0.05, 图1A、B)。同时,SAP组大鼠血清淀粉酶和脂肪酶活性以及TNF-α、IL-6水平较Sham组明显升高,而APD组上述指标较SAP组明显降低(P<0.05,图1C-F)。
2.2 APD对小肠组织病理改变和肠道损伤相关血清指标的影响 HE染色结果显示,Sham组大鼠小肠黏膜结构正常;与Sham组比较,SAP组大鼠小肠结构和肠绒毛形态出现明显异常,包括绒毛顶端剥落、黏膜和黏膜下肿胀、充血伴炎性细胞浸润以及潘氏细胞中颗粒物增加,病理评分明显升高(P<0.05);与SAP组比较,APD组大鼠小肠病理改变明显减轻(P<0.05,图2A、B)。同时,SAP组大鼠血清D-乳酸、内毒素水平以及DAO活性明显升高,APD组上述指标水平较SAP组明显降低(P<0.05, 图2C-E)。
2.3 APD对小肠组织TLR4、MyD88和NF-κB p65表达的影响 RT-PCR法检测结果显示,建模后24 h,SAP组大鼠小肠组织TLR4 mRNA的表达水平较Sham组明显升高,免疫组化和Western blotting检测进一步证实TLR4蛋白的表达水平也呈升高趋势;APD干预后,TLR4的mRNA和蛋白表达水平较SAP组明显降低(P<0.05,图3A-D)。伴随TLR4表达水平的升高,SAP组MyD88蛋白的表达水平和 NF-κB p65的磷酸化水平也显著升高,而APD组上述指标较SAP组均明显降低(P<0.05,图3E、F)。
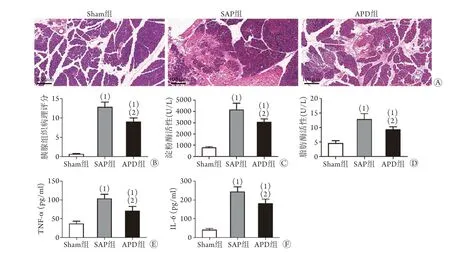
图1 APD对大鼠胰腺组织病理损伤和胰腺炎血清指标的影响Fig.1 Effects of APD on the pathological injury of pancreatic tissue and serum markers of pancreatitis
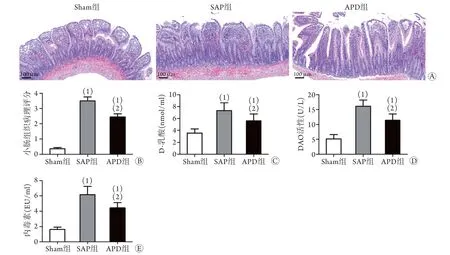
图2 APD对大鼠小肠组织病理改变和肠道损伤相关血清指标的影响Fig.2 Effects of APD on the pathological changes of small intestine and serum indexes related to intestinal injury
2.4 APD对小肠组织炎性因子表达和肠黏膜细胞凋亡的影响 ELISA检测结果显示,与Sham组比较,SAP组大鼠肠黏膜炎性因子TNF-α和IL-6的表达水平明显升高(P<0.05,图4A、B)。TUNEL法检测结果显示,SAP组大鼠肠黏膜细胞凋亡指数较Sham组明显增高,Western blotting检测显示促凋亡蛋白Bax和cleaved-caspase-3的表达水平升高,抗凋亡蛋白Bcl-2的表达水平降低(P<0.05,图4C-H)。早期实施干预后,APD组大鼠肠黏膜炎性因子的表达和肠黏膜细胞凋亡指数较SAP组明显降低,促凋亡蛋白和抗凋亡蛋白比例失衡明显改善(图4,P<0.05)。
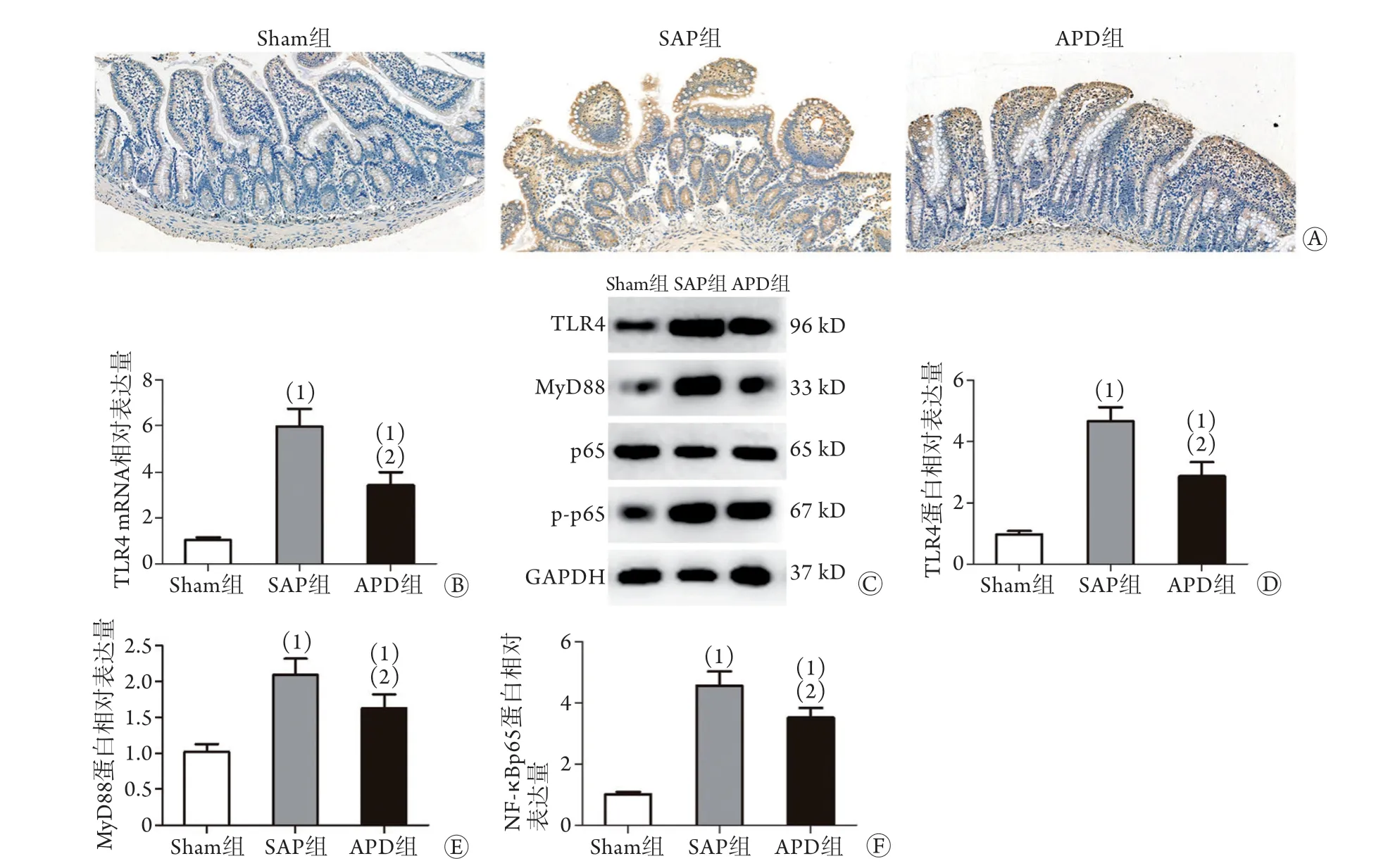
图3 APD对大鼠小肠组织TLR4、MyD88和NF-κB p65表达的影响Fig.3 Effects of APD on the expressions of TLR4, MyD88 and NF-κB p65 in intestinal tissues
3 讨 论
PAII是SAP早期最常见的胰腺外损伤之一。DAO特异性存在于哺乳动物肠黏膜上皮细胞的胞质内,其在外周血中的基础水平与肠黏膜的完整性呈明显负相关[10]。本研究中,建模后24h即观察到SAP组大鼠小肠黏膜的绒毛形态出现明显异常,同时反映肠黏膜完整性和肠屏障功能的血清指标,如DAO活性、D-乳酸和内毒素水平均显著升高,表明SAP大鼠模型伴有明显的肠道损伤。相关研究发现,肠黏膜屏障功能的损害及其介导的病理生理变化在SAP进程中扮演着重要角色[11]。SAP造成的肠黏膜完整性破坏和通透性增加会导致细菌和内毒素移位,引起肠源性感染和脓毒症,从而进一步刺激已激活的单核细胞和巨噬细胞释放大量炎性因子,促使全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的发生,并对胰腺及胰外其他器官造成“二次打击”[2]。因此,积极预防PAII的发生或减轻其损伤程度是SAP治疗的重点。
在SAP早期,腹腔内可出现程度不等的PAAF,其在SAP进程中的作用已逐渐被揭示[12]。一方面,PAAF中含有大量的消化酶、炎性介质、游离脂肪酸等毒性物质,不仅能刺激腹腔巨噬细胞合成和释放大量促炎细胞因子,从而加重全身炎症反应,还能通过腹膜重吸收等途径进入外周血造成胰外器官损伤[13-14];另一方面,PAAF的积聚会造成腹内压增高,致使腹腔间室综合征(abdominal compartment syndrome,ACS)的发生风险增加[15]。然而,目前相关的治疗指南均未对PAAF提出指导性的处理意见。本团队前期的系列研究表明,通过APD及时去除PAAF是SAP治疗中的重要环节,能减轻SAP的重症化倾向,发挥保护重要脏器的作用[16]。本研究发现,早期实施APD治疗能明显减小SAP大鼠胰腺组织的坏死面积,减轻全身炎症反应的程度和小肠黏膜的病理改变,降低肠道损伤相关血清指标的水平,表明APD具有显著的肠屏障保护作用,但其潜在的分子机制目前尚不明确。
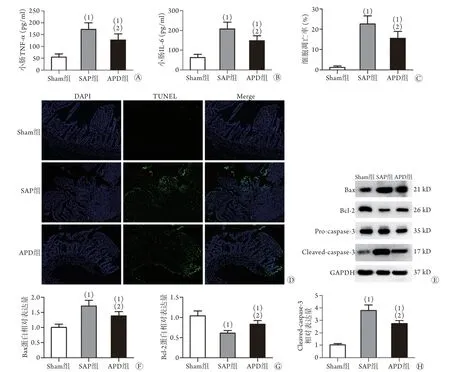
图4 APD对大鼠小肠组织炎性因子表达和肠黏膜细胞凋亡的影响Fig.4 Effect of APD on the expression of inflammatory factors and apoptosis of intestinal mucosal cells
TLR4是广泛表达于哺乳动物细胞表面的一种跨膜信号转导蛋白,也是模式识别受体家族的重要成员,在诱导机体炎症反应中起着重要的枢纽作用[17]。有研究发现,TLR4可通过MyD88途径激活NF-κB炎症信号通路,进而诱导细胞大量合成和释放多种促炎细胞因子,引起炎症正反馈的恶性循环,加重SAP及局部脏器的炎性损伤[18]。此外,Zheng等[19]的研究发现,SAP时大鼠肠黏膜TLR4的表达水平明显升高,而抑制其表达能显著减轻PAII的程度,表明TLR4及其下游信号通路激活可能是PAII的重要机制。本研究结果显示,SAP组大鼠小肠黏膜TLR4明显活化,这可能与发生SAP时外周血中高浓度的炎性细胞因子以及肠黏膜缺血缺氧密切相关。而下游激活的NF-κB信号通路可促使多种促炎细胞因子合成增加,致使小肠组织TNF-α和IL-6的表达水平明显高于Sham组。经APD治疗后,SAP大鼠肠黏膜TLR4信号通路关键蛋白和炎性因子的表达明显减少,提示APD可能通过抑制TLR4信号通路的激活,进而减轻SAP引起的肠道炎症反应。另有研究报道,炎症与细胞凋亡的发生密切相关,NF-κB信号通路的激活会造成调控细胞凋亡的相关蛋白表达失衡,尤其是促凋亡蛋白caspase-3是执行细胞死亡的关键蛋白,其活化后的裂解产物会进一步激活Caspase信号通路,最终引起细胞凋亡[20-21]。而肠黏膜上皮细胞的凋亡已被证实参与了SAP引起的肠黏膜屏障破坏和通透性增加[22-23]。本研究发现,随着肠道炎症反应的加重,SAP大鼠肠黏膜促凋亡蛋白Bax和cleaved-caspase-3的表达水平升高,抗凋亡蛋白Bcl-2的表达水平降低,细胞凋亡数目明显增加。而在APD治疗后,促凋亡蛋白与抗凋亡蛋白的失衡得到明显改善,肠黏膜细胞凋亡数目明显减少,进一步提示APD对PAII的保护作用可能与减轻炎症导致的肠黏膜细胞凋亡有关。
综上所述,本研究结果表明早期实施APD能显著降低SAP大鼠肠道TLR4的表达,抑制下游NF-κB信号通路的激活,减轻小肠组织炎症反应程度,进而减少肠黏膜上皮细胞的凋亡,以此发挥肠道保护作用。
