荧光定量PCR测定粗品肝素钠DNA提取液中反刍基因及猪基因的浓度
2021-01-22李丽红米文强张雪霞任风芝刘建芬
李 宁,李丽红,米文强,张雪霞,任风芝*,刘建芬
(1.华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心河北省工业微生物药物代谢工程技术中心,河北 石家庄 050015;2.华北制药华坤河北生物技术有限公司,河北 石家庄 050000)
肝素钠是由不同分子量糖链的硫酸氨基葡聚糖的钠盐组成的混合物[1],是目前抗凝血和抗血栓的首选药物[2],还具有抗平滑肌细胞增殖、抗炎症、抗肿瘤及抗病毒等多种生物学功能[3]。肝素钠可以从猪、牛的小肠黏膜和牛肺等组织中提取,但由于疯牛病的出现,使牛源肝素钠的应用受到了限制[4]。不同动物来源的肝素钠具有不同的化学结构和生物活性,其不良反应也不同,牛源肝素钠引起血小板减少的不良反应约是猪源肝素钠的2倍[5]。《中华人民共和国药典》2020年版中明确规定,肝素钠应从检疫合格的猪肠黏膜中提取,并对肝素钠的动物来源进行种属鉴别[1]。因此,开发一种快速检测粗品肝素钠中反刍基因及猪基因的方法,对于判定肝素钠的动物来源尤为重要。作者采用细胞裂解和蛋白酶K消化技术,结合DNA制备柱选择性吸附DNA的方法提取粗品肝素钠中的动物DNA,将DNA标准溶液、粗品肝素钠DNA提取液分别与相应的PCR试剂混合,进行PCR扩增,测定粗品肝素钠DNA提取液中反刍基因及猪基因浓度。
1 实验
1.1 材料、试剂与仪器
粗品肝素钠(猪源),华北制药华坤河北生物技术有限公司;粗品肝素钠(羊源),广东赛格生物技术有限公司。
基因组DNA小量试剂盒(DNA制备柱、核糖核酸酶A、裂解液、蛋白酶K、蛋白去除液、洗涤液、去盐液、洗脱液),康宁生命科学(吴江)有限公司;反刍基因荧光PCR检测试剂盒(反刍基因PCR试剂预混剂、双蒸馏水、TE缓冲液、反刍基因组DNA对照品)、猪基因荧光PCR检测试剂盒(猪基因PCR试剂预混剂、双蒸馏水、TE缓冲液、猪基因组DNA对照品)、牛基因组DNA对照品、绵羊基因组DNA对照品、山羊基因组DNA对照品,广东赛格生物技术有限公司。
ABI Prism 7000型荧光定量PCR仪,美国应用生物系统公司;XW-80A型涡旋混合器,上海精科实业有限公司;TGL-20M型高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;水浴锅,泰特实验仪器厂。
1.2 粗品肝素钠DNA提取液的制备
将1.0 g粗品肝素钠用水溶解至10 mL,10 000 r·min-1离心5 min;取上清液100 μL于离心管中,加入250 μL双蒸馏水、0.9 μL 核糖核酸酶A,涡旋混合30 s;然后加入150 μL裂解液,涡旋混合30 s,再加入20 μL 蛋白酶 K,涡旋混合30 s, 56 ℃水浴30 min,得消化液;向消化液中加入350 μL 蛋白去除液,轻轻摇匀,12 000 r·min-1离心10 min;上清液转移至DNA制备柱中,静置5 min后,12 000 r·min-1离心1 min;弃去滤液,DNA制备柱用500 μL洗涤液离心洗涤后,用去盐液离心洗涤2次,每次700 μL;最后在DNA制备柱中加入150 μL 65 ℃预热的洗脱液,静置2 min,离心,收集洗脱液至洁净的灭菌离心管中,得粗品肝素钠DNA提取液,即供试溶液。
1.3 DNA标准溶液的配制
1.3.1 反刍基因组DNA标准溶液的配制
取10 ng·μL-1反刍基因组DNA标准溶液,用TE缓冲液稀释至浓度分别为1 000 pg·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1、0.1 pg·μL-1、0.01 pg·μL-1的反刍基因组DNA标准溶液。
1.3.2 猪基因组DNA标准溶液的配制
取10 ng·μL-1猪基因组DNA标准溶液,用TE缓冲液稀释至浓度分别为10 000 pg·μL-1、1 000 pg·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1、0.1 pg·μL-1的猪基因组DNA标准溶液。
1.4 荧光定量PCR扩增检测
1.4.1 反应液的配制
按每孔PCR试剂预混剂11.5 μL、双蒸馏水6.5 μL的比例分别混合稀释反刍基因PCR试剂预混剂及猪基因PCR试剂预混剂;将粗品肝素钠DNA提取液与DNA标准溶液按2 μL/孔分别添加至对应的PCR反应孔中,混合均匀。
1.4.2 测试程序
PCR扩增程序:95 ℃ 120 s;95 ℃ 5 s,60 ℃ 30 s,45个循环。计算溶液中反刍基因及猪基因浓度。
2 结果与讨论
2.1 反刍基因PCR试剂和猪基因PCR试剂的专属性
在反刍基因PCR试剂和猪基因PCR试剂中分别加入牛基因组DNA标准溶液、绵羊基因组DNA标准溶液、山羊基因组DNA标准溶液、猪基因组DNA标准溶液、双蒸馏水(空白对照),进行PCR扩增,考察反刍基因PCR试剂和猪基因PCR试剂的专属性,结果见表1。
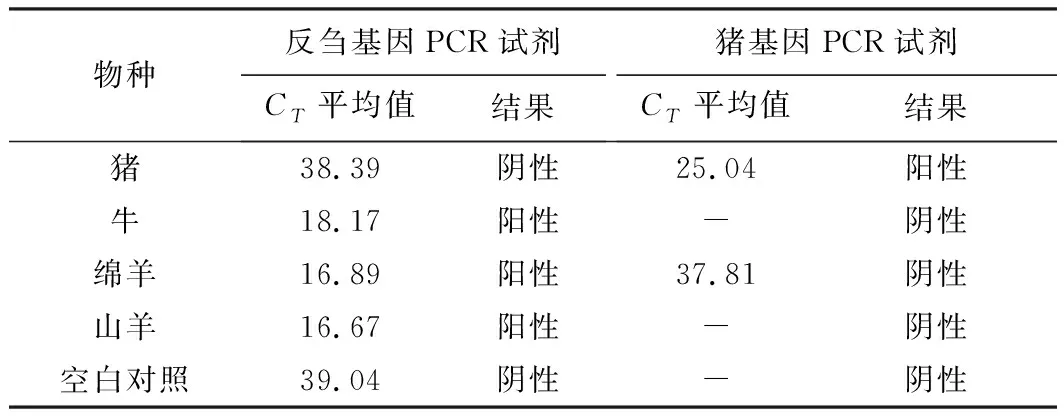
表1 反刍基因PCR试剂和猪基因PCR试剂的专属性
从表1可知,反刍基因PCR试剂对牛基因组DNA、绵羊基因组DNA、山羊基因组DNA可正常扩增,结果均为阳性;对猪基因组DNA、空白对照的扩增结果均为阴性。猪基因PCR试剂对猪基因组DNA正常扩增,结果为阳性;对牛基因组DNA、绵羊基因组DNA、山羊基因组DNA与空白对照的扩增结果均为阴性。表明反刍基因PCR试剂和猪基因PCR试剂的专属性满足检测要求。
2.2 线性范围
2.2.1 反刍基因浓度的线性范围
以浓度为0.01~1 000 pg·μL-1的反刍基因组DNA标准溶液为模板进行PCR扩增,以双蒸馏水为空白对照。以反刍DNA浓度的对数(logc)为横坐标、扩增CT值为纵坐标,绘制标准曲线(图1),拟合得线性回归方程为:CT=-3.46logc+25.95,R2=0.9990,扩增效率=94.54%。表明反刍基因浓度在0.01~1 000 pg·μL-1范围内与扩增CT值线性关系良好。
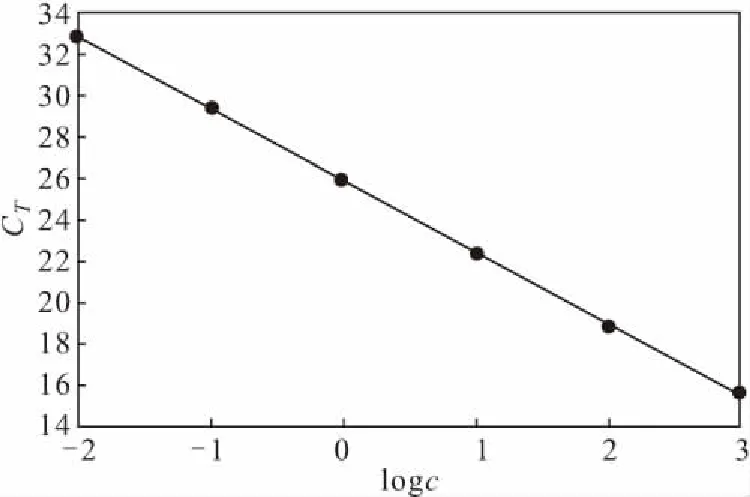
图1 反刍基因的标准曲线Fig.1 Standard curve of ruminant gene
2.2.2 猪基因浓度的线性范围
以浓度为0.1~10 000 pg·μL-1的猪基因组DNA标准溶液为模板进行PCR扩增,以双蒸馏水为空白对照。以猪DNA浓度的对数(logc)为横坐标、扩增CT值为纵坐标,绘制标准曲线(图2),拟合得线性回归方程为CT=-3.18logc+32.63,R2=0.9952,扩增效率=106.11%。表明猪基因浓度在0.1~10 000 pg·μL-1范围内与扩增CT值线性关系良好。
2.3 准确度
2.3.1 反刍基因检测准确度
分别将浓度为10 000 pg·μL-1、1 000 pg·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1的牛基因组DNA标准溶液与粗品肝素钠DNA提取液按1∶9的比例混合,作为模板进行PCR扩增,结果见表2。
由表2可知,反刍基因的平均回收率为107.66%,RSD为7.11%,表明该方法测定反刍基因浓度的准确度满足检测要求。
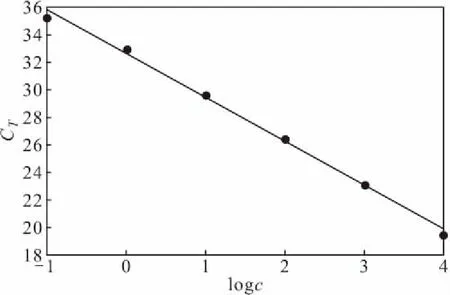
图2 猪基因的标准曲线Fig.2 Standard curve of porcine gene
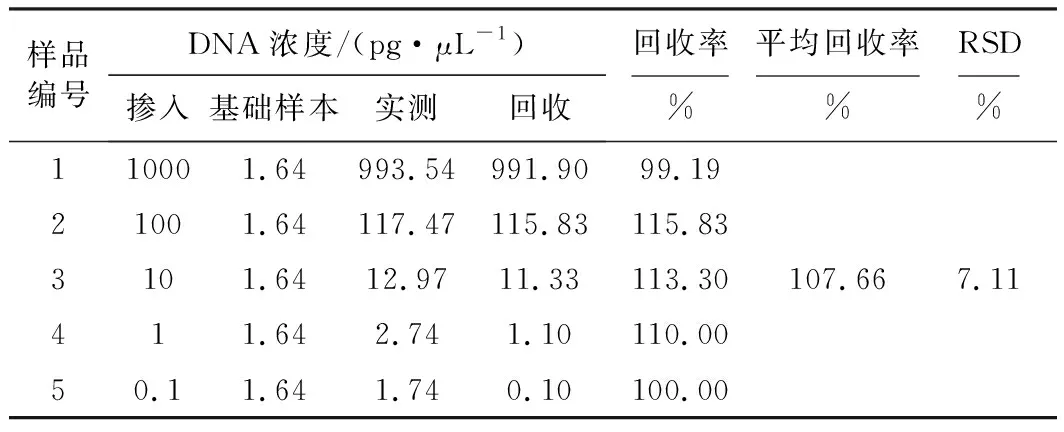
表2 反刍基因检测准确度
2.3.2 猪基因检测准确度
分别将浓度为10 000 pg·μL-1、8 000 pg·μL-1、6 000 pg·μL-1、4 000 pg·μL-1、2 000 pg·μL-1的猪基因组DNA标准溶液与粗品肝素钠DNA提取液按1∶9的比例混合,作为模板进行PCR扩增,结果见表3。
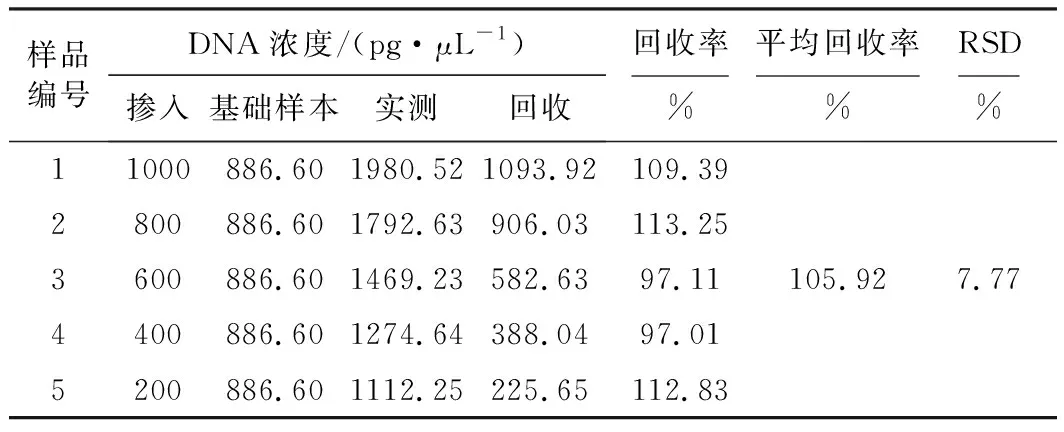
表3 猪基因检测准确度
由表3可知,猪基因的平均回收率为105.92%,RSD为7.77%,明该方法测定猪基因浓度的准确度满足检测要求。
2.4 精密度
取1批猪源粗品肝素钠与1批羊源粗品肝素钠等比例混合均匀,由 2 名实验人员在不同时间分别制备供试溶液6份,测定反刍基因与猪基因浓度,结果见表4。
由表4可知,反刍基因和猪基因浓度的RSD分别为7.01%、5.60%,表明该方法的精密度满足检测要求。
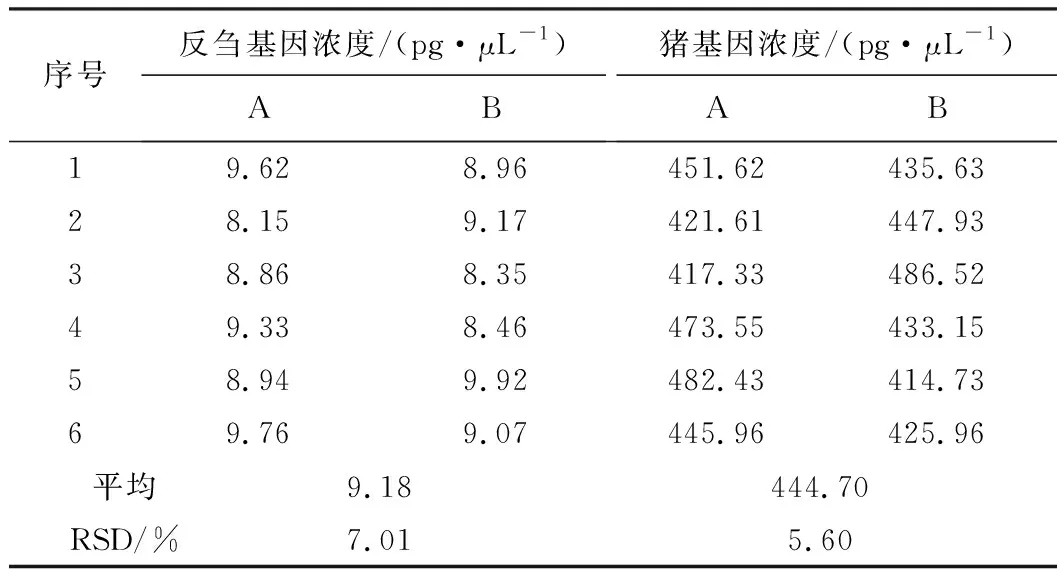
表4 检测精密度
2.5 稳定性
取1批猪源粗品肝素钠与1批羊源粗品肝素钠等比例混合均匀,制备供试溶液,将DNA标准溶液、供试溶液于(4±2) ℃分别放置0 h、12 h、24 h、36 h、48 h,测定反刍基因与猪基因浓度,结果见表5。
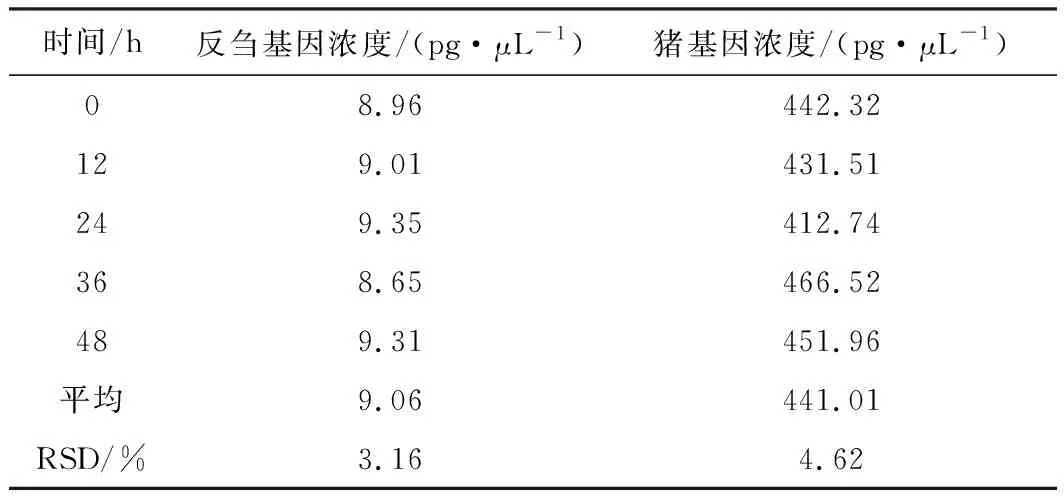
表5 供试溶液的稳定性
由表5可知,反刍基因和猪基因浓度的RSD分别为3.16%、4.62%,表明DNA标准溶液和供试溶液于(4±2) ℃放置48 h内稳定。
2.6 样品测定
对3批粗品肝素钠进行检测,批号MHC190601、MHC190602、MHC190603的样品中反刍基因浓度分别为3.02×10-2pg·μL-1、3.21×10-2pg·μL-1、1.64×10-2pg·μL-1,猪基因浓度分别为604.81 pg·μL-1、1 063.24 pg·μL-1、886.60 pg·μL-1。
3 结论
采用细胞裂解和蛋白酶K消化技术,结合DNA制备膜选择性吸附DNA的方法,可同时处理多个样品,快速提取粗品肝素钠中的动物DNA。将DNA标准溶液分别与含有针对猪或反刍动物特有基因序列设计的探针、引物的PCR试剂混合,进行PCR扩增,反刍基因浓度在0.01~1 000 pg·μL-1范围内线性关系良好,猪基因浓度在0.1~10 000 pg·μL-1范围内线性关系良好。该方法具有良好的专属性、准确度、精密度,适用于粗品肝素钠动物来源的种属鉴别。
