发酵剂抗氧化活性对发酵肉制品品质的影响研究进展
2021-01-20刘英丽于青林李洪岩
刘英丽,于青林,万 真,李洪岩,刘 洁,王 静
(北京工商大学食品与健康学院,中国-加拿大食品营养与健康联合实验室(北京),北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048)
发酵肉制品是指原料肉在特定的温度和湿度条件下,经微生物或酶的发酵作用而制成的具有较长货架期以及特殊风味、质地和色泽的肉制品[1]。发酵肉制品历史悠久、种类繁多,一般可分为以萨拉米香肠、广式腊肠、中式香肠为代表的发酵香肠类和以金华火腿、宣威火腿、帕尔玛火腿为代表的发酵火腿类;此外,广义上来说,以腊肉、板鸭、酸肉为代表的中国传统腌腊肉制品也均属于发酵肉制品[2-3]。蛋白质和脂肪作为发酵肉制品中最重要的组成成分,其在生产加工过程中极易发生氧化降解,从而影响产品的品质。在发酵及成熟过程中,蛋白质水解生成短肽和游离氨基酸等物质,在微生物作用下继续降解生成醛、酸和酯等,蛋白质适度降解可以改善产品的营养价值和风味,而蛋白质的过度氧化会对肉的质地、保水性和风味等产生不利影响,此外,蛋白质的氧化诱导还可能会影响其消化利用率,降低肉制品的营养价值[1,4-5]。脂肪氧化除直接产生己醛、2-壬烯醛、2,4-壬二烯醛、丁酸乙酯和1-辛烯-3-醇等挥发性风味化合物外,其氧化降解产物还能进一步参与美拉德反应,从而赋予发酵肉制品独特浓郁的风味[6]。适度的脂肪氧化可以改善肉制品风味、提升品质,但过度氧化会产生酸败味、哈喇味,使发酵肉制品失去良好色泽和质构品质,缩短产品的货架期,影响消费者的接受程度,甚至会产生丙二醛、戊醛、4-羟基壬醛等有毒物质,对人体健康造成威胁[7-8]。因此,在发酵肉制品加工及流通过程中,如何抑制肉制品中脂肪和蛋白质的过度氧化受到广泛关注。
目前,肉制品企业常通过添加天然或人工合成抗氧化剂来抑制产品的过度氧化,延长发酵制品的保藏期,常用的抗氧化剂主要有丁基羟基茴香醚、二丁基羟基甲苯、异抗坏血酸、茶多酚和迷迭香等[9-10]。随着毒理学研究的深入,对于在肉质品中添加合成抗氧化剂的安全性受到质疑,有研究表明多种合成抗氧化剂具有潜在安全风险[11]。例如大量摄入丁基羟基茴香醚可诱发大鼠前胃癌[12];二丁基羟基甲苯会促进甲状腺癌和膀胱癌的发生[13];过量摄入没食子酸丙酯的不良反应包括肾脏损伤、胃刺激以及过敏反应等[14]。同时天然抗氧化剂的使用因来源及工艺等原因而发展受限。发酵剂作为肉类发酵过程中必不可少的加工助剂,在发酵肉制品中的作用被广泛研究,一些功能性发酵剂被发现具有抗癌[15]、抗氧化[16]、降低胆固醇[17]等功能。Zhang Yulong等[18]对分离自发酵酸肉中的弯曲乳杆菌SR6和副干酪乳杆菌SR10-1的抗氧化活性进行了测定,其中弯曲乳杆菌SR6具有较高的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率和还原力,副干酪乳杆菌SR10-1具有较高的羟自由基清除率和脂质过氧化抑制能力。Kantachote等[19]使用产γ-氨基丁酸(γ-aminobutyric acid,GABA)的发酵剂——戊糖片球菌HN8和纳木雷氏乳杆菌NH2混合发酵泰国发酵猪肉香肠,发现与对照组相比,混合发酵剂的使用显著降低了该香肠中生物胺和胆固醇的含量,同时提高了GABA水平。本文对脂肪与蛋白质的氧化、发酵肉制品中常见发酵剂的种类、抗氧化活性、抗氧化酶系以及抗氧化评价方法的研究进展进行综述,以期为功能性发酵剂在发酵肉制品中抗氧化性的研究及应用提供参考依据。
1 发酵肉制品中脂肪和蛋白质的氧化
1.1 脂肪的氧化
根据氧化过程中有无酶的参与,脂肪氧化可分为酶促氧化和非酶促氧化,后者又被称为自动氧化,在发酵肉制品的脂肪氧化过程中起主导作用[20-21]。酶促氧化过程中,O2在酶的作用下与不饱和脂肪酸的不饱和双键相连,进而发生氧化反应。自动氧化是指不饱和脂肪酸在加热、辐照、金属离子、水分等条件下的氧化反应,自然氧化过程是一个自由基链式反应过程,包含链引发、链传递和链终止3 个阶段,也称诱发期、增殖期和终止期[22-24]。氧气、不饱和脂肪酸及促氧化物质是脂肪氧化发生的必要条件,脂肪的不饱和程度直接影响产品的氧化稳定性。肉制品中的氧化反应通常发生于两个部位,分别是肌肉组织中的磷脂以及脂肪组织中的甘油三酯。其中磷脂因含有亚麻油酸和花生四烯酸等大量不饱和脂肪酸,且在肌肉组织中位置更靠近血红蛋白、氯化钠等催化剂,较甘油三酯更容易发生氧化酸败[25]。此外,脂肪氧化还受到温度、pH值、水分活度、金属离子、光、氯化钠等的影响。
不饱和脂肪酸发生氧化后继续分解产生醛、酮等羰基化合物和低级脂肪酸,羰基化合物进一步脱水、水解、环化生成内酯化合物,综合赋予发酵肉制品良好的风味[26]。Huan Yanjun等[27]发现金华火腿中约50%的风味物质直接来自于脂肪氧化。但随着氧化程度的加深,不饱和脂肪酸的过度氧化会给产品的风味、色泽等都带来负面的影响。韦诚等[28]在探究发酵时长对酸肉理化指标及安全特性影响时,发现发酵20~50 d时,酸肉具有较好的色泽、硬度及咀嚼性,随着发酵周期的延长,酸肉的过氧化值(peroxide value,POV)和硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)含量逐渐上升,肉制品的弹性下降,色泽变暗,品质降低。脂肪氧化产物中对肉制品风味起到贡献作用的一般为小分子化合物,对人体健康有害的主要是大分子脂肪氧化物[29]。因此,在发酵肉制品的生产过程中应尽量保留小分子脂肪氧化物,抑制大分子脂肪氧化物的形成。
1.2 蛋白质的氧化
自Martinaud等[30]发现活性氧对肉成熟过程中肌原纤维蛋白有影响后,有关肉类蛋白质氧化的研究越来越多。与脂肪氧化类似,蛋白质氧化同样遵循自由基链式反应过程,但蛋白质的氧化过程更为复杂且反应产物更多[31]。蛋白质氧化过程中主要发生氨基酸侧链基团的修饰。几乎所有氨基酸侧链均可以与自由基反应发生修饰,但不同氨基酸的敏感程度并不相同。其中半胱氨酸含硫的活性中心具有较高的敏感性,在所有氨基酸残基中最先被氧化,巯基氧化形成二硫键,导致蛋白质的交联。Stadtman[32]报道活性氧优先攻击氨基酸残基的侧链,并导致一些氨基酸残基转化为羰基衍生物。此外,常见的蛋白质氧化反应还包括芳香族氨基酸侧链与脂肪族发生羟基化、蛋氨酸亚砜化、碱性氨基酸脱氨生成羰基化合物等[33]。羰基化合物作为蛋白质氧化损伤的重要标志,一方面通过氨基酸侧链氧化及主肽链断裂直接形成;另一方面美拉德反应及蛋白质与非蛋白羰基化合物结合的间接作用也会导致羰基的产生[33-34]。
蛋白质氧化会引起蛋白质的交联和氨基酸侧链的改变,对肉制品的持水性、硬度等理化性质及蛋白质消化率产生影响[35]。Grune等[36]报道了蛋白质的适度氧化有利于蛋白酶对蛋白质的识别,提高蛋白质的水解率,过度氧化和交联会导致蛋白质聚集体的生成以及一些氨基酸侧链氧化分解,使蛋白质不易被蛋白酶识别。此外,大量研究还发现,蛋白质的氧化会导致肉嫩度和多汁性的降低,这可能与蛋白质氧化后水解敏感度降低、不易被蛋白酶识别以及蛋白质交联有关[37]。研究发现,干腌火腿中蛋白质氧化对产品品质影响显著,并导致干腌火腿硬度增加、多汁性下降[38]。
1.3 脂肪与蛋白质氧化的相互作用
在肉制品中,脂肪和蛋白质的氧化过程并不相互独立,根据现有研究提供的证据和共识,认为二者中任一方的氧化产物均会促进另一方的氧化,二者的氧化是相互促进的[37,39-40]。有研究指出,肉类系统中脂肪的氧化往往比肌原纤维蛋白氧化降解要快,脂质衍生的氢过氧化物和自由基容易导致蛋白质的氧化[33]。同时,肌红蛋白(myoglobin,Mb)的变性会导致铁元素的释放,从而促进脂肪的氧化[41]。图1描述了脂质双分子层中不饱和脂肪酸与氧合肌红蛋白(oxymyoglobin,MbO2)之间潜在的氧化相互作用[39],磷脂在金属离子等催化剂影响下发生氧化,产生过氧化自由基等初级氧化产物,其在脂肪氧化过程中非常不稳定,极易进一步氧化产生4-羟基壬烯醛等次级氧化产物,这些次级氧化产物能够促进氧和Mb氧化。同时,在氧和Mb氧化过程中会产生H2O2,其与Fe3+发生Fenton反应生成羟自由基又反过来促进脂肪氧化。值得注意的是,肌原纤维蛋白同时可以作为氧化还原活性物质,保护脂质等其他食物成分免受氧化反应。Garry等[42]报道了Mb具有清除体内活性氧的作用。
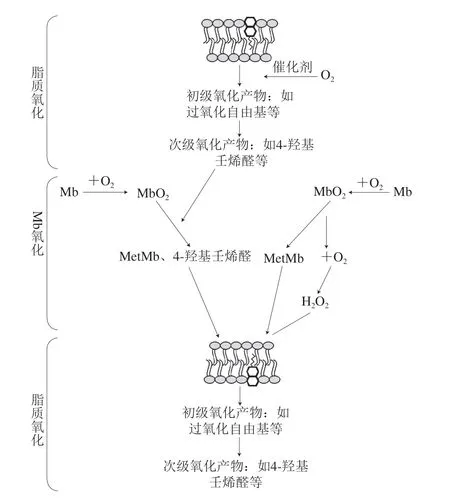
图1 脂质双分子层中不饱和脂肪酸与MbO2之间潜在氧化相互作用反应[39]Fig.1 Potential oxidative interactions between unsaturated fatty acids in the lipid bilayer and MbO2[39]
Estévez等[43]证实肉制品的颜色和质地特征与氧化引起的蛋白质功能性改变显著相关,迷迭香提取物的添加有效抑制了香肠中蛋白质的氧化,增强了法兰克福香肠的质地特征。吴雪燕[44]的研究也得出类似的结论。肉制品中脂肪和蛋白质的氧化相互关联,二者共同影响产品品质,天然或人工抗氧化剂对肉制品品质的影响已被大量研究,而功能性微生物对肉制品品质的影响仍缺少系统深入的研究。
2 发酵剂在发酵肉制品中的抗氧化作用
在传统发酵肉制品中,发酵微生物是在肉制品加工时通过环境和设备偶然混入原料中,并在竞争过程中逐渐成为优势菌的野生菌株。1940年Jenson和Paddock首次提出使用乳酸菌发酵香肠[4],开创了人类使用纯种发酵剂生产发酵肉制品的先河,自此,肉用发酵剂的应用与研究快速发展。在肉制品的发酵成熟中,微生物能够分解糖发酵产酸,降低肉制品的pH值,防止腐败菌的滋生,肌肉内源酶类能够降解脂肪和蛋白质,产生游离脂肪酸、氨基酸及挥发性风味物质,既提高了营养价值又赋予发酵肉制品独特的风味。其中对肉制品的发酵成熟起作用的微生物主要有细菌、酵母和霉菌[3]。
发酵肉制品传统的生产存在生产周期长、产品品质难以控制、安全性差等问题,随着发酵工业的进步,肉用发酵剂的品种日益繁多。Gilliland[45]认为良好的肉类发酵剂应符合非致病性、抗噬菌体、耐酸、耐盐、耐亚硝酸盐、在26.7~43 ℃下适宜生长等条件。此外,肉用发酵剂还应对肉制品的风味色泽有积极影响,耐酸、不具有氨基酸脱羧酶活性、不产生H2O2、对有害菌及病原体(如金黄色葡萄球菌、沙门氏菌、大肠杆菌及李斯特菌等)有拮抗作用[46]。如表1所示,发酵肉制品中常见的微生物主要有乳酸菌、葡萄球菌、微球菌、酵母菌及霉菌等[47-48]。

表1 发酵肉制品中常见的微生物种类及作用[47-48]Table 1 Common types of microorganisms and their functions in fermented meat products[47-48]
2.1 乳酸菌
乳酸菌是一类可以发酵糖类生产乳酸、微好氧或专性厌氧、革兰氏染色阳性无芽孢细菌的统称,在发酵肉制品成熟过程中起到降低pH值、抑制腐败菌生长、促进风味色泽形成等重要作用[49]。无氧条件下,乳酸菌利用肉类中的碳水化合物生产乳酸,迅速降低肉制品的pH值至4.8~5.2之间,根据代谢产物的不同,发酵过程只产生乳酸的称为同型发酵,除乳酸外还产生乙醇、醋酸、CO2等产物的称为异型发酵。低酸性环境一方面抑制了腐败病原菌的繁殖;另一方面也促进了水分的散失,加快了干燥的速率,延长了产品的货架期[50]。Stahnke[51]指出,低pH值可以促进亚硝酸盐转化为亚硝酸,进一步降解为一氧化氮(nitric oxide,NO)和其他化合物,有效抑制了强致癌物亚硝胺的生成。同时NO可以与Mb结合,生成亚硝基Mb,促进肉制品发色[52]。此外,乳酸菌还可以产生细菌素来抑制或杀死李斯特菌、金黄色葡萄球菌等病原微生物,提高自身的竞争力[52]。研究表明,乳酸菌的蛋白水解系统能够促进蛋白质降解,产生短肽及游离氨基酸等风味化合物,改善产品风味[53]。
乳酸菌具有抗氧化、维持肠道菌群平衡、降血压、降胆固醇等生理功能,是一种优质的天然抗氧化剂。Lin等[54]对19 株乳酸菌无细胞提取物的抗坏血酸自动氧化抑制能力、金属离子螯合能力、活性氧自由基清除能力、超氧化物歧化酶(superoxide diamutase,SOD)活力和还原活性等抗氧化能力进行测定,发现所有的菌株均表现出抗氧化活性。吴祖芳等[55]对4 种食物来源的抗氧化乳酸菌进行筛选鉴定,得出戊糖乳杆菌H15和植物乳杆菌H17具有较高的超氧阴离子自由基清除能力和抑制脂质过氧化能力。目前,普遍认可的乳酸菌抗氧化机制有4 种:1)乳酸菌面临氧胁迫时,通过分泌抗氧化物质(如硫醇类物质、抗氧化酶等)、清除活性氧及分解氧化代谢产物来抵抗氧胁迫作用;2)通过调节宿主细胞信号通路,如核因子E2相关性因子2(nuclear factor erythroid 2 related factor 2,Nrf2)、蛋白激酶C(protein kinase C,PKC)、蛋白激酶B等,提高其抗氧化能力;3)通过清除自由基系统控制细胞内自由基的数量,避免自由基过多造成细胞损伤;4)抑制脂质过氧化和螯合金属离子作用。此外,乳酸菌在发酵过程中产生的代谢产物以及自身产生的胞外多糖等也具有一定的抗氧化作用。乳酸菌的多种抗氧化调控机制往往不是单独发挥作用,而是相互关联(图2)。

图2 乳酸菌抗氧化作用机制[56]Fig.2 Antioxidant mechanism of lactic acid bacteria[56]
Yang Xin等[57]发现通过饲喂雏鸡植物乳杆菌JM113,雏鸡肠黏膜内Nrf2及下游HO-1基因的mRNA水平上调,有效减轻了霉菌毒素脱氧雪腐镰刀菌烯醇对雏鸡的不良影响。Pan Daodong等[58]发现从乳球菌培养物中分离得到的胞外多糖具有较强的羟自由基和超氧阴离子自由基清除能力,能够显著降低小鼠体内丙二醛的含量,并提高CAT和SOD的活力。
发酵肉制品研究方面,田圆圆等[59]对7 种传统腌腊肉制品中的乳酸菌进行分离鉴定和抗氧化能力分析,发现一株肠膜明串珠菌L4具有较强的抗氧化能力,同时满足肉类发酵剂的要求,有望开发为功能性肉类发酵剂。此外,还有研究发现具有高蛋白酶活性的乳酸菌可以提高发酵香肠中肽抗氧化活性。Cao Chenchen等[60]从中国传统发酵香肠中分离出一株工艺性能优良、蛋白酶活力高的植物乳杆菌CD101,并研究了其对发酵香肠肽抗氧化活性的影响,发现与对照组相比,以植物乳杆菌CD101为发酵剂的发酵香肠肽抗氧化活性显著提高。
2.2 葡萄球菌和微球菌
葡萄球菌和微球菌均属于微球菌科,二者的主要区别在于葡萄球菌兼性厌氧,有无氧气均能较好地生长,而微球菌专性好氧,多集中于发酵肉制品中富氧的表层部位,两者往往混合使用。实际生产中,葡萄球菌和微球菌除应满足肉用发酵剂的基本要求外,还应具备分解H2O2、蛋白质和脂肪的活性,以及硝酸盐还原酶活性,赋予发酵肉制品良好的风味和色泽,因此又被称为“风味菌”[61]。近年来,被广泛应用的发酵菌种主要有变异微球菌、肉糖葡萄球菌和木糖葡萄球菌。
乳杆菌和片球菌在发酵和成熟的最初阶段起到了重要作用,而葡萄球菌和微球菌则将最终影响产品的色泽和风味。在发酵过程中,葡萄球菌和微球菌都能产生硝酸还原酶和亚硝酸盐还原酶,既促进了腌肉色泽的形成,又降低了亚硝酸盐及致癌物亚硝胺的含量[62]。在发酵过程中许多乳酸菌会产生强氧化剂H2O2,葡萄球菌和微球菌具有H2O2酶活性,可以促进H2O2分解,抑制过氧化物的产生。Coppola等[63]对意大利南部一种传统发酵香肠中的菌种进行了分离鉴定,得到138 株葡萄球菌与微球菌,大多数菌株能在18 ℃或30 ℃下还原硝酸盐,并具有H2O2酶活性。许多研究表明,葡萄球菌和微球菌有助于改善发酵肉制品的品质,延长产品的货架期。张大磊等[64]研究具有亚硝酸盐还原酶、蛋白酶和脂肪酶活性的2 株葡萄球菌和微球菌发酵广式腊肠,发现接菌组比对照组有更高的感官评分和MetMb含量,更低的羰基值和TBARS含量。
2.3 霉菌和酵母菌
霉菌为好氧微生物,常分布于发酵肉制品的表面或靠外侧一层,形成一层“保护膜”。霉菌常用于中式火腿和意式发酵干香肠的生产,通过在肉制品表面定植形成一层霉衣,一方面能够控制水分的迁移,防止肉制品表面形成硬壳而影响产品品质;另一方面又起到避光和隔氧的作用,抑制产品的过度氧化。金二庆[65]在探究红曲菌发酵对广式腊肠风味、感官及贮藏特性的影响时,发现红曲菌有助于抑制广式腊肠中杂菌的生长,提高产品品质,延缓产品的腐败变质,延长保质期。此外,霉菌还具有抑菌以及分解蛋白质和脂肪的能力,对发酵肉制品品质及特征风味物质的形成起重要作用[66]。Rodríguez等[67]对伊比利亚干腌火腿中分离出来的微生物蛋白水解酶活性进行评价,发现产黄青霉对干腌肉制品中蛋白质的水解起重要作用,能显著提高火腿中游离氨基酸的含量。多数霉菌在人工培养基上可以产生霉菌毒素,因此霉菌发酵剂需验证安全无毒后方可应用,产黄青霉和纳地青霉是常用的不产毒霉菌发酵剂[61]。
酵母菌兼性好氧、耐高渗透压、产酸能力较弱,具有分解蛋白质、脂肪和H2O2的活性,主要分布于发酵肉制品的表面或浅表层[68]。在发酵肉制品的生产中酵母菌主要起到消耗氧气、改善色泽和风味、抑制病原微生物生长等作用。在氧气充足时,酵母菌进行好氧呼吸,消耗肉馅中残存的氧气,氧气耗尽后进行厌氧发酵,降低环境的pH值,酸性环境有助于抑制病原微生物的生长以及色泽的稳定[61]。多数酵母菌本身没有硝酸盐和亚硝酸盐的还原能力,甚至还会对固有微生物的硝酸盐还原能力产生抑制作用,在实际生产中酵母菌常与乳酸菌、微球菌等混合使用。常见的肉用酵母菌种主要有汉逊氏德巴利酵母和法马塔假丝酵母,近年来假丝酵母和鲁氏酵母等在发酵肉制品中也有应用[69]。Ozturk等[70]在研究分离自土耳其干发酵香肠Sucuk中酵母菌群的功能和工艺特性时,发现筛选出的24 株涎沫假丝酵母和23 株汉逊德巴利酵母均具有CAT活力。Flores等[71]发现汉逊氏德巴利酵母能够抑制脂肪氧化,促进发酵香肠特征风味物质乙酯的产生,对香肠成熟过程中挥发性物质的生成有重要作用。国内研究方面,李林[72]利用从发酵酸鱼中筛选出的3 种优势菌株(植物乳杆菌Lp120、木糖葡萄球菌Sx135和酿酒酵母菌Sc31)对鱼肉浆模拟体系进行发酵,发现与空白对照相比,Sc组表现出一定的抗氧化活性,同时Sc组的游离脂肪酸氧化率仅为387.5 g/kg,远低于Lp组(475.9 g/kg)及Sx组(802.2 g/kg)。
2.4 微生物抗氧化活性评价方法
微生物抗氧化活性的测定主要通过不同的方法分别对发酵上清液、菌悬液、胞外多糖和无细胞提取物这4 个部分进行评价。目前抗氧化的评价方法主要包括体外抗氧化活性评价法、细胞模型抗氧化评价法和体内抗氧化活性评价法。
体外抗氧化活性评价方法一般可分为4 类[73]:1)活性氧自由基清除能力,包括超氧阴离子自由基清除实验、羟自由基清除实验;2)基于氢原子转移能力,包括氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)法、TBARS法、硫氰酸铁(ferric thiocyanate,FTC)法;3)基于单电子转移能力,包括DPPH自由基清除实验、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除实验、铁还原能力(ferric ion reducing antioxidant power,FRAP)法;4)基于金属离子螯合能力(metal chelating capacity,MCC)法。表2总结了常见的体外抗氧化活性检测方法及其适用性。

表2 体外抗氧化活性检测方法Table 2In vitro antioxidant activity assays
体外抗氧化活性评价方法具有检测周期短、操作简单等优点,但每种方法在原理、适用范围上各有侧重,其检测结果通常只反映某种或某一类成分(如溶解特性)的抗氧化特性,难以对微生物的抗氧化性作出真实而全面的评价[89]。通常采用多种方法相互补充的方式,来弥补各种方法的不足,达到全面反映受试物抗氧化活性的目的[90]。此外,体外评价系统往往与细胞或生物体内真实环境相差较大,例如微生物不仅能够清除自由基,还可以通过提高细胞或者生物体内内源性抗氧化物质(如SOD、GPx)等的水平来起到抗氧化的效果。因此,通常采用体外评价对微生物的抗氧化性进行初筛,通过细胞模型或动物实验对微生物的抗氧化性进行进一步验证。
细胞模型抗氧化评价法具有快速、经济、准确的特点,能较好地阐明抗氧化剂在体内的吸收、代谢机理。当前,研究较多的细胞模型抗氧化评价法有基于红血球细胞抗氧化保护能力(cell-based antioxidant protection in erythrocytes,CAP-e)法、细胞抗氧化活性(cellular antioxidant activity,CAA)法、红细胞氧化溶血抑制(oxidative hemolysis inhibition assay,OxHLIA)法和氧化损伤细胞模型法。其中CAP-e法和CAA法的原理相同,利用荧光染料2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)进入细胞后在细胞酯酶的作用下分解为还原型二氯荧光素(2',7'-dichlorodihydrofluorescein,DCFH),外源性自由基引发剂2,2'-偶氮双(2-甲基丙脒)二盐酸盐(2,2'-azobis(2-methylpropionamidine) dihydrochloride,AAPH)将DCFH氧化为具有强荧光性的氧化型二氯荧光素,荧光强度与自由基含量成正比,与受试物抗氧化强度成反比[91]。二者的区别是前者以正常红细胞作为细胞模型,能有效避免细胞本身发生氧化应激的缺陷[92];后者以肝癌细胞作为细胞模型,肝脏是人体进行物质代谢的主要场所,而肝癌细胞具有和人体正常肝细胞相似的生理活性[93]。CAP-e法和CAA法灵敏度高,适用于高通量分析,缺点是荧光标记物敏感、检测设备昂贵、操作复杂、实验周期长[94]。OxHLIA法同样以AAPH作为自由基引发剂,测定受试物对氧化应激下红细胞溶血的抑制能力[95]。氧化损伤细胞模型法是指将细胞暴露于H2O2或脂质过氧化物体系下,观察受试物对细胞氧化损伤的抑制能力[96]。除上述常见的细胞抗氧化实验外,还有噻唑蓝法、ATP测定法、乳酸脱氢酶释放法等[97]。
虽然体外实验和细胞实验具有便捷、高效、成本低的优势,但仍不能完全反映抗氧化剂在生物体内的吸收代谢等情况,因为抗氧化剂须经过胃肠道的酸性环境以及多种酶的消化降解后才被机体吸收,到达靶向器官发挥作用。体内抗氧化活性评价法是指给人或动物注射或饲喂受试物,通过测定实验动物体内抗氧化酶活力及丙二醛等指标对受试物的抗氧化能力进行评价[98-99]。体内抗氧化活性评价结果准确,能够真实反映受试物在体内抗氧化能力的同时对受试物的毒理性质等进行评价,但实验周期长、成本高,不适合抗氧化剂前期大批量的测定[77]。

表3 部分发酵剂在发酵肉制品中的抗氧化性研究结果Table 3 Antioxidant effects of some starters in fermented meat products
目前,大量文献报道了发酵剂的抗氧化潜力,表3整理了近年来部分发酵肉制品中发酵剂的抗氧化活性研究结果。由于研究所采用的抗氧化测定方法不尽相同,使得各发酵剂菌株之间的抗氧化性能难以比较,但总地来说,发酵剂在发酵肉制品中的抗氧化能力评价方法以自由基清除实验、ABTS阳离子自由基清除实验、TBA实验、POV实验最为常见。各类发酵剂中乳酸菌的研究较多,葡萄球菌、微球菌、霉菌和酵母的抗氧化活性研究较少。随着对发酵剂抗氧化机制研究的逐渐深入,发酵剂在发酵肉制品中发挥抗氧化作用的生物活性物质有待明确,发酵剂在不同抗氧化实验中的抗氧化能力与其对发酵肉制品品质影响之间的相关关系尚待阐明。
3 抗氧化酶系
微生物的抗氧化活性一方面是菌体内阿魏酸、半胱氨酸等抗氧化活性成分造成的,另一方面细胞内抗氧化酶类也起到了至关重要的作用。常见的抗氧化酶主要有SOD、CAT以及GPx 3 类。

图3 各类抗氧化酶的反应方程[110-111]Fig.3 Reaction equations of antioxidant enzymes[110-111]
SOD可以快速催化高活性的超氧阴离子并歧化为O2和活性较弱的H2O2(图3),H2O2可以被CAT及GPx继续分解[111]。根据所携带金属离子的不同,SOD可以分为4 类:Cu/Zn-SOD、Mn-SOD、Fe-SOD和Ni-SOD。其中Cu/Zn-SOD在原始的生物类群中较为常见,存在于真核生物细胞质、周质空间及叶绿体中;Mn-SOD常见于原核生物及真核生物的线粒体内;Fe-SOD主要存在于少数植物和原核生物细胞内;Ni-SOD的研究较少,目前只发现在蓝细菌和链霉菌属中有存在[112]。Arasu等[113]研究发现具有良好H2O2耐受性和DPPH自由基清除能力的短乳杆菌P68具有SOD及GPx活力。Zuo Fanglei等[114]研究发现SOD和CAT的异源表达能够显著提升长双歧杆菌NCC2705对活性氧的耐受能力,此外这两种酶的共同表达在应对氧化应激时具有协同的有益作用。
CAT又称触酶、血红素酶,广泛存在于动物、植物和微生物中,是一种四聚体酶,由4 个相同四面体排列的亚基组成,每个亚基各有一个铁卟啉基。CAT能够催化H2O2分解成H2O和O2,此外CAT还具有过氧化物酶活力,可以和氢供体(甲醇、乙醇、甲酸或酚类)反应[111]。Lin Jinzhong等[115]发现异源表达的CAT有效提高了干酪乳杆菌对抗H2O2损伤的能力。酿酒酵母在铜离子胁迫导致的氧化应激下,其细胞内CAT和SOD的活力均有不同程度的提高[116]。
与CAT类似,GPx也是四聚体酶,4 个相同的亚基单位里每个亚基都含有一个硒半胱氨酸残基。GPx代谢是最基本的抗氧化防御代谢机制之一,通过还原性谷胱甘肽催化脂质过氧化物或H2O2还原,从而保护细胞免收氧化损伤[110]。蔡秋杏等[117]对分离自腌干鱼的乳酸菌抗氧化酶活力及其胞外多糖抗氧化能力进行了测定,发现抗氧化能力越强的菌株其抗氧化酶活力越高,其中综合抗氧化能力最强的干酪乳杆菌L21 SOD、GPx及CAT活力分别为(44.28±2.28)、(12.80±0.09)U/mg和(1.23±0.07)U/mg。
4 结 语
微生物对发酵肉制品的发酵成熟起到至关重要的作用,蛋白质和脂肪的氧化程度直接影响产品的最终品质。合适的发酵剂和添加剂能够促进氧化降解、缩短生产周期、控制氧化程度、抑制有害菌的生长繁殖。当前发酵剂在发酵肉制品中抗氧化性的研究主要集中于抗氧化微生物的筛选鉴定以及微生物应用于产品后理化指标和感官评价的表现,其中抗氧化菌种主要集中于乳酸菌,除乳酸菌外其他微生物的抗氧化机制还缺乏系统深入的研究。微生物抗氧化活性的评价和筛选方法根据反应环境的差异一般可分为体外实验、细胞实验和动物实验,不同的评价方法因其原理与操作的不同,在评价过程中受到很多限制,同时体外模拟环境与体内真实环境相比仍有较大差异,且菌株被机体摄入后,消化作用及菌体的自聚性和黏附性都会对微生物的抗氧化能力造成影响,微生物体外抗氧化活性与缓解体内氧化应激能力之间的关系尚不明确,缺乏一种能够综合评价微生物体外抗氧化活性并能真实反映其缓解体内氧化应激能力的方法。此外,还应关注脂肪与蛋白质的初级氧化和次级氧化、氧化过程中脂肪与蛋白质的相互作用、添加剂等对发酵肉制品品质的影响。我国是肉制品消费大国,发酵肉制品历史悠久、种类丰富、微生物资源繁多,应充分利用我国宝贵的微生物资源,结合现代基因工程、酶工程、细胞工程等先进技术,促进肉制品产业深化发展,为消费者提供优质美味的发酵产品。
