日粮添加乳酸菌对苏尼特羊生长、肉品质、风味物质和抗氧化能力的影响
2021-01-20巴吉木色杨致昊赵丽华田建军郭月英
窦 露,刘 畅,巴吉木色,杨致昊,苏 琳,赵丽华,田建军,郭月英,靳 烨,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古乌拉特中旗农牧和科技局,内蒙古 乌拉特中旗 015300)
羊肉的品质包括色泽、pH值和风味等,影响羊肉品质的因素主要包括品种、性别、饲养方式以及日粮组成[1]。随着禁牧政策的实施,通过日粮调控改善舍饲羊肉品质成为研究热点。乳酸菌(lactic acid bacteria,LAB)是一类利用可发酵碳水化合物产生大量乳酸的革兰氏阳性细菌的通称,其以无抗药性、无毒副作用等诸多优势成为益生菌饲粮的重要选择。乳酸菌可提高机体的抗氧化能力,减少PSE(pale, soft, exudative)肉的产生,并对风味的前体物质产生影响,乳酸菌及其代谢产物还可减少肠道中胺、硫化氢等有害代谢产物的生成,减轻畜禽肉的异味,从而改善肉品风味[2]。此外,乳酸菌在代谢过程中产生的大量有机酸不仅可以有效降低动物日粮的碱值,增加饲料的适口性和可消化率,而且可以减少肠道中有害微生物的繁殖,维持肠道动态平衡[3]。
李敏华在研究中发现,乳酸菌制剂不仅对猪饲料中钙、磷的表观消化率有促进作用,而且提高了肌肉嫩度、持水性以及上调了与肉质相关的脂肪酸结合蛋白和钙蛋白酶抑制蛋白基因的表达,具有从分子层面调控肉质的重要功能[4]。脂肪酸在羊肉风味形成中至关重要,但不饱和脂肪酸的氧化酸败是影响肉品风味的重要因素,由脂肪酸氧化产生的小分子物质(醛、醇、酮、烃)在适宜的范围内可对羊肉的风味产生积极作用;但过度氧化时会产生令人不愉悦的气味,影响羊肉的感官品质。邬理洋研究表明,乳酸菌能提高超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等的活性,这对保护细胞膜、防止风味物质的流失以及脂质的过度氧化有重要作用[5]。Lin Biaosheng等发现在猪饲粮中添加4%的益生菌可显著提高猪肉中的单不饱和脂肪酸和多不饱和脂肪酸含量,这表明饲喂益生菌对猪肉的风味有一定的改善作用[6]。有研究表明厚壁菌门和拟杆菌门的相对丰度能调控宿主对饮食的吸收以及脂质代谢作用,当益生菌进入动物肠道后,可通过改变厚壁菌门与拟杆菌门的比例,影响脂肪沉积[7]。Wang Hesong等在肉鸡饲粮中加入约氏乳杆菌后发现其肠道内细菌丰富度明显增加,厚壁菌门与拟杆菌门的比值显著降低,最终风味得到了改善[8]。本实验以不同饲养条件下(乳酸菌组和对照组)苏尼特羊为实验材料,旨在研究在日粮中添加乳酸菌对苏尼特羊生长性能、肉品质、挥发性风味物质及抗氧化能力的影响,为改善舍饲羊肉品质提供新的思路和方法。
1 材料与方法
1.1 动物、材料与试剂
3 月龄健康无病的纯种苏尼特羊,体质量(16.50±1.36)kg,取自内蒙古巴彦淖尔市乌拉特中旗。
复合微生态制剂(成分为乳酸杆菌Lactobacillus caseiHM-09、Lactobacillus plantarumHM-10,活菌数不低于1.5×109CFU/g) 内蒙古某公司;SOD试剂盒、过氧化氢酶(catalase,CAT)试剂盒、GPx试剂盒以及总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒 南京建成生物工程研究所;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐 美国Amresco公司;RNAiso Plus、TB GreenTMPremix ExTaqTMII、PrimeScriptTMRT Reagent Kit with gDNA Eraser试剂盒、SYBR®Premix ExTaqTM、Marker DL2000 大连宝生物工程有限公司。
1.2 仪器与设备
pH-STAR型胴体pH值直测仪 德国Matthaus公司;C-LM3B型数显式肌肉嫩度仪 东北农业大学;TC-P2A全自动测色色差计 上海生物生化实验仪器公司;Trace 1300、ISQ 型气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)仪 美国赛默飞世尔科技公司;固相微萃取装置 上海安谱实验科技股份有限公司;XHF-DY型高速分散器 宁波新芝生物科技股份有限公司;TU-1810型紫外分光光度计北京普析通用仪器有限公司;YNERGY H1型酶标仪美国Bio-Tek Instruments公司;LightCycler®96实时荧光定量聚合酶链式反应仪 罗氏诊断产品(上海)有限公司;凝胶成像分析系统 美国Bio-Rad 公司;BG-power 3500型稳定温流电泳仪、水平电泳槽 北京百晶生物技术有限公司。
1.3 方法
1.3.1 动物饲养与分组
3 月龄健康无病的纯种苏尼特羊共24 只,采用单因素随机试验设计,将苏尼特羊随机分为2 组:对照组(C)、乳酸菌组(L),每组12 只,公母各半。对照组的日粮以牧区饲草料为主,乳酸菌组的日粮是在对照组日粮的基础上添加200 g乳酸菌(添加量为生产厂家推荐剂量,1.5×109CFU/g),基础日粮配方见表1。实验羊舍为半开放式羊舍,温度、光照、通风等饲养环境条件一致。预实验期7 d,实验期3 个月。

表1 基础日粮组成Table 1 Composition of basal diet
1.3.2 实验样本采集
实验期结束后采用无菌一次性塑料勺取直肠粪便样品约5 g,用无菌取样袋封存后4 ℃冷藏,并及时运回实验室进行检测。实验动物在草原恒通食品有限公司进行屠宰,宰后迅速测定肉品质等相关指标,同时取背最长肌约2 g置于无菌无酶管于液氮中存放,并转移到实验室于-80 ℃冰箱中保存,用于抗氧化能力相关指标以及基因的测定;另取背最长肌100 g左右,在-20 ℃条件下冷冻,用于挥发性风味物质测定。
1.3.3 生长性能的测定
实验开始到实验结束期间每月对实验羊进行空腹称体质量,并进行记录。
1.3.4 肠道中乳酸菌和大肠杆菌的测定
在无菌条件下,取1 g粪便到灭菌离心管中,加入9 倍体积的生理盐水,混匀后梯度稀释,取1 mL稀释液接种到培养基后置于37 ℃恒温箱中培养(乳酸菌培养48 h,大肠杆菌培养24 h),最后进行菌落计数,菌群数量以每克粪便中所含细菌群落总数的对数(lg(CFU/g))表示[9]。
1.3.5 肉品质测定
羊屠宰后采用pH-STAR型胴体pH值直测仪分别测定pH45min、pH24h;采用TC-P2A全自动测色色差计测定色差(L*值、a*值、b*值);采用C-LM3B型数显式肌肉嫩度仪测定嫩度;称取约30~50 g的肉块,质量记为m1,密封后在水浴锅中85 ℃煮40 min,肉冷却后滤纸吸干表面水分,再次称质量,记为m2。熟肉率为m2和m1的比值。
1.3.6 挥发性成分提取
挥发性成分提取参照文献[10]的方法。在20 mL样品瓶中加入5 g肉糜,将老化的萃取头插入样品瓶,使石英纤维头暴露于样品上部空间,在60 ℃条件下吸附45 min后拔出,萃取头在气相色谱进样口,250 ℃解吸附4 min。
GC-MS条件:TR-5色谱柱(30 m×0.25 mm,0.25 μm);载气He;载气流速1.0 mL/min;传输线温度250 ℃;不分流进样;进样时间1 min;升温程序:40 ℃保持3 min,以4 ℃/min升温到150 ℃,保持1 min,再以5 ℃/min升温到200 ℃,最后以20 ℃/min升至230 ℃,保持5 min进样口温度250 ℃;质量扫描范围m/z30~400;溶剂延迟时间1.0 min。
1.3.7 挥发性风味物质定性与定量分析
质谱数据经与Meanlib、NIST Demo和Wiley Library数据库检索定性,将匹配度大于800作为鉴定依据,采用面积归一化法计算各物质相对含量。
1.3.8 关键风味物质确定
采用相对气味活度值(relative odor activity value,ROAV)法分析各挥发性物质对羊肉风味的贡献[11]。定义对样品风味贡献最大的风味物质ROAVstan=100,对其他风味物质的ROAVi按式(1)计算。
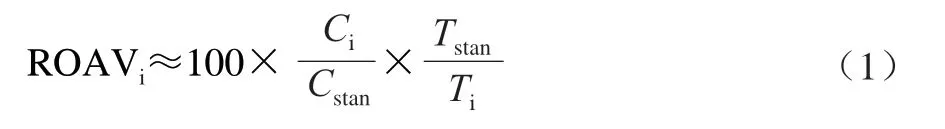
式中:Ci为各挥发性风味物质的相对含量/%;Ti为各挥发性风味物质的感觉阈值/(μg/kg);Cstan和Tstan分别为对样品风味贡献最大的挥发性风味物质的相对含量/%和感觉阈值/(μg/kg)。
1.3.9 抗氧化酶活力和T-AOC的测定
取0.5 g肉样于离心管中,加入9 倍体积的生理盐水,冰浴条件下匀浆30 s(3 000 r/min),然后离心10 min(4 ℃、4 000 r/min),取上清液,参照试剂盒说明书测定SOD、CAT、GPx活力以及T-AOC。
1.3.10 自由基清除率的测定
参照罗玉龙等的实验方法测定自由基清除率(radical scavenging ability,RSA)[12],以组织匀浆液为空白组,抑制率按式(2)计算。
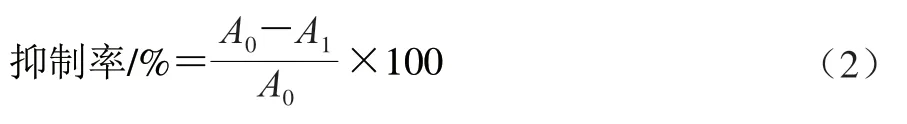
式中:A0为空白组吸光度;A1为样品组吸光度。
1.3.11 抗氧化酶相关调控基因表达量的测定
称取约100 mg的肉样参照参考文献[13]进行RNA的提取。对提取的RNA测定吸光度(A260nm/A280nm)及浓度后,用质量分数1.5%琼脂糖凝胶电泳检测提取的RNA质量,再将RNA样品稀释至500 ng/μL,参照反转录试剂盒两步法进行反转录,将得到的cDNA放入-20 ℃冰箱内保存。SOD、CAT、GPx由上海生工生物工程有限公司设计并合成,18S rRNA作为管家基因,引物序列如表2所示。
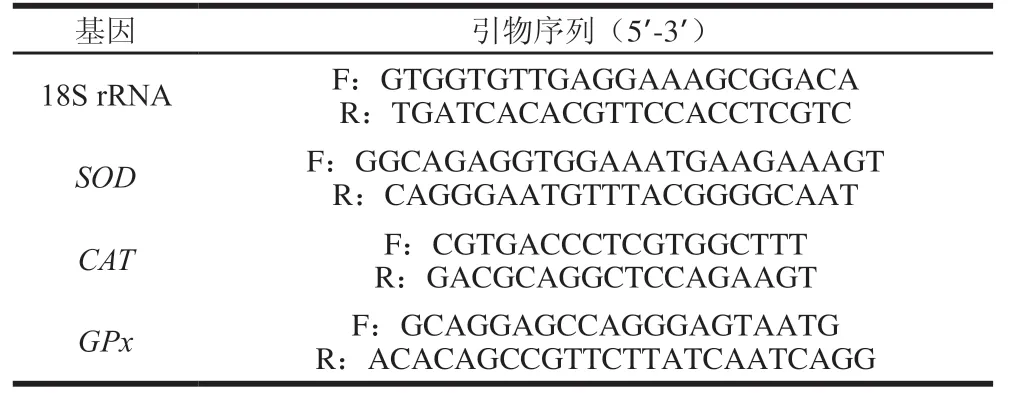
表2 实时定量荧光聚合酶链式反应引物Table 2 Primer sequences used for real-time polymerase chain reaction
1.4 数据统计分析
利用SPSS 22.0软件进行单因素方差分析,以P<0.05为显著性检验标准,所有数值均以平均值±标准差表示。
2 结果与分析
2.1 日粮添加乳酸菌对苏尼特羊肠道微生物数量的影响

表3 日粮添加乳酸菌对苏尼特羊肠道微生物数量的影响(n=12)Table 3 Effect of dietary lactic acid bacteria on intestinal microorganisms in Sunit sheep (n= 12)
动物肠道寄居着大量微生物,包括对动物机体有益的微生物(乳酸菌)以及有害的微生物(大肠杆菌),这些菌株间的数量组成被认为是评价动物肠道健康的重要指标。张乃锋等的研究结果表明在饲料中添加植物乳杆菌能够显著降低畜禽肠道中大肠杆菌数量,提高乳酸菌数量[14]。本实验的结果与其一致,如表3所示,日粮中添加乳酸菌的苏尼特羊肠道中乳酸菌的数量显著高于对照组(P<0.05),大肠杆菌的数量显著低于对照组(P<0.05),其原因可能是动物摄入乳酸菌后在肠道中大量定植,竞争性地争夺肠壁的定植位点。同时乳酸菌在生长繁殖过程中产生乳酸及某些抑菌因子,抑制了大肠杆菌的数量,平衡了消化道微生物区系[15],这为动物的生长发育带来积极影响。
2.2 日粮添加乳酸菌对苏尼特羊生长性能的影响

表4 日粮添加乳酸菌对苏尼特羊生长性能的影响(n=12)Table 4 Effect of dietary lactic acid bacteria on growth performance of Sunit sheep (n= 12)
如表4所示,在日粮中添加乳酸菌饲喂苏尼特羊90 d后,发现乳酸菌组的平均日增体质量显著高于对照组(P<0.05),这表明在饲粮中添加乳酸菌可提高肉羊的生长性能。Bayatkouhsar等的实验证明在日粮中添加乳酸杆菌可显著提高犊牛的采食量和平均日增体质量[16]。研究表明乳酸菌可产生黏附素定植于肠黏膜表面,这一过程使得动物胃肠道菌群处于动态平衡,此外乳酸菌在厌氧环境中可产生淀粉酶、脂肪酶和蛋白酶等,这些消化酶有助于畜禽对营养物质的吸收,从而提高饲料的消化吸收率[17-18]。
2.3 日粮添加乳酸菌对苏尼特羊肉品质的影响

表5 日粮添加乳酸菌对苏尼特羊肉品质的影响(n=12)Table 5 Effect of dietary lactic acid bacteria on meat quality of Sunit sheep (n= 12)
由表5可知,乳酸菌组的初始pH值与对照组无统计学差异(P>0.05),经排酸24 h后对照组的pH24显著高于乳酸菌组(P<0.05)。对照组的剪切力显著高于乳酸菌组(P<0.05),说明日粮添加乳酸菌可改善苏尼特羊肉的嫩度,使其更柔嫩多汁。这可能与乳酸菌参与机体脂肪代谢有关,乳酸菌可影响动物的脂肪代谢,使脂肪沉积在肌肉的内肌束膜中,进而使结缔组织松散,最终提高了肌肉的嫩度[19]。对照组与乳酸菌组的熟肉率无显著差异(P>0.05)。肉色是肌肉外观评定的重要指标,可以看出,乳酸菌组a*值高于对照组,L*值低于对照组,但差异不显著(P>0.05),乳酸菌组的b*值显著低于对照组(P<0.05),这表明乳酸菌对改善肉色有积极作用。肌肉组织的氧化导致高铁肌红蛋白的生成,进而使肉色变差,而乳酸菌恰恰能够阻碍该氧化进程从而改善肉色。综上,乳酸菌可能通过影响肠道中益生菌的数量、消化酶的水解活性以及与肉质相关的糖酵解酶和原肌球蛋白的表达[20],进而影响畜禽对营养物质的消化吸收,最终改善肉品质。
2.4 日粮添加乳酸菌对苏尼特羊挥发性风味物质的影响
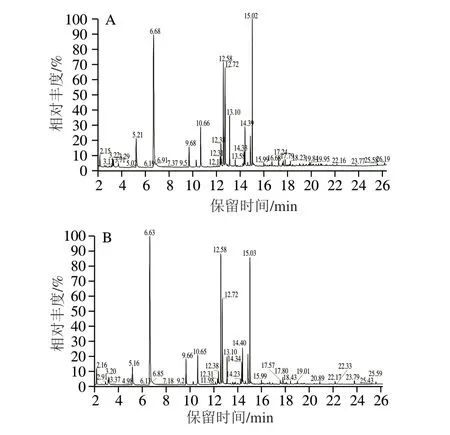
图1 苏尼特羊肉的挥发性风味物质色谱图Fig.1 Chromatogram of volatile flavor components in meat of Sunit lambs under two feeding conditions
羊肉中的挥发性风味物质是评价肉品质的重要指标之一,它是前体物质经脂质氧化和美拉德反应产生的多种化合物共同作用形成的[10]。据报道,羊肉的部分风味物质来源于菌群的代谢产物,由畜禽吸收并进一步沉积到肌肉中[21]。如图1、表6所示,本实验共检测出38 种风味物质,其中,醛类物质13 种,主要物质为己醛、庚醛和壬醛等;醇类13 种,包括1-戊醇、正己醇、庚醇等;烃类5 种,其中丁烷是最具代表性的物质;酮类3 种,其他物质4 种。两组羊肉中,乳酸菌组中风味物质有29 种,对照组中为26 种,这表明日粮添加乳酸菌丰富了风味物质的种类。Wang Yan等在日粮中添加益生菌后发现,与对照组相比,益生菌组中风味物质的种类明显增加[22]。

表6 日粮添加乳酸菌对苏尼特羊肉挥发性风味物质的影响(n=12)Table 6 Effect of dietary lactic acid bacteria on volatile flavor components in Sunit lamb meat (n= 12)
阈值的高低决定了香味的浓郁程度,只有气味阈值低的挥发性成分才能对风味做出直接贡献[10]。通过挥发性成分的相对含量及阈值判断,癸醛在苏尼特羊肉中相对含量较高,且阈值为1 μg/kg,对苏尼特羊肉的风味贡献最大,因此定义癸醛为两组羊肉的关键风味物质(ROAVstan=100)。当ROAV≥1时,此挥发性成分为羊肉的关键风味物质;当0.1≤ROAV<1时,则对羊肉总体风味有重要修饰作用[23]。根据挥发性物质的ROAV共筛选出19 种关键风味物质,其结果如表7所示。
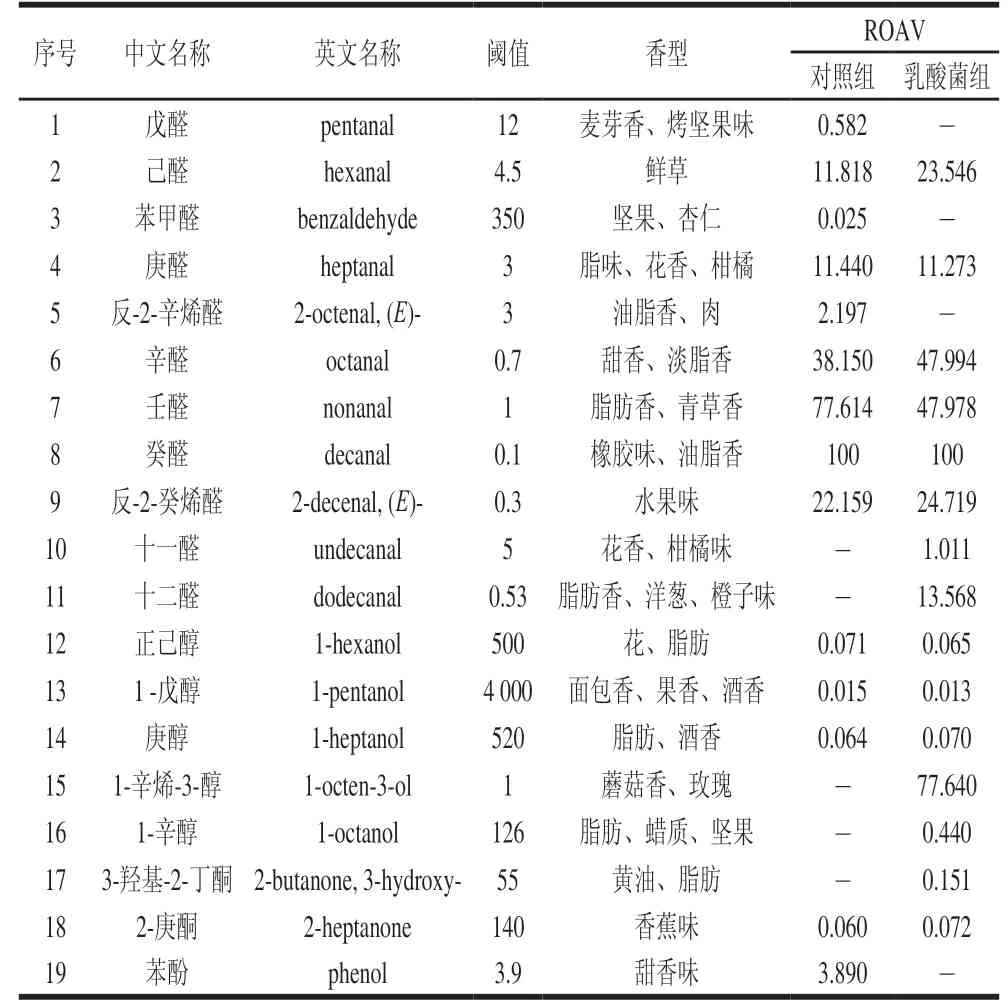
表7 关键风味物质及对应ROAV(n=12)Table 7 ROAV of critical volatile flavor substances in Sunit lamb meat (n= 12)
醛类物质主要来源于脂肪酸的氧化降解,其阈值较低,对风味形成具有重要作用。己醛是不饱和脂肪酸的氧化产物,可作为两组羊肉的关键风味物质(ROAV>1),赋予羊肉独特的青草味。庚醛、辛醛和壬醛在两组羊肉的风味中均是关键物质(ROAV>1),为羊肉提供脂香、花香和青草气息。由表6可知,对照组庚醛、辛醛和壬醛的含量显著高于乳酸菌组(P<0.05),其原因可能是日粮中添加乳酸菌提高了苏尼特羊的抗氧化能力,从而降低了不饱和脂肪酸的氧化程度。罗玉龙的研究结果表明当动物机体抗氧化能力较高时,其脂质氧化的产物庚醛、壬醛等含量明显较低[12],这与本实验的研究结果相符。戊醛可对对照组羊肉起到修饰作用(0.1<ROAV<1),而反-2-辛烯醛是对照组羊肉的关键风味物质(ROAV≥1),但在乳酸菌组中未检测到。癸醛的阈值较低,是苏尼特羊肉中风味贡献度最大的物质(ROAV=100),由表6可知,对照组的相对含量显著高于乳酸菌组(P<0.05),这表明对照组羊肉有更浓的油脂味。这也说明饲粮中加入乳酸菌能有效抑制肉质氧化。反-2-癸烯醛呈现清新的水果气息,为苏尼特羊肉带来独特风味,两组羊肉中反-2-癸烯醛的ROAV都大于1,是具有重要修饰作用的风味物质。十一醛(花香、柑橘味)和十二醛(脂肪香、洋葱、橙子味)仅在乳酸菌组中检测到,说明日粮添加乳酸菌丰富了羊肉的风味物质种类,使羊肉的风味更协调。
醇类主要由肌肉中的共轭亚油酸被脂肪氧合酶和氢过氧化酶降解产生[24]。醇类阈值较高,对肉香的贡献不如醛类,但也会左右风味的形成。正己醇、1-戊醇和庚醇对羊肉风味无明显贡献作用。1-辛醇和1-辛烯-3-醇仅在乳酸菌组中检测到,前者提升了羊肉的坚果和黄油味,后者是亚油酸和花生四烯酸的氧化产物[25],在乳酸菌组中是关键风味物质(ROAV>1),其ROAV达到77以上,赋予羊肉浓郁的蘑菇香和玫瑰气味。
酮类化合物是脂肪氧化的另一种产物,由不饱和脂肪酸氧化产生[26]。酮类对风味的贡献要小于醛类和醇类,但对羊肉的风味形成具有不可替代的作用。二酮类化合物是美拉德反应最初阶段的产物,能为肉制品提供肉香和黄油香;3-羟基-2-丁酮对乳酸菌组羊肉具有重要修饰作用(0.1<ROAV<1)。
烃类可分为烷烃和芳香烃,对肉的风味贡献较小,但对肉的香味起到加和作用,其中有香味的烃为脂质热降解产生,也可在烷基自由基的脂质氧化或类胡萝卜素的分解中生成[27]。苯酚呈现甜香气味,仅在对照组中可检测到,且是对照组的关键风味物质(ROAV>1)。
总体上,在苏尼特羊饲粮中添加乳酸菌可改善羊肉风味的种类和相对含量。对照组羊肉的特征风味为油脂、青草和甜香气味;乳酸菌组为鲜草、柑橘、洋葱、玫瑰、花香、淡脂香和蘑菇香,因此日粮添加乳酸菌组赋予了羊肉洋葱、橙子、玫瑰和蘑菇气味。
2.5 日粮添加乳酸菌对苏尼特羊肉抗氧化能力的影响
动物机体抗氧化系统是保护自身免受氧化损伤的重要体系,与生物体的免疫力密切相关,包括酶系统和非酶系统[28]。其中SOD、CAT和GPx是肉中抗氧化酶系统的重要组成[29],T-AOC是反映机体抗氧化能力的综合指标,RSA则可反映肌肉抗氧系统对自由基的清除能力。

表8 日粮添加乳酸菌对苏尼特羊肉抗氧化能力的影响(n=12)Table 8 Effect of dietary lactic acid bacteria on antioxidant properties of Sunit lamb meat (n= 12)
机体抗氧化酶会呈现发育性变化,但可能受到饲养方式、日粮组成等因素影响[30]。由表8可知,本实验中乳酸菌组CAT活力和T-AOC显著高于对照组(P<0.05),GPx活力高于对照组,但差异不显著(P>0.05)。SOD活力和RSA在两组间无统计学差异(P>0.05),整体上,乳酸菌组羊肉的抗氧化能力高于对照组。耿正颖等在猪日粮中添加丁酸梭菌后发现GPx活力和T-AOC较对照组显著提高[31]。高畅的研究结果显示日粮中添加乳酸菌可显著提高育肥猪的SOD、GPx活力以及T-AOC[32]。这可能与乳酸菌的抗氧化能力有关:一方面,乳酸菌可通过清除自由基、螯合金属离子而起到抗氧化作用;另一方面,乳酸菌在畜禽肠道内停留时会通过代谢反应向细胞壁外分泌胞外多糖和生物活性肽等物质,这些代谢产物会发挥抗氧化作用,抑制脂质自由基连锁反应的发生[33]。因此,日粮添加乳酸菌可提高肌肉的抗氧化能力,从而抑制脂质的过度氧化,减少不良风味的产生,延长羊肉的货架期。
2.6 日粮添加乳酸菌对苏尼特羊抗氧化酶相关调控基因表达量的影响

表9 日粮添加乳酸菌对苏尼特羊肉抗氧化酶相关调控基因表达量的影响(n=12)Table 9 Effect of dietary lactic acid bacteria on the expression of antioxidant enzyme genes in Sunit lamb meat (n= 12)
在动物组织内SOD、CAT和GPx基因与肌肉的抗氧化能力相关,可反映肌肉的抗氧化能力。由表9可知,在两种饲养条件下,抗氧化酶基因均有表达,其中乳酸菌组的CAT、GPx基因表达量显著高于对照组(P<0.05)。乳酸菌被畜禽吸收后使得体内的CAT、GPx基因表达较活跃,进而调控CAT、GPx的活力,及时清除机体产生的自由基以及脂质氧化产物。抗氧化酶活性与基因编码调控之间存在一种作用机制,使得酶活性和基因表达量的变化趋势一致。由表8可知,乳酸菌组CAT、GPx活力显著高于对照组(P<0.05),这也从分子水平印证了乳酸菌组的抗氧化酶活性较对照组好。罗玉龙[12]和Vahedi[34]等的实验均证明肉中的抗氧化酶基因能够调控酶活力,从而影响机体的抗氧化能力,并在一定程度上影响羊肉的风味和肉品质。因此,在舍饲羊饲料中加入乳酸菌可提高肌肉的抗氧化能力,进而有效抑制羊肉氧化,平衡羊肉风味。
3 结 论
日粮添加乳酸菌可改善苏尼特羊肠道菌群、提高生长性能及嫩度,并对肉色改善有积极作用。将乳酸菌添加到日粮中可丰富羊肉中挥发性风味物质的种类,对照组的脂质氧化产物辛醛、壬醛、癸醛、1-戊醇、正己醇、庚醇相对含量显著高于乳酸菌组,说明乳酸菌可通过抗氧化作用抑制脂质过度氧化。实验筛选出乳酸菌组的特征风味为鲜草、柑橘、洋葱、玫瑰、花香、淡脂香和蘑菇香,对照组为油脂、青草和甜香气味,表明日粮添加乳酸菌增添了羊肉洋葱、柑橘、玫瑰和蘑菇气味。乳酸菌可提高苏尼特羊肉中CAT、GPx活力和T-AOC,通过抗氧化酶相关调控基因得出乳酸菌组CAT和GPx基因的表达量高于对照组,从分子水平证实了乳酸菌组的抗氧化能力较对照组的高。目前为了适应草原畜牧业持续发展,通过日粮调控改善羊肉品质已成为研究热点,因此可将日粮添乳酸菌作为改善肉品品质的重要途径。
