酸胁迫处理对鼠伤寒沙门氏菌抗酸性的影响
2021-01-20李琳琼张爱静王鹏杰高瑀珑
李琳琼,洪 静,张爱静,王鹏杰,高瑀珑
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
沙门氏菌是一种常见的食源性致病菌,在自然界分布广泛、种类繁多,几乎所有的血清型沙门氏菌都具有致病性,在全球范围内,由其引起的细菌性食物中毒常居食源性疾病首位[1-2]。沙门氏菌不仅威胁到人类健康,而且给食品制造业带来巨大损失[3-5]。沙门氏菌广泛寄生于动物肠道内,常常存在于新鲜的家禽肉和猪肉等肉制品中,能引起败血症和肠胃炎。在食品生产、贮藏、运输和销售过程中,沙门氏菌常遭受极端的酸、碱、渗透压、温度、压力以及抗菌剂等不适生长条件的胁迫作用,诱发其产生一系列的适应性来应对变化的环境条件,这种适应性包含同源性保护作用和交叉性保护作用[6-7]:如李斯特菌经某种不利生存的因素长时间胁迫后,其生存能力增强,这种现象被Hill等[8]称为同源性保护作用;沙门氏菌遭受某种不利生存的环境胁迫后,之后在其他不利环境条件下其生存能力增强,这种现象被He Shoukui等[9]称为交叉性保护作用。这些应激反应(适应性反应)均有助于菌体的损伤修复,能够增强其抵抗后续应激作用的能力。
环境胁迫是指环境因素接近或超过生物体、种群或群落的忍耐极限时造成的胁迫作用[10]。酸对微生物的胁迫作用一直是生物学领域研究的热点,而微生物的抗酸性受其种类、生长阶段和环境因素的影响[11]。在食品生产加工的过程中,微生物常遭受各种不适环境条件的胁迫,诱导出一系列自我保护机制,导致其对致死因素的抗性增加。其中,pH值是引起细菌细胞组成和生理变化的一个重要因素[12]。
在食品保藏过程中,有许多关于采用有机酸来控制、杀灭食源致病菌的研究报道,例如采用一定浓度的有机酸对鲜肉和蔬果等进行喷淋、浸泡等处理来杀灭其中的致病菌[13-14]。Foster等[15]首次提出诱导性耐酸应答的概念,认为在酸胁迫条件下处于亚致死状态的细菌经过损伤修复之后,其生存能力会明显增强。Zhang Yimin等[16]将单核增生李斯特菌置于添加了乳酸、醋酸和乙酰丙酸酸化的培养基中,发现其生长至稳定期后,再经过一定致死条件的胆盐和酸处理后,其灭活率低于原野生对照菌株,说明单核增生李斯特菌经过酸处理后产生了抗酸性。Cebrián等[17]通过对金黄色葡萄球菌进行亚致死浓度的酸、碱、热和H2O2处理后,发现其对这些胁迫因子的抗性与原野生对照菌株相比显著增加。Martine等[18]研究发现,大肠杆菌受到酸性环境的胁迫作用后,其生理状态会发生相应的变化,其中调控因子基因RpoS表达量上调并产生一定量的酸修复蛋白。但对于鼠伤寒沙门氏菌(Salmonella typhimurium)经不同种类和不同pH值的有机酸胁迫后,是否可诱导其产生抗酸性和同源性保护作用,目前尚不清楚。
食品中微生物在不适环境条件下的生长和失活可通过建立微生物预测模型来对其进行预测,为食品中微生物的控制提供科学的理论依据[19]。常用来描述微生物生长和失活的动力学模型有Linear模型[20]、Logistic模型[21]、Gompertz模型[22]、Baranyi模型[23]和Weibull模型[24]等。Linear模型操作简便,但对数据预测的精确度不高;Logistic模型是数学中用来描述某一普通笛卡尔平面上S型曲线的模型,有人也将其用来研究细菌生长曲线,但因其不能拟合细菌延滞期的生长变化,所以不能完整地显示S型曲线;Gompertz模型和Baranyi模型克服了这些缺点;Baranyi模型中的参数生物学意义更明确,能够较好地描述微生物的生长曲线,目前应用较多。Juneja等[25]使用Baranyi模型、修正Gompertz模型和Huang模型等分别建立了蜡样芽孢杆菌在四季豆中的一级生长模型,发现Baranyi模型为其最适生长模型;Weibull模型在材料工业中常用于对脆性材料强度的寿命预测,也可用于研究不同实验条件对细菌失活的影响,适用于热力杀菌[26]和非热力杀菌[27]条件下细菌失活模型的拟合。张爱静等[28]发现采用Weibull模型能较好地拟合经多次热胁迫后产生抗性的大肠杆菌在80 ℃下的热失活曲线。
本实验采用食品工业中常用的具有较强杀菌能力的柠檬酸、乙酸、乳酸和苹果酸等有机酸处理S.typhimurium,借助Weibull模型研究经不同有机酸诱导后其抗酸性的变化,以期为有机酸杀菌技术的广泛应用提供理论参考,对保障食品加工贮藏安全、有效控制食源性致病菌、建立食品质量安全控制体系具有重要意义。
1 材料与方法
1.1 菌株、材料与试剂
鼠伤寒沙门氏菌(S.typhimurium)CGMCC 1.1190购于中国普通微生物菌种保藏管理中心。
胰蛋白胨大豆琼脂(trypticase soy agar,TSA)培养基、胰蛋白胨大豆肉汤(trypticase soy broth,TSB)液体培养基、柠檬酸、乙酸、乳酸、苹果酸、盐酸、氯化钠(均为分析纯) 南京丁贝生物科技有限公司。
1.2 仪器与设备
LDZX-50FBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;GNP-9160型隔水式恒温培养箱、SF-CF-2A型超净工作台 上海三发科学仪器有限公司;PHS-3G型pH计 上海仪电科学仪器股份有限公司;HZQ-F160型恒温振荡培养箱 太仓市实验设备厂;ME55型精密电子天平 北京塞多斯天平有限公司;SK-1型快速混匀器金坛市杰瑞尔电器有限公司;A1正置荧光显微镜 德国蔡司公司。
1.3 方法
1.3.1 菌种活化与预处理
供试菌经活化后,接入pH 7.2的TSB培养基,于37 ℃、150 r/min摇床振荡培养24 h,后续作为对照组,备用。
1.3.2 CGMCC 1.1190抗酸菌株的获得
不同pH值TSB培养基的配制:分别用浓度0.05 mol/L柠檬酸(pH 2.2)、1 mol/L醋酸(pH 2.4)、1.7 mol/L乳酸(pH 2.5)、0.07 mol/L苹果酸(pH 2.4)调节TSB培养基的pH值,得到12 种pH值分别为6.2、5.2和4.2的TSB培养基,121 ℃、20 min灭菌,冷藏备用。强酸基质培养基的配制:用浓度1 mol/L HCl溶液调节TSB培养基至pH 2.5,灭菌备用。
酸胁迫处理:将材料中经活化的CGMCC 1.1190菌悬液以体积分数1%转接至上述12 种不同pH值的TSB培养基中,摇床振荡培养(37 ℃、150 r/min)。对不同pH值的TSB培养基中CGMCC 1.1190菌株定期取样进行菌落计数,不同pH值TSB培养基选取不同时间间隔进行取样,时间间隔的选取根据CGMCC 1.1190菌株在不同pH值TSB培养基中的生长情况决定,其生长情况通过分光光度计测定的光密度确定。按文献[29]的方法使用TSA平板计数法进行菌落计数。不同pH值的TSB培养基中CGMCC 1.1190菌株的生长量通过计算每毫升TSB培养基中活菌的数量(CFU/mL)确定,以(lg(CFU/mL))表示。
抗酸菌株的获得:取1.3.1节中pH 7.2的TSB培养基与上述12 种pH值分别为6.2、5.2、4.2的TSB培养基中培养至稳定期的CGMCC 1.1190菌株培养液10 mL混合,离心(4 ℃、5 000 r/min,10 min),弃上清液,收集的沉淀用质量分数0.85%无菌生理盐水洗涤两次,再以等体积的生理盐水制成菌悬液,分装于无菌离心管,备用。
1.3.3 生长模型的建立
采用Baranyi模型拟合CGMCC 1.1190菌株在不同种类、不同pH值的酸胁迫环境下的生长曲线,建立CGMCC 1.1190菌株在不同pH值的TSB培养基中生长的一级模型,菌株的生长量参照公式(1)计算。
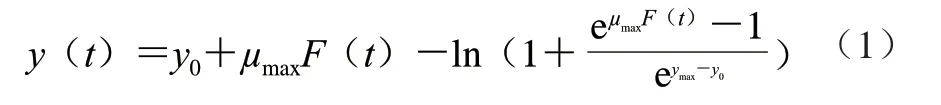
式中:t为培养时间/h;y(t)为t时刻CGMCC 1.1190菌株的生长量(lg(CFU/mL));y0为t=0时CGMCC 1.1190菌株初始菌数的对数(lg(CFU/mL));ymax为菌体最大生长量的对数(lg(CFU/mL));μmax为最大比生长速率/h-1;F(t)为调整函数,表示CGMCC 1.1190菌株在生长过程中,从迟滞期到对数期的过渡时期(调整生理状况和对新环境的适应期)所对应的生长迟滞时间。
F(t)按照公式(2)、(3)计算。
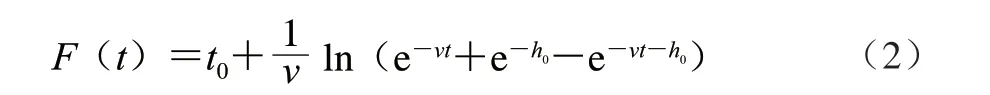
式中:v为菌体在生长过程中的增长速率/h-1,相当于μmax;h0为菌体的初始生理状态参数,用来描述其适应新环境的能力。

式中:λ为迟滞时间/h。
1.3.4 生长模型的验证
生长模型的验证采用决定系数R2、准确因子Af和偏差因子Bf。其中,R2表示模型的精确度和可靠性,R2越接近1,模型的拟合度越高;Af是衡量预测值与实测值之间的接近程度,Af越接近1,模型的拟合度越好、越精确;Bf>1表示模型预测值比实测值高,Bf<1表示模型预测值比实测值低,Bf越接近1,模型拟合度越高[30]。
CGMCC 1.1190菌株在经柠檬酸、乳酸、醋酸和苹果酸调节pH值分别至6.2、5.2和4.2的TSB培养基中生长,在每种pH值条件下,在不同于模型建立的时间点进行取样验证,每次实验重复3 次。R2、Af和Bf分别按照公式(4)~(6)计算。

式中:n为测定值的个数。
1.3.5 CGMCC 1.1190菌株抗酸性的测定
利用Weibull模型来拟合CGMCC 1.1190菌株在pH 2.5的TSB培养基中的酸致死曲线,Weibull模型的规模参数δ/min和形态参数ρ按公式(7)计算。

式中:N0为初始CGMCC 1.1190菌数量;Nt为酸处理t时刻后存活的CGMCC 1.1190菌数量;t为酸处理时间/min。
将1.3.1节中制备的对照组和酸胁迫CGMCC 1.1190菌株生理盐水的菌悬液分别离心(4 ℃、5 000 r/min,10 min),弃上清液,重悬于10 mL的pH 2.5 TSB培养基中进行酸处理,每隔10 min取样,于TSA培养基37 ℃培养72 h后,进行菌落计数,其存活率按公式(7)计算。利用Weibull模型对酸胁迫培养的CGMCC 1.1190菌株在pH 2.5的TSB培养基中的酸致死曲线进行非线性拟合。
1.3.6 菌体形态的观察
对1.3.1 节p H 7.2 的T S B 培 养 基 中 培 养 的CGMCC 1.1190原始对照菌种和分别经pH 6.2、5.2和p H 4.2 的柠檬酸胁迫培养至稳定期获得的3 种CGMCC 1.1190抗酸性菌株,在TSA培养基培养48 h后,以无菌接种环挑取单菌落,用结晶紫和碘液简单染色,显微镜观察CGMCC 1.1190菌株的个体形态。
1.4 数据处理与分析
实验数据通过DMFit(www.combase.cc)软件和JMP 10.0软件进行模型拟合,采用SPSS 22.0软件进行数据处理,实验数据以平均值±标准差表示,差异性显著分析采用Duncan's新复极差法,P<0.05表示差异显著。
2 结果与分析
2.1 CGMCC 1.1190菌株在不同pH值TSB培养基中的生长曲线
CGMCC 1.1190菌株在pH值分别为6.2、5.2和4.2 TSB培养基中的Baranyi模型生长曲线及其失活情况见图1。
除了经乳酸、醋酸和苹果酸调节的pH 4.2的TSB培养基外,CGMCC 1.1190菌株在其他几种不同pH值TSB培养基中的生长量皆均匀地分布在生长曲线两侧,说明利用Baranyi模型能很好地拟合CGMCC 1.1190菌株在pH 7.2和有机酸酸化处理后不同pH值TSB培养基中的生长曲线,CGMCC 1.1190菌株的生长曲线均呈S型,拟合度较高(R2>0.995),都有典型的延滞期、对数期和稳定期,pH值越低,迟滞期越长。在pH 4.2柠檬酸酸化处理的TSB培养基中,CGMCC 1.1190菌株的生长也呈典型的S型生长曲线;而在经乳酸、醋酸和苹果酸3 种有机酸酸化处理pH 4.2的TSB培养基中,随着培养时间的延长,CGMCC 1.1190菌体数量快速降低,分别在12、10 h和8 h后低于检测限,推断其在经乳酸、醋酸和苹果酸3 种有机酸酸化处理pH 4.2的TSB培养基中不生长并开始失活。与醋酸、乳酸和苹果酸相比,CGMCC 1.1190菌株在柠檬酸酸化的TSB培养基中的生存能力较强,对柠檬酸的耐受性、抗酸性作用最强。
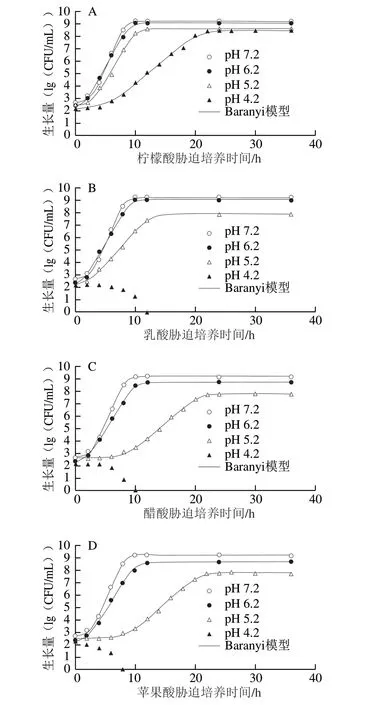
图1 S.typhimurium CGMCC 1.1190菌株在不同pH值TSB培养基中的生长曲线及其失活情况Fig.1 Growth curves and inactivation of S.typhimurium CGMCC 1.1190 in TSB acidified at different pH
在不同pH值的TSB培养基中,CGMCC 1.1190菌株生长的一级Baranyi模型曲线的参数估计值见表1。
Baranyi模型是近年来运用广泛的一种微生物模型[31],其既表达了微生物生长量与时间的关系,也较为准确地评估微生物λ、μmax及ymax等生长参数[32]。微生物生长的迟滞期是指微生物接种到新的培养基后,由于要适应新环境,微生物数目不会发生变化的一段时间。由表1可知,在CGMCC 1.1190菌株的生长曲线中,对于同一种有机酸酸化处理的TSB培养基,pH值越低,λ越长。CGMCC 1.1190菌株生长的迟滞时间与有机酸种类有关,在pH 4.2柠檬酸酸化处理的TSB培养基中,CGMCC 1.1190菌株的生长有典型的S型生长曲线(图1A),λ为5.32 h,而在经乳酸、醋酸和苹果酸酸化处理的pH 4.2的TSB培养基中,随着时间的延长,CGMCC 1.1190菌株的数量明显降低,表现为不生长、被抑制而失活,可能是因为CGMCC 1.1190菌体的核酸、蛋白质、细胞膜等的生物大分子物质对这3 种酸较敏感,在酸胁迫下发生了变性,细胞的生理代谢功能急剧下降,造成菌体死亡。说明CGMCC 1.1190菌株抗酸性的强弱与有机酸的种类有关,其对柠檬酸的抗性大于乳酸、醋酸和苹果酸。
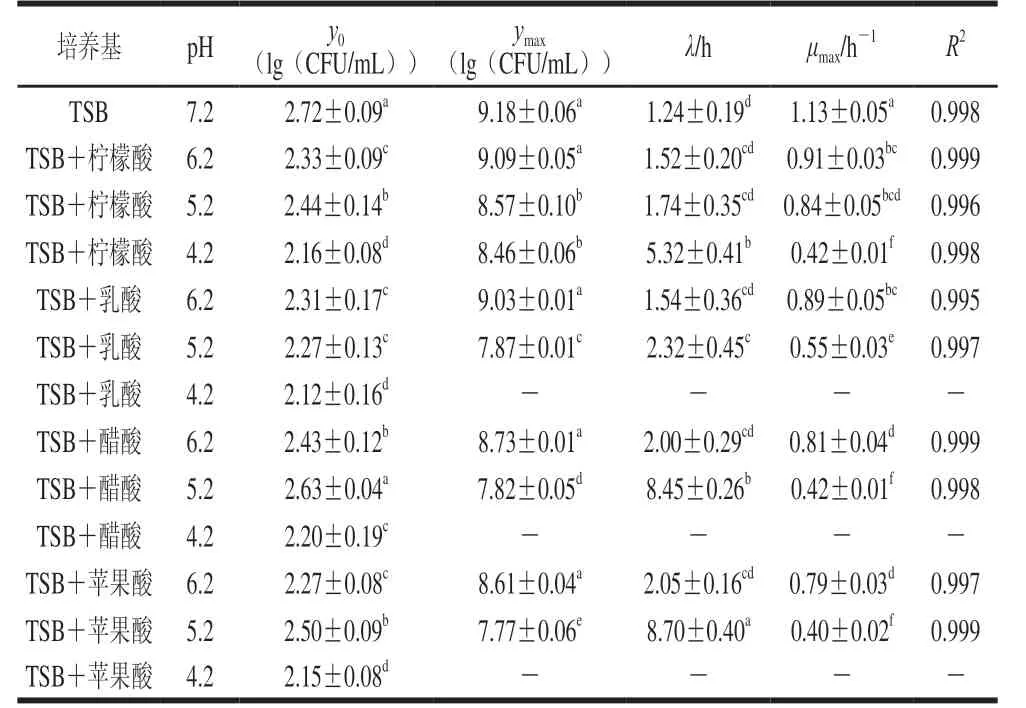
表1 S.typhimurium CGMCC 1.1190菌株生长的一级Baranyi模型曲线的参数估计值Table 1 Parameter estimates of Baranyi primary model for the growth of S.typhimurium CGMCC 1.1190
在经pH 5.2的乳酸、醋酸和苹果酸酸化处理的TSB培养基中,CGMCC 1.1190菌株生长的λ分别为2.32、8.45 h和8.70 h,皆明显长于经柠檬酸酸化处理pH 5.2的TSB培养基中λ(1.7 h);在经醋酸和苹果酸酸化处理的pH 6.2的TSB培养基中,λ分别为2.00 h和2.05 h,明显长于在经柠檬酸酸化处理的pH 6.2的TSB培养基中的λ(1.5 h)。研究结果表明,在相同pH值条件下,CGMCC 1.1190菌株对柠檬酸产生的抗性最强。
由图1 与表1 可知, 不同有机酸胁迫培养CGMCC 1.1190菌株的对数期差异显著(P<0.05),在经pH 5.2柠檬酸酸化处理后,CGMCC 1.1190菌株生长的对数期约为8 h,在经pH 5.2的乳酸、醋酸和苹果酸酸化处理后,对数期分别为10、16 h和16 h,表明CGMCC 1.1190菌株在不同种类的酸胁迫下的生长速率不同,柠檬酸胁迫生长速率最快,醋酸和苹果酸胁迫生长速率最慢;CGMCC 1.1190菌株的μmax也反映了菌体生长过程中对不适环境抵抗能力的强弱,μmax越大,抵抗能力越强,在pH 5.2的柠檬酸、乳酸、醋酸和苹果酸酸化处理的TSB培养基中,μmax分别为0.84、0.55、0.42 h-1和0.40 h-1,说明CGMCC 1.1190菌株对这4 种酸的抵抗能力依次减小,其中,经柠檬酸酸化处理的TSB培养基中μmax显著大于在其他3 种酸化处理的μmax(P<0.05),也说明同一pH值下CGMCC 1.1190菌株在柠檬酸酸化处理的TSB培养基中抗性最强。
在4 种酸胁迫条件下,y0在2.12~2.72(lg(CFU/mL))之间,彼此相差小于1(lg(CFU/mL))。进入稳定期后,在pH 7.2和4 种有机酸调节至pH 6.2的TSB培养基中ymax均可达到108~109CFU/mL,无显著性差异(P>0.05),表明在pH 6.2时,CGMCC 1.1190菌株生长所能达到的最大菌浓度并不受有机酸种类的影响。在以4 种酸分别调节至pH 5.2的TSB培养基中,CGMCC 1.1190菌株的ymax分别为8.57、7.87、7.82、7.77(lg(CFU/mL)),呈显著降低趋势(P<0.05);当柠檬酸调节pH 4.2时,ymax为8.46(lg(CFU/mL)),显著高于在经乳酸、醋酸和苹果酸酸化处理pH 5.2 TSB培养基中的ymax(P<0.05)。结果表明,CGMCC 1.1190菌株抗酸性大小与有机酸的种类相关,其中柠檬酸>乳酸>醋酸>苹果酸。
2.2 一级Baranyi生长模型的验证结果
CGMCC 1.1190菌株一级Baranyi模型的验证结果见表2。对CGMCC 1.1190菌株生长的实测值及一级模型的预测值进行相关性分析,决定系数R2=0.999 7、Af=1.008 3、Bf=1.005 3,表明本实验建立的Baranyi模型拟合效果好,且有效、可靠,可以利用Baranyi模型对酸胁迫培养的CGMCC 1.1190菌株的生长情况进行预测。

表2 S.typhimurium CGMCC 1.1190菌株生长一级Baranyi模型的验证Table 2 Validation of Baranyi model for S.typhimurium CGMCC 1.1190
2.3 抗酸性菌株在pH 2.5 TSB培养基中的酸致死Weibull模型曲线
1.3.2 节中经柠檬酸、乳酸、醋酸和苹果酸4 种有机酸调节pH值分别至6.2、5.2的TSB培养基中胁迫培养获得的8 种抗酸性CGMCC 1.1190菌株与pH 7.2的TSB培养基中培养的对照组CGMCC 1.1190菌株,在pH 2.5 TSB培养基中的酸致死曲线分别见图2、3。
由图2 可知,采用W e i b u l l 模型能较好地拟合CGMCC 1.1190菌株经4 种有机酸胁迫培养后获得的抗酸菌株(pH 6.2)在pH 2.5 TSB培养基中的失活曲线,拟合程度较高(R2>0.991 0)。CGMCC 1.1190菌株经酸胁迫培养后,再置于pH 2.5的强酸性环境下,随着酸处理时间的延长,菌体存活率均呈下降趋势,但与对照组相比,其存活率明显增大,表明经4 种有机酸酸胁迫(pH 6.2)培养至稳定期的4 种CGMCC 1.1190酸胁迫菌株之间抗酸性存在差异,说明对酸的抗性作用与胁迫培养的有机酸的种类相关,其中胁迫菌株抗酸性从大到小依次为柠檬酸>乳酸>醋酸>苹果酸。
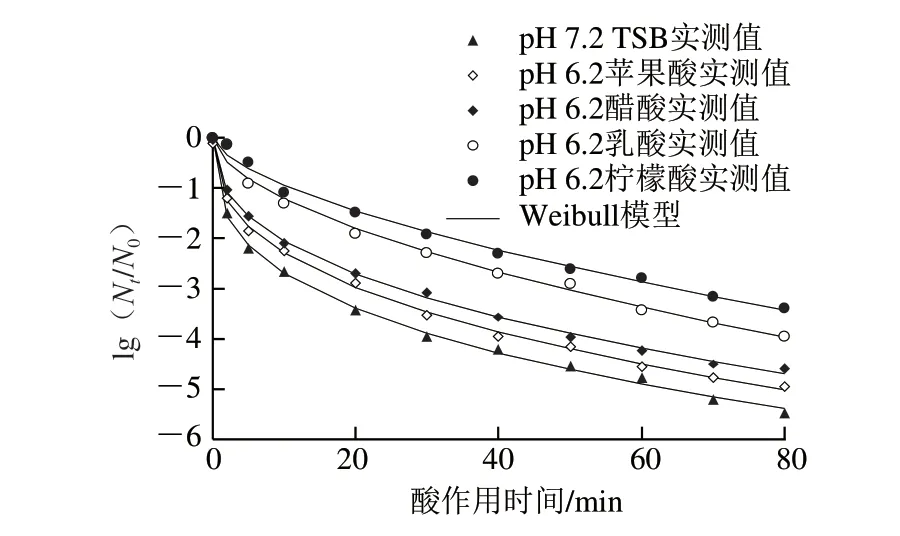
图2 pH 6.2的TSB培养基中胁迫培养获得的S.typhimurium CGMCC 1.1190抗酸菌株在pH 2.5的TSB培养基中的致死曲线Fig.2 Inactivation curves of S.typhimurium CGMCC 1.1190 cultured in TSB at pH 6.2 when exposed to pH 2.5

图3 pH5.2的TSB培养基中胁迫培养获得的S.typhimurium CGMCC 1.1190抗酸菌株在pH 2.5的TSB培养基中的致死曲线Fig.3 Inactivation curves of S.typhimurium CGMCC 1.1190 cultured in TSB at pH 5.2 when exposed to pH 2.5
由图3可知,采用Weibull模型也能较好地拟合CGMCC 1.1190菌株经4 种有机酸胁迫培养后获得的抗酸菌株(pH 5.2)在pH 2.5 TSB培养基中的失活曲线,拟合程度较高(R2>0.992 6)。研究发现,经4 种有机酸酸胁迫培养至稳定期的4 种CGMCC 1.1190酸胁迫菌株抗酸性存在差异,这4 种CGMCC 1.1190酸胁迫菌株(pH 5.2)对pH 2.5的强酸的抗性大小也与有机酸的种类相关,其中胁迫菌株抗酸性从大到小依次为柠檬酸>乳酸>醋酸>苹果酸。
利用Weibull模型对本实验获得的9 种CGMCC 1.1190抗酸性菌株与对照组在pH 2.5的TSB培养基中的致死实验数据进行回归拟合,以规模参数δ来评价CGMCC 1.1190菌株的抗酸性,通过JMP软件内部自动运算所得的模型参数δ和ρ见表3。
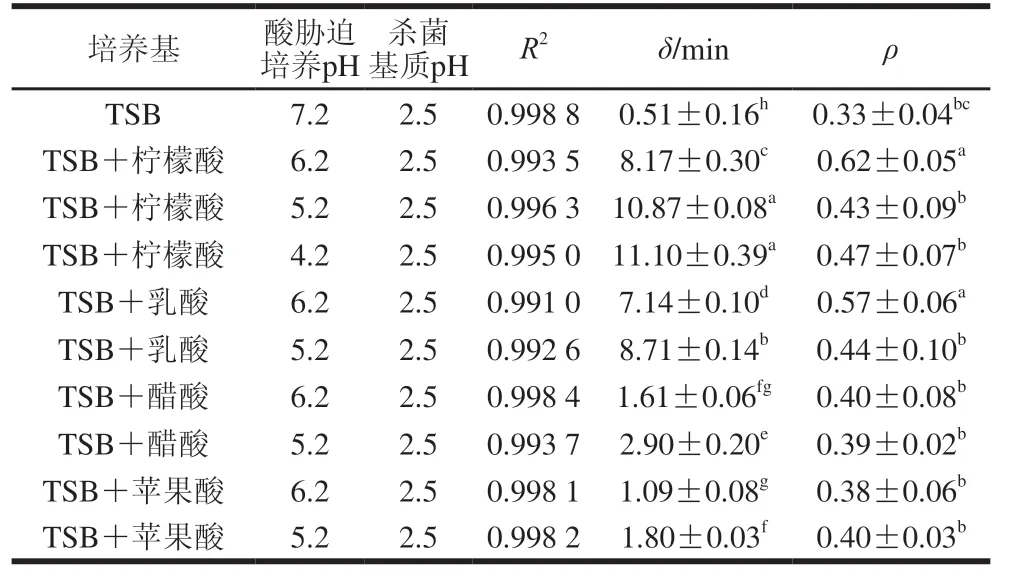
表3 S.typhimurium CGMCC 1.1190抗酸性菌株在pH 2.5的TSB培养基中酸致死模型曲线的拟合度及参数Table 3 Fitness and parameters of inactivation models for S.typhimurium CGMCC 1.1190 cultured in medium acidified with different organic acids when exposed to pH 2.5
ρ参数代表以Weibull模型拟合CGMCC 1.1190菌株的酸致死曲线的形状,当ρ=1时,曲线为直线;当ρ>1时,曲线向下弯曲,为凸型曲线;当ρ<1时,曲线向上弯曲,为凹型曲线[33]。δ表示CGMCC 1.1190菌体数量第一次减少10 倍所用的时间/min,抗酸性大小与δ成正比。随着胁迫培养的pH值的降低,CGMCC 1.1190菌株的抗酸性呈上升趋势,用柠檬酸胁迫培养pH值分别为6.2、5.2、4.2 TSB培养基中的CGMCC 1.1190菌株,δ分别为8.17、10.87 min和11.10 min,显著大于对照组pH 7.2 TSB培养基中CGMCC 1.1190菌株的δ(0.51 min)(P<0.05)。同样,经乳酸、醋酸和苹果酸3 种酸胁迫培养后,CGMCC 1.1190菌株的δ均呈现相同的变化趋势。pH 6.2和pH 5.2柠檬酸胁培养的δ分别是苹果酸胁迫培养的7.5 倍和6.0 倍,也表明在相同pH值下柠檬酸胁迫培养诱导CGMCC 1.1190菌株产生的抗酸性最强,苹果酸胁迫培养诱导产生的抗酸性最弱。经过酸胁迫培养后的CGMCC 1.1190菌株比对照组菌种更加耐酸,对照组菌种于pH 2.5的TSB培养基中处理80 min后菌体数量下降约5.5 个对数,大部分菌体死亡,经柠檬酸调节pH 4.2 TSB培养基中胁迫诱导培养的CGMCC 1.1190菌株于pH 2.5 TSB培养基中处理80 min后,菌体数量仅下降了约2.4 个对数,CGMCC 1.1190菌株的存活率明显提高。实验结果ρ<1,表明CGMCC 1.1190菌株的酸致死曲线向上弯曲,为凹型曲线,进一步说明模型曲线随着酸处理时间的延长,其下降趋势减缓,菌株失活率下降趋势减缓。综上,以4 种有机酸胁迫培养CGMCC 1.1190菌株至稳定期均可诱导其产生抗酸性,在强酸作用下其致死率降低,抗酸性强弱与有机酸种类和pH值有关,对于同一种有机酸,pH值越低,胁迫诱导CGMCC 1.1190菌株产生的抗酸性越强。
2.4 柠檬酸胁迫前后CGMCC 1.1190菌株个体形态的变化
CGMCC 1.1190菌株原始对照菌种与分别经过pH 6.2、5.2和pH 4.2柠檬酸胁迫培养至稳定期获得的3 种耐酸菌株在显微镜下的个体形态见图4。
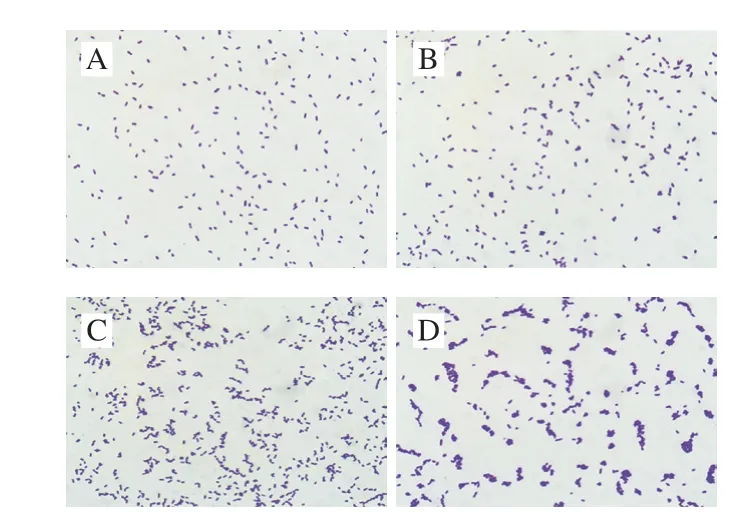
图4 S.typhimuriumCGMCC 1.1190菌株个体形态图(×1 000)Fig.4 Cellular morphology of S.typhimurium CGMCC 1.1190 (× 1 000)
CGMCC 1.1190对照菌株酸胁迫培养48 h后,在显微镜下呈单个分散状态的短杆状,单杆菌两端为钝圆(图4A);经pH 6.2的柠檬酸胁迫培养后,个体形态略有变化,有极少数个体聚集并呈双杆状或八字形排列(图4B);经pH 5.2的柠檬酸胁迫培养后,大部分菌体聚集并呈链状或八字形排列(图4C);经pH 4.2的柠檬酸胁迫培养后,几乎全部菌体聚集并成链状、栅状或重叠状排列(图4D)。说明柠檬酸的胁迫pH值越低,CGMCC 1.1190菌体的聚集状态越明显。个体间聚集程度的变化有助于其避免在强酸环境下产生损伤,这可能与其抗酸性能力的增加有一定的关系。刘艳霞等[34]研究发现,用某些药物对双歧杆菌作用后,其个体出现丝状体生长现象,这种个体形态的适应性变化有利于其抵抗不适的外界环境。目前,对于CGMCC 1.1190菌株酸胁迫导致其抗酸能力增加的相关机理仍在研究。本实验发现酸胁迫培养对S.typhimuriumCGMCC 1.1190菌株产生了同源性保护作用。
3 结 论
本实验研究了S.typhimuriumCGMCC 1.1190菌株分别在经柠檬酸、乳酸、醋酸和苹果酸调节pH值的TSB培养基中胁迫培养,结果表明,在相同pH值条件下CGMCC 1.1190菌株的抗酸性从大到小依次为柠檬酸>乳酸>醋酸>苹果酸。筛选出经胁迫培养的耐酸性菌株,发现在相同pH值下胁迫诱导,柠檬酸胁迫菌株抗酸性最强;对于同一种有机酸,pH值越低,胁迫培养诱导CGMCC 1.1190菌株产生的抗酸性越强,个体形态聚集程度越明显。综上,一定浓度的有机酸前期胁迫培养有利于保护CGMCC 1.1190菌株后期对强酸处理的同源性保护作用。
