源自螺旋藻渣枯草芽孢杆菌发酵抗菌肽SP-AP-1和伊枯草菌素对金黄色葡萄球菌抑菌机制对比研究
2021-01-20赵谋明庞一扬刘小玲
付 云,赵谋明,2,庞一扬,刘小玲,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.华南理工大学食品科学与工程学院,广东 广州 510000)
金黄色葡萄球菌(Staphylococcus aureus)是食品中常见的食源性致病菌,广泛分布于自然界中,容易污染乳制品、水产品和肉制品等食品,造成食物中毒,进而威胁人类的生命健康安全[1]。因此,有效抑制食品中金黄色葡萄球菌的生长繁殖、提高食品安全性,是对人类健康和生命安全的重要保障。
抗菌肽是一类天然的具有抗细菌或真菌作用的小分子生物活性肽,因有望成为新型天然食品防腐剂而备受关注[2]。作为天然来源的抗菌肽,与传统的抗菌剂相比,其独特的抑制病原微生物生长且不易产生耐药性的机理已成为广大学者的研究热点。Powers等[3]研究发现抗菌肽polyphemusin可破坏大肠杆菌细胞膜,从而使菌体裂解死亡;陈飞龙等[4]研究发现抗菌肽F1能够以嵌插方式与金黄色葡萄球菌的DNA结合,干扰其正常代谢,从而达到抑菌效果。然而,由于抗菌肽生产成本高昂,且对其抑菌机理研究尚不够深入,限制了其在食品及农业生物防治等方面的应用发展[5]。
螺旋藻渣是螺旋藻粉生产过程中的沉积物,其蛋白质含量高、价格低廉。在本课题组前期研究中,采用枯草芽孢杆菌YA215发酵螺旋藻渣,发现其发酵产物具有显著的抗金黄色葡萄球菌效果[6],后续通过Sephadex LH-20凝胶层析柱和反相高效液相色谱法进行分离纯化,采用基质辅助激光解吸电离飞行时间质谱从发酵产物中鉴定得到两种抗菌多肽:一种是伊枯草菌素(iturin A),分子质量1 043.44 Da,为枯草芽孢杆菌自身代谢产物[7];另一种是螺旋藻渣发酵过程中产生的新型抗菌肽,将其命名为SP-AP-1,分子质量1 422.60 Da,氨基酸序列为ATHDNCCLRQS。两种抗菌肽iturin A和SP-AP-1对金黄色葡萄球菌的最小抑菌浓度(minimum inhibitory concentration,MIC)分别为0.052 mg/mL和0.014 mg/mL,本实验以金黄色葡萄球菌为指示菌,从细胞膜表面疏水性、细胞膜通透性、K+泄漏情况、蛋白质合成和基因组DNA迁移变化等方面探究两种抗菌肽对金黄色葡萄球菌的抑菌机理,并比较其抗菌效果,以期为抗菌肽iturin A和SP-AP-1在食品和药品领域中的应用提供理论指导。
1 材料与方法
1.1 菌株、材料与试剂
金黄色葡萄球菌CGMCC 14519由中国普通微生物菌种保藏管理中心提供。
抗菌肽SP-AP-1(纯度>95%)由湖北普罗金科技有限公司合成;iturin A购自美国Sigma公司。
正十六烷、邻硝基苯-β-D-吡喃半乳糖苷 上海麦克林生化科技有限公司;曲拉通 北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;考马斯亮蓝R-250 天津市科密欧化学试剂有限公司;Nisaplin 丹尼斯克(中国)有限公司。
1.2 仪器与设备
UV-6100紫外-可见分光光度计 上海美谱达仪器有限公司;SW-CJ-2F洁净工作台 苏州安泰空气技术有限公司;ZEEnit700P原子吸收光谱仪 德国耶拿分析仪器股份公司;MOS-450圆二色光谱仪 法国Bio-Logic公司;SCIENTZ-48L冷冻型高通量组织研磨器 宁波新芝生物科技股份有限公司;GI80TW高压蒸汽灭菌锅致微(厦门)仪器有限公司;ZQZY-85CS振荡培养箱上海知楚仪器有限公司;Gel-Doc XRS免疫电泳成像系统美国Bio-Rad科技公司;RF-5301PC荧光分光光度计岛津企业管理中国有限公司。
1.3 方法
1.3.1 抗菌肽对金黄色葡萄球菌生长的影响
参照孟兆丽[8]的方法并稍作修改,将Nisaplin、抗菌肽SP-AP-1和iturin A分别加入金黄色葡萄球菌菌悬液(菌液浓度为108CFU/mL)中,使其终质量浓度均为1 MIC。37 ℃、200 r/min连续培养24 h,每隔2 h进行取样,测定OD600nm,绘制生长曲线,以未加入抗菌样品溶液的金黄色葡萄球菌作为空白对照。
1.3.2 抗菌肽对细菌细胞表面疏水性的影响
表面疏水性的测定参照Hou Lixia[9]和Pelletier[10]等的方法并稍作修改,采用0.02 mol/L pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤对数期金黄色葡萄球菌并用0.1 mol/L KNO3溶液重悬(菌液浓度为108CFU/mL),依次将质量浓度分别为1、1/2、1/4、1/8 MIC的两种抗菌肽溶液与菌悬液等体积混合,对照组为等量PBS。37 ℃、200 r/min培养30 min,测定OD405nm(OD0);然后吸取体积为1.2 mL的菌悬液,向其中加入200 µL十六烷,25 ℃摇床混匀2 min,静置15 min,直至菌悬液和十六烷两相溶液完全分层,小心吸取水相,测定OD405nm(OD1)。细菌细胞表面疏水性按下式计算。
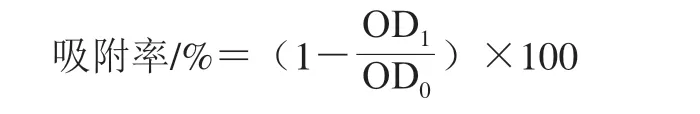
1.3.3 抗菌肽对细菌细胞内膜渗透性的影响
参照Ibrahim等[11]的方法并稍作修改,吸取1 mL对数生长期金黄色葡萄球菌菌液,8 000 r/min离心15 min,收集菌体沉淀并用己灭菌的生理盐水清洗两次,然后将洗涤后的菌液加入到10 mL的M9乳糖诱导培养基中,37 ℃振荡培养8 h,离心,洗涤菌体沉淀并用β-半乳糖苷酶反应缓冲液将其重悬,使其OD630nm在0.2左右。吸取重悬液1.6 mL,分别向其中加入200 µL 质量浓度为1 MIC的两种抗菌肽溶液,再加入200 µL质量浓度为1 mg/mL的邻硝基苯-β-D-吡喃半乳糖苷,混合均匀,37 ℃水浴5 h,间隔1 h测定OD405nm的变化情况,阴性对照为PBS,阳性对照为曲拉通。
M9乳糖诱导培养基(以1 L灭菌水计):乳糖5 g、Na2HPO4·7H2O 12.8 g、NaCl 0.5 g、NH4Cl 1 g、KH2PO43 g、CaCl20.01 g、MgSO40.5 g,121 ℃、0.1 MPa湿热灭菌15~20 min。
β-半乳糖苷酶反应缓冲液(以1 L灭菌水计):Na2HPO4·12H2O 2.9 g、NaCl 8 g、KH2PO40.24 g、KCl 0.2 g、MgSO40.25 g、β-硫基乙醇0.39 g。
1.3.4 抗菌肽对细菌细胞内K+泄漏的影响
将金黄色葡萄球菌菌悬液( 菌液浓度为108CFU/mL)分别与质量浓度1 MIC的两种抗菌肽混合,37 ℃孵育一定时间,10 000 r/min离心10 min,对照组为金黄色葡萄球菌菌悬液(菌液浓度为108CFU/mL,不添加任何抗菌肽溶液),采用原子吸收光谱仪测定上述上清液中K+质量浓度的变化情况,每隔10 min记录一次,共记录7 次。
1.3.5 抗菌肽对细菌胞内蛋白质合成的影响
1.3.5.1 菌体胞内蛋白质相对含量的测定
参照郭娟等[12]的方法,将培养至对数生长期的金黄色葡萄菌10 000 r/min离心15 min,收集菌体并重悬为108CFU/mL菌悬液,在100 mL菌悬液中分别加入质量浓度0.5 mg/mL的SP-AP-1和iturin A(终质量浓度均为1 MIC)和质量浓度0.5 mg/mL Nisaplin,对照组加入等体积无菌蒸馏水,37 ℃恒温培养,分别取间隔培养1 h的菌悬液10 mL,离心,收集菌体沉淀并用PBS洗涤两次。将沉淀转移至研钵,液氮研磨,加入500 µL 20 g/100 mL三氯乙酸和400 µL超纯水,冰浴10 min后离心取沉淀。用10 g/100 mL三氯乙酸再次重悬取沉淀,将菌体转移至无菌试管中,加入100 µL生理盐水重悬,再加入5 mL考马斯亮蓝染色液,室温放置30 min后在595 nm波长处测定OD595nm。
1.3.5.2 菌体蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
将培养至对数生长期的金黄色葡萄球菌用LB液体培养基培养液重悬后,分别加入两种抗菌肽溶液(质量浓度设置:1 MIC和5 MIC),为确保实验准确性,本实验采取两次对照(加入等体积的无菌蒸馏水),37 ℃、200 r/min培养8 h,8 000 r/min离心20 min,收集菌体,向菌体沉淀中加入500 µL PBS和0.3 g石英砂,8 000 r/min离心4 min,收集上清液,取20 µL上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析。
1.3.6 抗菌肽对金黄色葡萄球菌基因组DNA的影响
参考宁亚维等[13]的方法并稍作修改。采用DNA提取试剂盒对金黄色葡萄球菌基因组DNA进行提取,利用凝胶阻滞法观察SP-AP-1和iturin A对金黄色葡萄球菌基因组DNA的影响。将金黄色葡萄球菌基因组DNA与质量浓度分别为1、2、3 MIC和4 MIC的两种抗菌肽溶液按照体积比1∶1混合,对照组为金黄色葡萄球菌基因组DNA(不添加抗菌肽溶液),总反应体积为4 µL。充分混匀后,37 ℃恒温水浴60 min。反应结束后,用质量分数1%的琼脂糖凝胶电泳观察并分析基因组DNA的迁移结果。
1.3.7 抗菌肽作用于细菌细胞膜时二级结构的变化
分别采用30 mmol/L SDS溶液和10 mmol/L PBS将两种抗菌肽配制成质量浓度为0.5 mg/mL的溶液,在石英比色皿中加入一定体积的抗菌肽溶液,25 ℃下用圆二色光谱仪对样品进行180~260 nm的远紫外扫描并采集数据,扫描速率50 nm/min,带宽1.0 nm。对扫描后的所有图谱用CDNN软件进行减噪处理并对样品溶液的二级结构相对含量进行拟合计算。
1.4 数据统计与分析
所有实验均重复3 次,实验数据采用SPSS Statistics 19软件与Origin 9.1软件进行统计分析,以平均值±标准差表示。采用Duncan法进行显著差异性比较,P<0.05表示差异显著。
2 结果与分析
2.1 抗菌肽对金黄色葡萄球菌生长的影响
由图1可知,添加抗菌肽SP-AP-1和iturin A的金黄色葡萄球菌菌液在培养4 h后其生长曲线均发生明显变化,菌液质量浓度逐渐降低,8 h后OD600nm逐渐趋于稳定,而对照组菌落生长正常,无明显变化,表明两种抗菌肽均能够在金黄色葡萄球菌的对数生长期内抑制其生长繁殖,且SP-AP-1比iturin A有更强的抑制作用。
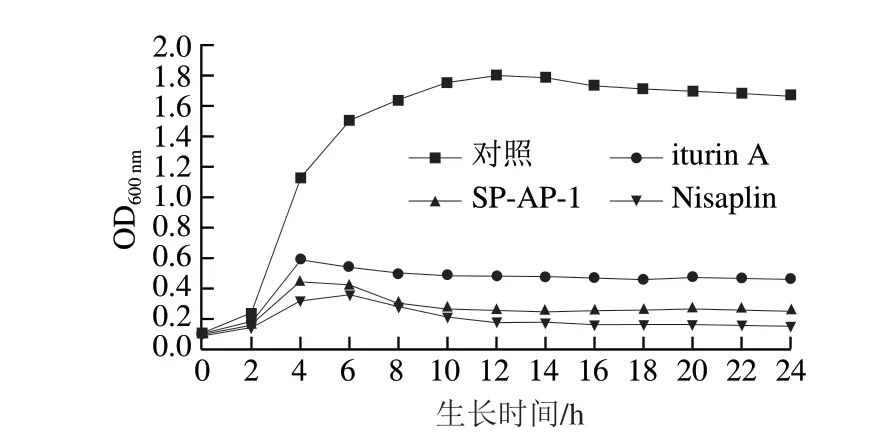
图1 抗菌肽对金黄色葡萄球菌生长的影响Fig.1 Effects of antimicrobial peptides on the growth of S.aureus
2.2 抗菌肽对细菌细胞表面疏水性的影响
正十六烷是一种有机相,金黄色葡萄球菌在水相和有机相中的吸附率是不同的,因此,细菌细胞表面疏水性的改变可由吸附率来反映[14]。如图2所示,当抗菌肽SP-AP-1和iturin A作用于金黄色葡萄球菌后,各组间和组内的细胞吸附率均存在显著性差异(P<0.05)。其中,经iturin A处理后,金黄色葡萄球菌细胞吸附率从PBS组的77.3%降为37.6%,而经SP-AP-1处理的菌液细胞吸附率仅为33.5%,两种抗菌肽对金黄色葡萄球菌细胞吸附率的影响均呈浓度依赖性。有研究表明,细胞表面疏水位点主要为蛋白质-脂类和糖-脂类等物质[15],故推测细胞表面疏水性降低的可能原因为抗菌肽与金黄色葡萄球菌细胞表面相互作用,吸引电负性基团造成重排,从而导致金黄色葡萄球菌细胞表面电负性增强,疏水性下降[16]。
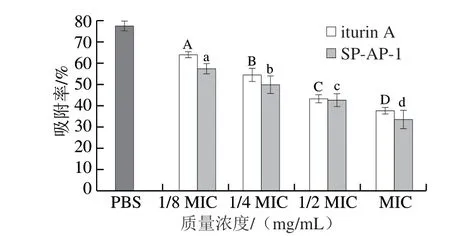
图2 抗菌肽对金黄色葡萄球菌细胞表面疏水性的影响Fig.2 Effects of antimicrobial peptides on the cell surface hydrophobicity of S.aureus
2.3 抗菌肽对细菌细胞内膜渗透性的影响
细菌经乳糖诱导后,其细胞内膜上能产生一种将乳糖水解成半乳糖和葡萄糖的β-半乳糖苷酶[17]。邻硝基苯β-D-半乳吡喃糖苷可作为乳糖替代物被β-半乳糖苷酶水解成半乳糖和黄色的邻-硝基苯酚,故通过测定反应体系中OD值来反映抗菌肽对细菌细胞内膜的破坏程度[18]。

图3 抗菌肽对金黄色葡萄球菌细胞内膜通透性的影响Fig.3 Effects of antimicrobial peptides on the permeability of S.aureus cell membrane
由图3可知,当抗菌肽作用于金黄色葡萄球菌后,两种抗菌肽的OD405nm均随时间的延长而增大,且在3 h时OD405nm达到最高,反应体系进行到5 h时,SP-AP-1组OD405nm显著高于iturin A组(P<0.05)。而在整个反应过程中,PBS阴性对照组基本无明显变化,其OD405nm稳定在0.42左右,这表明添加SP-AP-1和iturin A对金黄色葡萄球菌细胞内膜造成了一定的损伤作用,导致其细胞内膜渗透性增大、通透性增强,底物邻硝基苯β-D-半乳吡喃糖苷进入细胞内的数量增多,β-半乳糖苷酶催化分解速率加快,故黄色产物邻-硝基苯酚增多,OD405nm增大。随着时间的延长,由于β-半乳糖苷酶数量有限,催化分解的速率达到最大值时,OD405nm不再随底物邻硝基苯β-D-半乳吡喃糖苷的增加而增大,而是保持相对稳定的趋势。这与赵广旭[19]和张宇[20]自主设计的抗菌多肽具有类似作用效果,说明抗菌肽通过引起细菌细胞内膜通透性改变,达到抑制或杀死细胞的效果。
2.4 抗菌肽对细菌细胞膜内K+的泄漏影响
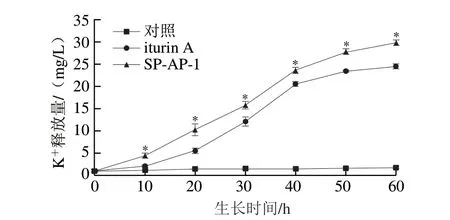
图4 抗菌肽诱导金黄色葡萄球菌细胞内K+释放量的变化Fig.4 Effect of antimicrobial peptides on the release of intracellular potassium ions from S.aureus
细胞内K+的泄漏是离子泄漏的典型代表之一,其泄漏程度可反映抗菌肽作用于细胞时细胞膜的损伤程度[21-22]。由图4可知,金黄色葡萄球菌经SP-AP-1和iturin A处理后,其胞内K+释放量随时间的延长均呈快速增长趋势,而对照组变化不明显,表明SP-AP-1和iturin A均能使金黄色葡萄球菌细胞膜通透性发生改变,且比较两种抗菌肽的作用效果发现,SP-AP-1比iturin A对金黄色葡萄球菌细胞膜的透化作用更强(P<0.05),这与2.3节中抗菌肽对细菌细胞内膜的渗透性影响结果相符,充分说明SP-AP-1和iturin A均能与金黄色葡萄球菌细胞膜相互作用,破坏其细胞膜的完整性,导致菌体死亡。然而SP-AP-1和iturin A引起金黄色葡萄球菌细胞膜完整性的破坏是否是导致其细胞死亡的主要原因还需进一步研究。
2.5 抗菌肽对细菌胞内蛋白质合成的影响
2.5.1 菌体胞内蛋白相对含量分析结果
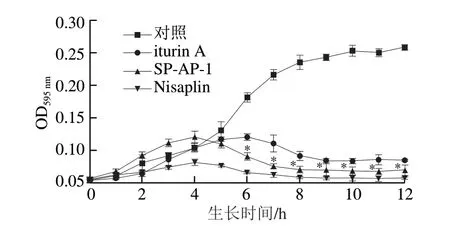
图5 抗菌肽对金黄色葡萄球菌胞内蛋白相对含量的影响Fig.5 Effects of antimicrobial peptides on intracellular protein content of S.aureus
由图5可知,对照组胞内蛋白相对含量随时间的延长而持续增加,且在10 h后保持稳定,而添加抗菌肽的实验组金黄色葡萄球菌胞内蛋白相对含量均呈先增加后降低的趋势。郭娟等[12]研究发现,抗菌肽与细菌作用后,短时间内细胞膜受损但尚未破裂,故其胞内蛋白相对含量表现出升高趋势。添加SP-AP-1和iturin A的实验组金黄色葡萄球菌胞内蛋白相对含量分别在4 h和6 h后急剧下降,且两组具有显著性差异(P<0.05),这可能是因为金黄色葡萄球菌细胞膜的破裂导致胞内蛋白相对含量降低,也可能是由于抗菌肽进入细胞后使其DNA转录和翻译过程受到抑制,因而菌体本身胞内蛋白含量降低[4]。
2.5.2 菌体蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测结果
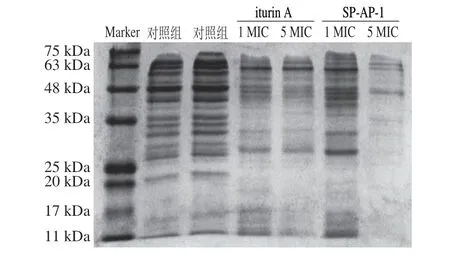
图6 菌体蛋白SDS-PAGE分析结果Fig.6 SDS-PAGE analysis of the effect of antimicrobial peptides on intracellular proteins of S.aureus
由图6可知,对照组胞内蛋白条带完整清晰,而经抗菌肽SP-AP-1和iturin A处理后的实验组金黄色葡萄球菌胞内蛋白出现不同程度的缺失现象。其中,蛋白条带缺失较多的部分主要集中在分子质量17、20、25~35 kDa,说明两种抗菌肽可影响金黄色葡萄球菌的基因转录或翻译功能,进而抑制其蛋白质的合成,导致金黄色葡萄球菌胞内分子质量17、20、25~35 kDa之间的蛋白含量降低;同时,研究发现当两种抗菌肽质量浓度从1 MIC增大到5 MIC时,分子质量在48~75 kDa之间的蛋白也会发生明显的缺失现象,金黄色葡萄球菌的蛋白条带清晰度明显下降,颜色明显变浅,特别是经质量浓度5 MIC抗菌肽SP-AP-1处理后,金黄色葡萄球菌胞内蛋白条带几乎没有,说明增大抗菌肽SP-AP-1质量浓度,金黄色葡萄球菌胞内蛋白含量急剧降低,金黄色葡萄球菌胞内蛋白质的合成完全受到抑制。因此,SDS-PAGE实验进一步表明抗菌肽进入金黄色葡萄球菌细胞后,抑制其胞内蛋白合成,从而导致菌体死亡,且高质量浓度的抗菌肽对金黄色葡萄球菌具有更强的抑制效果。陈飞龙等[4]研究了抗菌肽F1对金黄色葡萄球菌的胞内作用机制,也发现抗菌肽F1能够造成分子质量20~30 kDa的蛋白含量降低,蛋白条带颜色显著变浅。
2.6 抗菌肽对菌体基因组DNA的影响
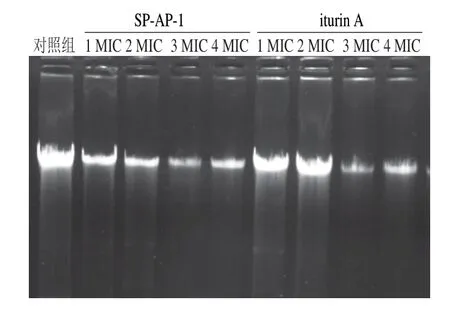
图7 抗菌肽对金黄色葡萄球菌基因组DNA的影响Fig.7 Effect of antimicrobial peptides on genomic DNA of S.aureus
如图7所示,不同质量浓度的抗菌肽SP-AP-1和iturin A作用于金黄色葡萄球菌后,菌体DNA条带并未发生明显的迁移现象,且部分DNA滞留于上样孔内,这可能是因为电荷电负性发生改变或DNA双螺旋结构改变,从而影响DNA迁移率[23-24]。增大两种抗菌肽质量浓度,iturin A作用的金黄色葡萄球菌菌体DNA条带迁移率和亮度没有明显变化,而SP-AP-1作用的金黄色葡萄球菌菌体DNA条带亮度逐渐变暗、颜色变浅,这是由于抗菌肽与溴化乙锭竞争性结合DNA[25],使金黄色葡萄球菌的基因功能受到影响,从而抑制其生长繁殖。Li Lirong等[26]研究发现细胞穿透肽衍生物可与溴化乙锭竞争性结合伤寒沙门氏菌DNA,从而导致菌体死亡;郭娟[12]和陈璇[27]等的研究也均证实了此观点。因此,虽然两种抗菌肽对金黄色葡萄球菌基因组DNA没有明显阻滞作用,但推测抗菌肽SP-AP-1可能与溴化乙锭竞争性结合DNA,使核酸合成受到抑制,而抗菌肽iturin A不能达到此效果。
2.7 抗菌肽作用于细菌细胞膜时二级结构的变化分析结果
抗菌肽的抑菌活性与其二级结构的变化密切相关[28]。圆二色光谱法是目前测定蛋白质二级结构、研究蛋白质在稀溶液中的结构和构象变化的较为准确和应用广泛的方法之一[29]。本实验利用圆二色光谱法对两种抗菌肽在PBS和SDS疏水环境下的二级结构变化进行研究分析(图8)。
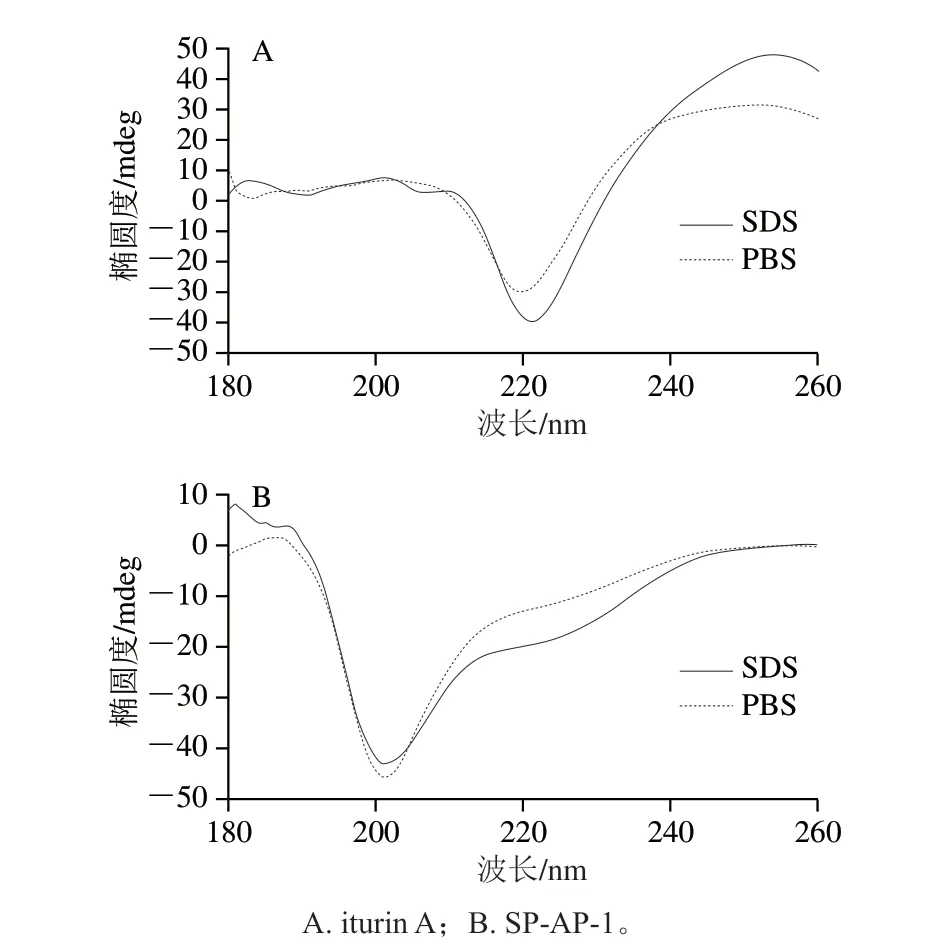
图8 两种抗菌肽在PBS和SDS缓冲液中的圆二色光谱Fig.8 Circular dichroism spectra of two antimicrobial peptides in PBS and SDS buffers
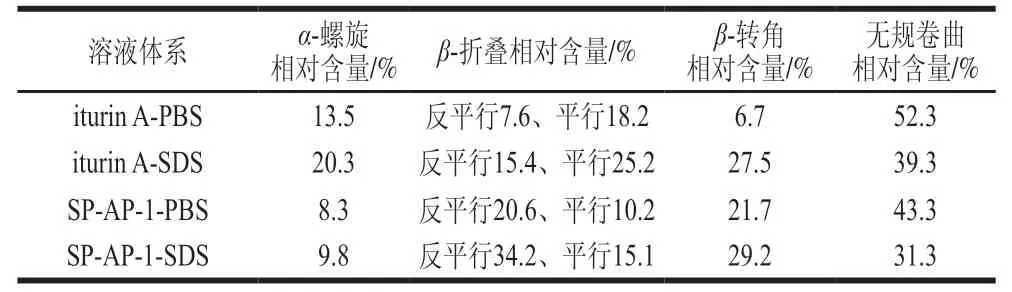
表1 两种抗菌肽二级结构的相对含量Table 1 Proportions of secondary structures in two antimicrobial peptides
两种抗菌肽在不同环境下的二级结构相对含量见表1。当抗菌肽SP-AP-1处于PBS体系中时,其二级结构主要以无规卷曲(相对含量43.3%)为主;当抗菌肽SP-AP-1处于SDS缓冲液体系中时,其二级结构中无规卷曲相对含量减少,α-螺旋、反向平行、平行及β-转角相对含量均有所增加,β-折叠(反向平行和平行)相对含量增加幅度最为明显;而抗菌肽iturin A二级结构相对含量变化主要以β-转角为主,当抗菌肽iturin A从PBS体系转变到SDS缓冲液体系后,其二级结构中β-转角相对含量从6.7%增加到27.5%。有研究表明,大部分抗菌肽通常在液体环境中的二级结构都是以无规卷曲为主,当抗菌肽接触细菌细胞膜后,其结构或构象会发生一定程度的变化,这种构象变化与其抗菌活性紧密相关[30]。因此,本实验中两种抗菌肽在缓冲液环境及模拟膜的疏水环境下二级结构的变化间接反映了当抗菌肽作用于金黄色葡萄球菌时的抑菌机制。
3 结 论
本实验以螺旋藻渣抗菌肽SP-AP-1和iturin A为研究对象,对比了两种抗菌肽对金黄色葡萄球菌的抑菌机制。结果表明,iturin A主要通过引起金黄色葡萄球菌细胞膜通透性增加、抑制菌体蛋白合成,从而抑制菌体生长繁殖;而SP-AP-1对金黄色葡萄球菌的抑菌机制则是影响细胞膜通透性、抑制蛋白合成和竞争性结合DNA共同作用的结果,且其抑制效果比iturin A更为明显,为进一步探究抗菌肽SP-AP-1的广谱抗菌机制提供了一定的理论指导。
