咽旁间隙肿瘤38例临床分析
2021-01-20殷继风陈浩李万举万光伦胡燕明孙敬武
殷继风 陈浩 李万举 万光伦 胡燕明 孙敬武
咽旁间隙是位于颈深部的一个潜在筋膜性上宽下窄的腔隙,列于咽后间隙两侧,呈倒立的锥体形,向上至颅底,向下至舌骨大角。由茎突及茎突相关肌肉组织将其分为茎突前间隙和茎突后间隙。茎突前间隙内包含有少许腮腺深叶组织,向内通至咽侧壁;茎突后间隙内有颈内动静脉、第IX~Ⅻ颅神经等重要血管神经走行。
咽旁间隙肿瘤发病率较低,约占头颈部肿瘤的0.5%~1%,其中以良性肿瘤为主,约占 70~80%[1,2]。咽旁间隙位置深,毗邻结构较复杂,发病早期临床症状特异性低,直接影响了该疾病的临床诊断和治疗。本文回顾分析了我科2015年5月到2020年3月经手术干预的38例咽旁间隙肿瘤的临床特点、手术入路的选择、病理类型及术后恢复情况,现报道如下。
资料与方法
1 临床资料
回顾分析于2015年5月~2020年3月期间在中国科学技术大学附属第一医院诊治的咽旁间隙肿瘤患者38例,其中男性14例、女性24例;年龄6~77岁,平均47.2岁,中位年龄49岁。
2 临床表现及诊断
患者临床症状主要包括有咽部不适(12/38)、睡眠打鼾或呼吸不畅(3/38)、颈部包块(9/38)、声嘶或发声含糊(2/38)、耳痛耳闷(2/38)、颈痛(1/38)、咽痛(2/38)等,另有7例患者系普通体检时偶然发现病变。入院后专科查体以咽侧壁隆起和(或)扁桃体移位(23/38)及颈部或颌下包块(10/38)为主,亦有少数患者(5/38)在体格检查时未发现阳性体征,依据影像学检查诊断咽旁间隙占位。见表1,肿瘤位于左侧患者17例、右侧者21例。
影像学检查:患者术前均行CT和(或)MRI检查,30例仅行CT检查,其中15例行CTA检查,3例仅行MRI检查,5例同时行CT和MRI检查。
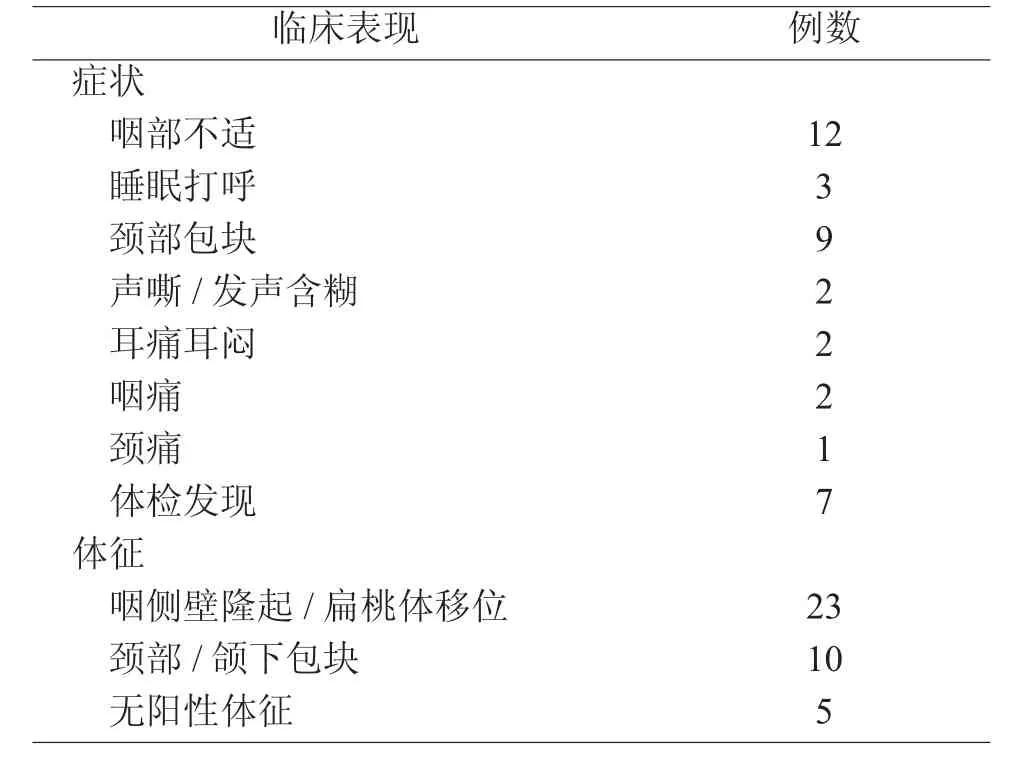
表1 临床表现(例)
3 手术入路
本组38例中,采用经颈侧入路者30例,其中1例术前行颈动脉栓塞术,1例术中行内镜辅助止血;内镜辅助经鼻入路3例;经口入路4例,其中内镜辅助经口入路1例;其中1例幼年患者术后5天因肺部炎症至排痰困难行气管切开术,出院后顺利拔管;其中2例患者仅行病理活检术,术后病理均为恶性肿瘤。
结果
1 影像学表现,见图1-4。
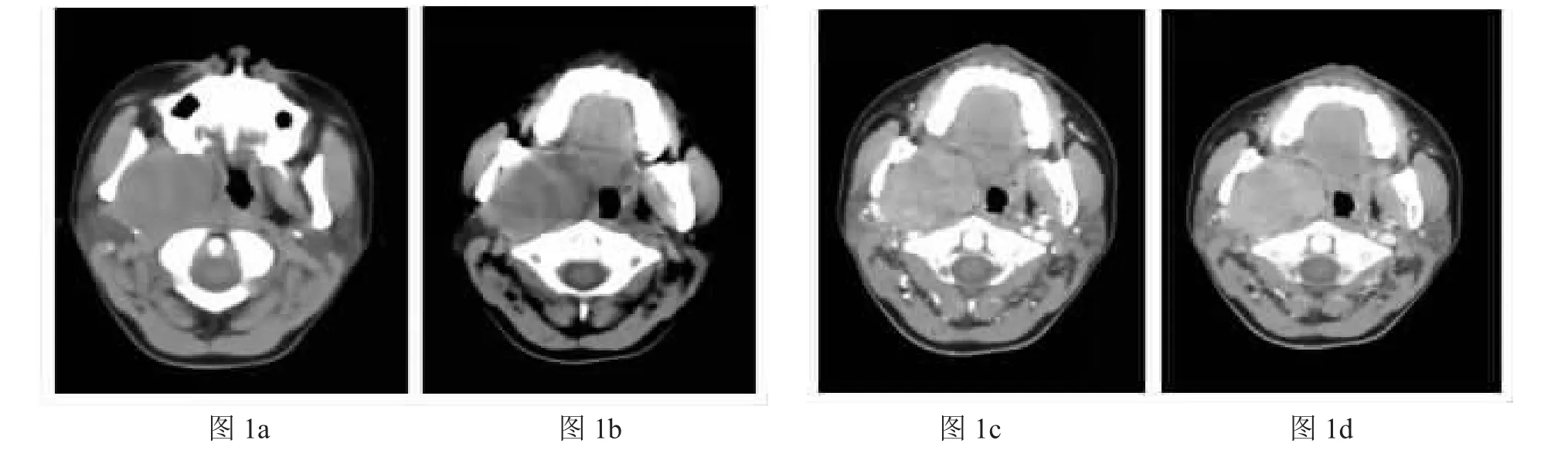
右侧咽旁间隙多形性腺瘤:右侧咽旁类圆形低密度肿块影。图1a:右侧茎突向后、外移位,提示肿块来源于茎突前间隙。图1b:肿块压迫咽旁间隙内脂肪,使其向内移位,呈“反C型”。图1c,1d:增强扫描动脉期病灶明显强化,静脉期进一步延迟强化,为明显坏死区(与病理相符)。

右侧咽旁间隙神经鞘瘤:图2a:箭头所示,右侧二腹肌后腹受压向前外移位,提示肿块来源于颈动脉间隙,并于病灶前缘见条状囊变区域,T2WI呈高信号。图2b:增强扫描肿块实性成分明显强化。
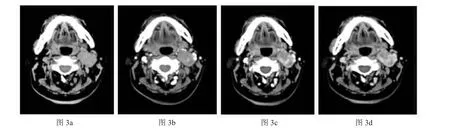
左侧咽旁间隙上皮样血管肉瘤:图3a:左侧咽旁见团块状软组织影,边界尚清,内见斑点状稍高密度影。图3b:增强动脉期病灶内见小片状强化灶。图3c、3d:增强静脉期及延迟期病灶呈渐进性强化,倾向于血管源性病变。
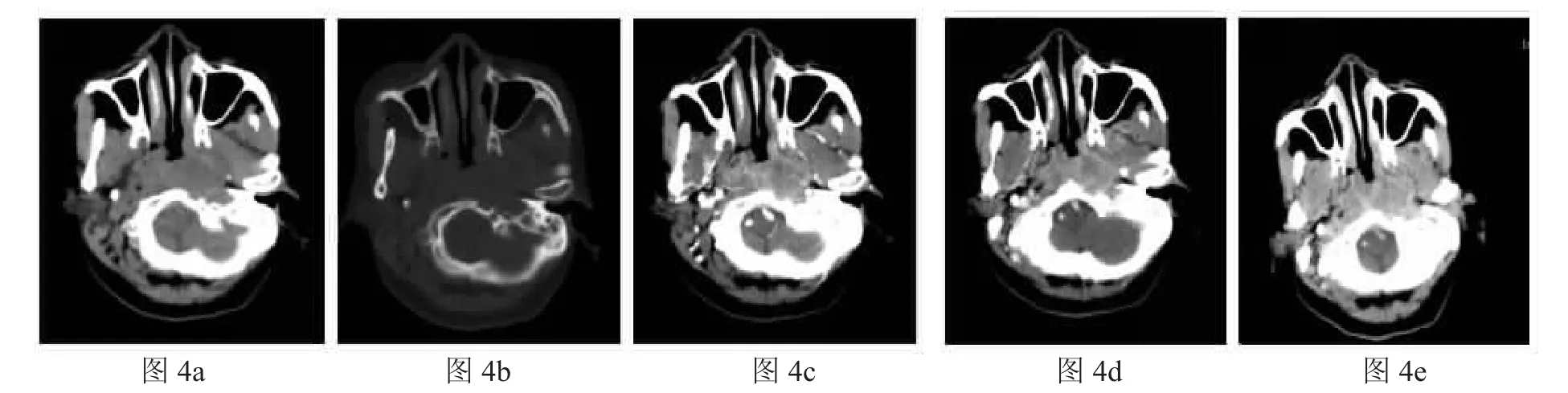
左侧咽旁间隙低分化鳞癌:图4a:平扫示左侧咽旁不规则软组织肿块影,边界不清。图4b:骨窗示病灶邻近左侧颅底骨质破坏, 提示恶性肿瘤。图4c:增强动脉期病灶明显不均匀强化,内见强化血管影。图4d、4e:增强静脉期及延迟期示病灶强化较动脉期减退。
2 术后病理诊断
所有患者术后均行病理学检查,其中良性病变为主(31/38),以多形性腺瘤(9/38)和神经鞘瘤(17/38)为绝大多数,基底细胞腺瘤、纤维瘤病、节细胞神经瘤和脂肪瘤各1例;恶性肿瘤7例,弥漫性大B细胞淋巴瘤、上皮样血管肉瘤、涎腺黏液表皮样癌、未分化癌、低分化鳞状细胞癌、恶性神经鞘膜瘤、低分化神经内分泌癌各1例,病理类型多样。见表2。

表2 术后病理诊断(例)
3 术后并发症及术后随访
1例术后当天出现术腔出血,行探查止血,术后恢复良好。术后声音嘶哑为最常见并发症,总发生7例,其中3例均在半年内基本缓解,1例患者出现严重声嘶的同时合并有吞咽困难、饮水呛咳及伸舌偏斜等后组颅神经受损的表现;术后出现面瘫患者2例,均在3月内基本恢复正常;1例患者术后出现患侧抬臂受限,考虑臂丛神经损伤。
良性肿瘤患者术后随访均未见肿瘤复发,1例失访;恶性肿瘤患者中,1例上皮样肉瘤患者,术后3月出现肺部转移死亡,1例鼻咽癌患者失访,其余均存活,其中3例术后行放化疗,恢复良好,2例术后于我科门诊定期复查,肿瘤无复发无转移。
讨论
影像学诊断:术前影像学检查的目的主要是判断肿瘤大小、位置、范围以及与周围神经血管的关系,以选择合适的手术入路。其中CT和MRI为最常用的检查。通过咽旁间隙脂肪移位及颈动静脉移位的方向可以判断肿瘤来源的部位。茎突前间隙来源肿瘤将脂肪向内侧推移,将颈鞘向后推移;茎突后间隙来源的肿瘤将脂肪向前外侧推移,颈鞘向前内或前外移位。涎腺源性肿瘤多位于茎突前间隙[3],CT多形性腺瘤可表现为类圆形的肿块,可呈不规则的分叶状,边界清楚,密度不均,间隙内脂肪受压向内移位,颈动脉鞘不移位或向后方移位(见图1)。神经鞘瘤则多见于茎突后间隙,CT常呈椭圆形较规则肿块,边界清楚,常伴囊性区,动静脉向前或向外侧移位。恶性肿瘤可表现为肿瘤密度不均,形状欠规则,边界欠清,部分可向周围组织侵犯,或伴骨质破坏(见图4)。MRA和CTA可作为评估肿瘤与血管位置关系的术前检查,对于鉴别颈动脉体瘤也有重要意义。
对肿瘤的术前诊断中,目前细针穿刺已广泛应用于乳腺、甲状腺肿块的检查,但咽旁间隙肿瘤的应用则较局限,国内有学者[4]报道咽旁间隙肿瘤细针穿刺的诊断准确率为74.6%。但考虑到肿瘤位置深,防止肿瘤种植,减少对肿瘤周围神经血管的损伤,有学者不主张常规使用细针穿刺技术[5]。但针对怀疑恶性肿瘤的病例,细针穿刺明确病理为恶性病变后,可以进行更为详尽的影像学检查,以提供更精准的治疗方案,避免盲目手术治疗。该组病例中患者在院内术前均未行细针穿刺检查。
手术入路的选择:结合术前患者影像学资料的分析,评估肿瘤大小、位置以及同周围重要神经血管的解剖关系,是手术入路选择的重要参考,在保证手术安全的前提下,尽量完整切除肿瘤,避免肿瘤残留。临床上常用的手术入路包括有经颈侧切开入路、经颈-腮腺入路、经颈-下颌骨裂开入路、经口入路、内镜辅助经鼻入路等。
本组病例中,主要选择经颈部侧切开入路,该入路系无菌切口、开放视野、直视下操作,且可在术中可根据肿瘤位置及大小,适当延长手术切口,适用于大多数咽旁间隙肿瘤的切除,亦是首选入路。
其余少数病例选择经鼻入路和经口入路。其中1例常规行颈侧切开,术中发现肿瘤位置高,位于颈内外动脉分叉的上方,经颈部无法完全暴露,术中转经口入路,顺利完整切除肿瘤。另2例患者,经过术前评估,肿瘤大小中等,毗邻咽侧壁,经口入路完整切除肿瘤,其中1例在内镜辅助下完成,完整剥除肿瘤,视野清晰,出血少,术后病理为多形性腺瘤。
而对于肿瘤体积巨大,位置深且靠近颅底的病变,经颈-下颌骨裂开入路可清晰暴露颈侧重要的血管和神经组织,赵敏等[6]曾利用该术式切除咽旁肿瘤,但该术式创伤较大,术后瘢痕明显,有可能发生颌骨坏死,遗留畸形或功能异常等,故较少使用,本组病例中尚未使用该术式病例。
咽旁间隙肿瘤手术方式的选择,也有不少学者认为经颈-腮腺入路为最常用的手术方式[7,8],该入路大多需要行面神经解剖,适用于累及腮腺深叶的肿瘤、位置较高的神经源性肿瘤或者恶性肿瘤[9]。随着内镜技术在各外科领域内的广泛应用,术中可在内镜辅助下探查术腔,可用于术腔深部的止血,残余肿瘤的发现及清理,减少手术并发症,降低肿瘤复发率,提高了经颈侧入路或经颈-腮腺入路等传统术式的手术疗效。
经口入路的使用在近年来开始逐渐增多,尤其是在内镜辅助下,多家医院均已开展经口内镜辅助下咽旁间隙肿瘤切除术[10]。国内卢永田等[11]开展口内径路咽旁间隙的内镜解剖研究,发现咽上缩肌和翼内肌为进入茎突前间隙的解剖标志,茎突咽肌和茎突舌肌是内镜下区分茎突前后间隙的重要标志。这与Dallan的报道相吻合[12],也为内镜下经口入路切除咽旁间隙肿瘤提供了解剖依据,便于手术定位,在内镜辅助下手术也减少血管神经的损伤。杨征等[13]对口翼突径路内镜下切除颈鞘内侧高位咽部间隙肿瘤的术式进行了研究,术中需磨除翼突根部,确保手术视野均在内镜监视下操作,与传统内镜经口入路相比,扩大了肿瘤上外侧的操作空间,能够有效避免严重手术并发症的发生。该研究挑选靠近咽侧壁的非巨大咽旁间隙良性肿瘤入组。在国外已经有报道使用手术机器人经口咽旁间隙肿瘤切除术,这也为手术的选择提供了全新的方向[14,15]。
对于术前是否行气管切开术,需视肿瘤大小及手术方式而定,对于术前有重症鼾症表现患者,可考虑气管切开[16],或者巨大肿瘤切除、选择经口入路时咽部黏膜肿胀明显时,为预防术后出现呼吸困难,也可考虑预防性气管切开[17],本组病例术前均未行气管切开术,术后1例幼年患者肺部炎症致排痰困难,行气管切开;其中针对巨大肿瘤切除或者选择经口入路患者,术中确切止血,放置有效术腔引流,术后仍需密切关注呼吸情况,必要时需行床旁紧急气管切开保证气道通畅,避免因气道梗阻导致严重并发症。
咽旁间隙肿瘤以良性多见,恶性肿瘤所占比例较低,但病理类型丰富[18]。其位置深在,肿瘤早期缺乏特异性临床表现,不利于及时诊断。术前影像学检查有助于判断肿瘤的性质及来源,评估肿瘤与周围重要结构的毗邻关系,选择合适的手术入路,在完整切除肿瘤的基础上,尽量减少术中损伤,降低术后并发症。随着微创意识的提升,在保证肿瘤完整切除的基础上,经口入路内镜辅助及机器人辅助技术将会得到更广泛的应用。
