氧化还原HMGB1 介导间充质干细胞血管修复对动脉粥样硬化的影响
2021-01-20孟小虎黄昌拼刘永昌解旭品张方捷
孟小虎 黄昌拼 刘永昌 解旭品 张方捷 方 欣
动脉粥样硬化是一种多因素疾病。高迁移率族1蛋白(High mobility group box 1 protein,HMGB1)是动脉粥样硬化的关键炎症介质,不同氧化还原状态的HMGB1 活性不同,完全氧化后会失去原有活性[1]。研究发现,外源性HMGB1 可抑制血小板衍生生长因子诱导的多能血管干细胞的增殖及其向血管平滑肌细胞的分化,但是氧化处理后,HMGB1 则失去上述抑制作用[2]。既往研究表明,间充质干细胞(mesenchymal stem cell,MSC)可通过选择修复模式减轻或加重动脉粥样硬化[3],目前尚不清楚氧化还原状态的HMGB1 是否以及如何参与动脉粥样硬化。本研究通过二硫苏糖醇(dithiothreitol,DTT)及过氧化氢(H2O2)处理HMGB1,使其处于不同氧化还原状态,观察其对MSC 增殖、迁移及向血管细胞(内皮细胞及平滑肌细胞)分化的作用,以阐明氧化还原状态HMGB1介导MSC 血管修复对动脉粥样硬化的影响。
1 材料与方法
1.1 细 胞 F344 大鼠骨髓MSC(美国Cyagen Biosciences 公司,RAFMX-01001)。
1.2 主要试剂 DMEM 培养基(美国Gibco,批号11995065)、0.25%胰酶(美国Gibco,批号25200056)、胎牛血清(fetal bovine serum,FBS)(美国Gibco,批号12484028)、细胞冻存液(美国Cyagen Biosciences,批号GUXMX-07021)、CCK-8 试剂盒(中国Beyotime Biotech,批号C0038)、Transwell 小室(中国corning,批号3422)、4',6-二脒基-2-苯基吲哚(4',6-diamidine-2-phenylindole,DAPI)(美国BioLegend,批号422801)、血管内皮生长因子(vascular endothelial growth factor,VEGF)(以色列ProSpec,批号CYT-116)、血小板衍生生长因子(platelet-derived growth factor,PDGF-BB)(以色列ProSpec,批号CYT-501)、小鼠抗CD31 IgG 抗体(美国Abcam,批号ab212711)、小鼠抗α-平滑肌抗原(α-SMA)IgG 抗体(美国Abcam,批号ab119952)、藻红蛋白(PE)偶联的抗α-SMA 抗体(美国Biodesign,批号hz-0189RPE)、Alexa Fluor 647 偶联的山羊抗小鼠IgG 抗体(中国FCMACS,批号FMS-Msaf64701)、PE 偶联的抗CD31 抗体(中国Miltenyi Biosciences,批号130-105-878)、重组HMGB1 细胞因子(美国Sigma-Aldrich,批号H4652)、H2O2(美国Sigma-Aldrich,批号18304)、DTT(美国Sigma-Aldrich,批号D0632)。
1.3 方 法
1.3.1 细胞培养 将MSC 置于含10% FBS 及1%双抗的DMEM 培养基中,放入5% CO2、37℃恒温培养箱中培养至对数生长期,使用0.25%胰酶消化进行传代培养。
1.3.2 氧化还原HMGB1 制备 室温下分别使用浓度梯度0.005mmol/L[HMGB1(0.005mM H2O2)组]、0.01mmol/L[HMGB1(0.01mM H2O2)组]、0.02mmol/L[HMGB1(0.02mM H2O2)组]H2O2和5mmol/L[HMGB1(5mM DTT)组]DTT 处理HMGB1 2h[4-5]使其处于氧化及还原状态,未处理的HMGB1 为阴性对照(HMGB1 组),然后分别使用100μg/L 浓度上述处理后的HMGB1 处理MSC 24h[2],不做处理的MSC 为空白组(MSC 组)。
1.3.3 细胞增殖力测定 将MSC 组、HMGB1 组、HMGB1(0.005mmol/L H2O2)组、HMGB1(0.01mmol/L H2O2) 组、HMGB1(0.02mmol/L H2O2) 组、HMGB1(5mmol/L DTT)组细胞以每孔4×103个细胞密度接种到96 孔板中,每组5 个复孔。温育24h 后,更换含有10%CCK-8 溶液的培养基继续培养2h。然后,测定450nm 波长处吸光度(OD)值,重复3 次,每次取5孔平均值。
1.3.4 细胞迁移能力测定 8-μm 孔的Transwell 小室插入24 孔板中,将其腔室分成上室和下室。然后,将MSC 组、HMGB1 组、HMGB1(0.005mmol/L H2O2)组、HMGB1(0.01mmol/L H2O2)组、HMGB1(0.02mmol/L H2O2)组、HMGB1(5mmol/L DTT)组用融合度为80%的细胞消化并以每孔8×104个细胞接种于上室,温育24h。其中上室加入无血清培养基500μL,在下室中加入含15% FBS 的培养基750μL 以诱导细胞迁移。继续培养24h 后,将迁移到膜下侧的细胞使用甲醇固定15min,使用0.1%结晶紫溶液染色,用相差显微镜观察(200×)并随机选取5 个视野计数。重复实验5 次。
1.3.5 诱导体外培养的MSC 向血管细胞分化 将MSC 组、HMGB1 组、HMGB1(0.02mmol/L H2O2)组、HMGB1(5mmol/L DTT)组细胞放在含有5% FBS 和25μg/L PDGF-BB 的DMEM 中培养7 天以诱导其向血管平滑肌细胞(vessel smooth muscle cell,VSMC)分化。用25μg/L 的VEGF 代替PDGF-BB 诱导MSC 向血管内皮细胞(vascular endothelial cell,VEC)分化。通过流式细胞术和细胞免疫荧光实验检测CD31 和α-SMA的表达,分别鉴定分化成VEC 和VSMC 的细胞。
1.3.6 细胞免疫荧光实验 免疫荧光检测上述诱导分化后MSC 组、HMGB1 组、HMGB1(0.02mmol/L H2O2)组、HMGB1(5mmol/L DTT)组培养细胞中CD31、α-SMA 表达。用冷丙酮将上述诱导分化后的培养细胞冷冻切片固定并用10%山羊血清封闭;再用特定的一级抗体探测靶蛋白,然后通过与相应的荧光蛋白标记的二级抗体孵育显现;最后,使用4',6-二脒基-2-苯基吲哚(4',6-diamidine-2-phenylindole,DAPI)复染细胞核。在荧光显微镜下观察并拍照。
1.3.7 流式细胞术 流式细胞技术检测上述诱导分化后MSC 组、HMGB1 组、HMGB1(0.02mmol/L H2O2)组、HMGB1(5mmol/L DTT)组细胞表面CD31 和α-SMA。将上述各组细胞转移至5μL 流式管中并在4℃下避光与PE 偶联的流式抗体温育30min,然后洗涤细胞并使用磷酸盐缓冲液重悬。最后使用BD FACSCanto Ⅱ流式细胞仪定量荧光。
1.4 统计学方法 应用Graph-Pad Prism 6.0 统计软件分析处理数据,计量资料以均数±标准差()表示,组间比较采用Mann-Whitney 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞增殖情况比较 与MSC 组比较,HMGB1组显著抑制MSC 增殖(P<0.05),HMGB1(5mmol/L DTT)组促进MSC 增殖(P<0.05);与HMGB1 组比较,HMGB1(0.005mmol/L H2O2)组、HMGB1(0.01mmol/L H2O2)组、HMGB1(0.02mmol/L H2O2)组对MSC 增殖的抑制作用减弱甚至消失(P 均<0.05)。见表1。
2.2 细胞迁移能力比较 与MSC 组比较,HMGB1组促进MSC 迁移(P<0.05);与HMGB1 组比较,HMGB1(5mmol/L DTT)组对MSC 迁移的促进作用增强(P<0.05),HMGB1(0.005mmol/L H2O2)组、HMGB1(0.01mmol/L H2O2)组、HMGB1(0.02mmol/L H2O2)组对MSC 迁移的促进作用减弱甚至消失(P 均<0.05)。见表1、图1。
表1 各组细胞增殖及迁移能力比较()
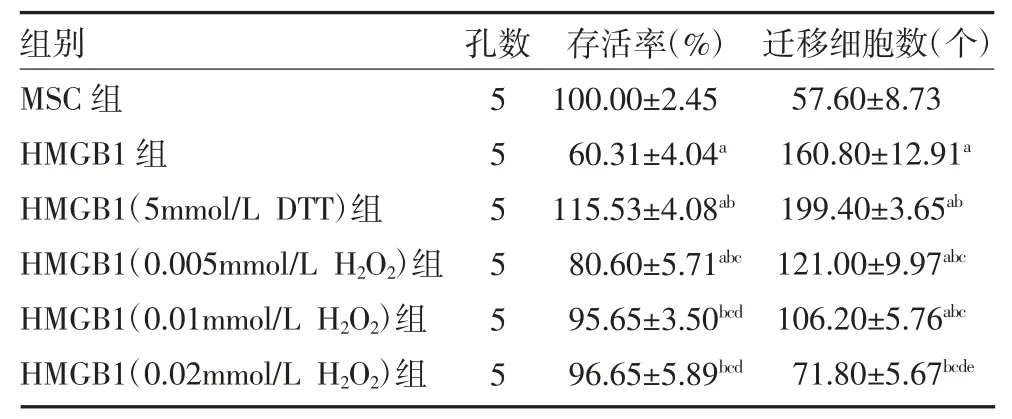
表1 各组细胞增殖及迁移能力比较()
注:MSC 组为未经处理的MSC;HMGB1 组为未经H2O2、DTT 处理的HMGB1;HMGB1(5mmol/L DTT)组为5mmol/L DTT 还原后HMGB1处理的MSC;HMGB1(0.005mmol/L、0.01mmol/L、0.02mmol/L H2O2)组为0.005mmol/L、0.01mmol/L、0.02mmol/L H2O2 氧化后HMGB1 处理的MSC;MSC 为间充质干细胞;HMGB1 为高迁移率族1 蛋白;DTT 为二硫苏糖醇;H2O2 为过氧化氢;与MSC 组比较,aP<0.05;与HMGB1 组比较,bP<0.05;与HMGB1(5mmol/L DTT)组比较,cP<0.05;与HMGB1(0.005mmol/L H2O2)组比较,dP<0.05;与HMGB1(0.01mmol/L H2O2)组比较,eP<0.05
2.3 各组MSC 细胞向血管内皮细胞分化比较 与MSC 组比较,HMGB1 组CD31 阳性细胞表达增加(P<0.05);与HMGB1 组比较,HMGB1(5mmol/L DTT)组可增强VEGF 诱导MSC 向CD31 阳性细胞分化的能力(P<0.05),HMGB1(0.02mmol/L H2O2)组上述能力减弱甚至消失(P<0.05)。见表2、图2。
2.4 各组MSC 细胞向血管平滑肌细胞分化比较与MSC 组比较,HMGB1 组抑制α-SMA 阳性细胞表达(P<0.05);与HMGB1 组比较,HMGB1(5mmol/L DTT)组α-SMA 阳性细胞表达明显降低(P<0.05),HMGB1(0.02mM H2O2)组升高(P<0.05)。见表2、图3。
2.5 氧化还原状态HMGB1 在动脉粥样硬化中的作用机制 HMGB1 抑制MSC 的增殖及其向血管平滑肌细胞分化,并促进MSC 向血管内皮细胞分化。在动脉粥样硬化的微环境中,氧化应激产生大量活性氧,使HMGB1 易被氧化而失活。根据上述研究结果,我们推论氧化还原状态的HMGB1 在动脉粥样硬化中的作用机制,见图4。
3 讨论
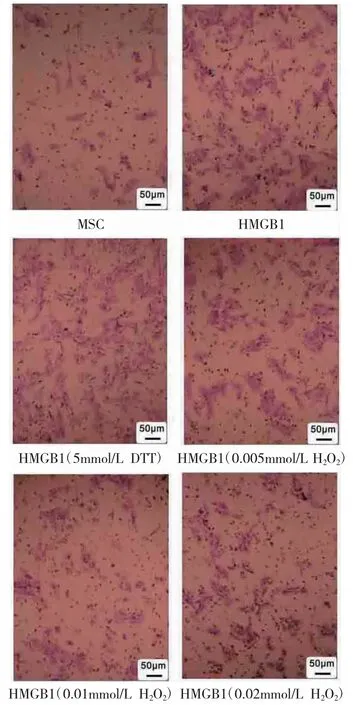
图1 Transwell 试验检测MSC 迁移能力(结晶紫染色×200)
动脉粥样硬化是心、脑血管疾病和周围血管疾病的主要原因,其特征是内皮下积聚大量脂肪物质、巨噬细胞和平滑肌细胞,导致慢性闭塞性血管病[6]。受累的动脉会逐渐形成充满血管平滑肌细胞和细胞外基质的增生性内膜层,该过程被称为内膜增生或新生内膜形成,并最终引起受累动脉狭窄[7]。MSC 增殖、迁移以修复血管损伤是目前研究热点,在临床研究中已取得满意的结果[8]。MSC 可在动员后进入血液循环及血管损伤位点并分化成内皮细胞加速再内皮化,维持血管内皮稳态(EC)[9]。研究表明,MSC 移植对治疗动脉硬化有效[10],我们前期研究发现,MSC 向血管细胞的分化受HMGB1 的影响,激活高迁移率族1 蛋白/晚期糖基化终末产物受体(HMGB1/RAGE)信号通路能够促进MSC 分化为血管内皮细胞并抑制血管内膜过度增生,抑制炎症细胞在移植动脉内膜中的浸润,从而抑制动脉硬化的发生[3]。HMGB1 是动脉粥样硬化的关键炎症介质。HMGB1 的许多胞内和胞外功能依赖于蛋白的氧化还原敏感半胱氨酸残基[11]。氧化应激与动脉粥样硬化的形成有关,氧化应激状态下活性氧(ROS)水平较高,主要是内源性促氧化酶活性与有利于活性氧的抗氧化酶活性失衡所致,过多的ROS 产生会诱导信号级联反应,导致促炎基因的表达、SMC 的生长和迁移[12-13]。HMGB1能够通过促进血管平滑肌细胞泡沫细胞的形成,促进动脉硬化发生发展[14]。在低氧的组织微环境中(如局部受损及缺血的血管组织),HMGB1 抑制多能血管干细胞向平滑肌细胞分化的能力会受到显著影响[2]。本研究通过使用DTT 及H2O2处理HMGB1,使其处于不同氧化还原状态,然后使用上述氧化还原状态HMGB1 处理体外培养MSC,还原状态HMGB1 能够促进MSC 增殖,并增强其对MSC 迁移的促进作用,而氧化状态的HMGB1 对MSC 增殖、迁移的影响减弱甚至消失。CD31 和α-SMA 分别为VEC 及VSMC细胞特异性标记分子,可通过检测CD31 和α-SMA的表达水平分析MSC 向VEC 及VSMC 分化情况[3]。
本研究结果显示,还原状态HMGB1 可增强其协调VEGF 诱导MSC 向CD31 阳性细胞分化的能力,并增强其对PDGF 诱导的MSC 向VSMC 分化的抑制作用;而氧化状态HMGB1 对MSC 向CD31 及α-SMA 阳性细胞分化的影响减弱甚至消失(P<0.05)。
表2 各组CD31 阳性细胞及α-SMA 阳性细胞比较(%,)
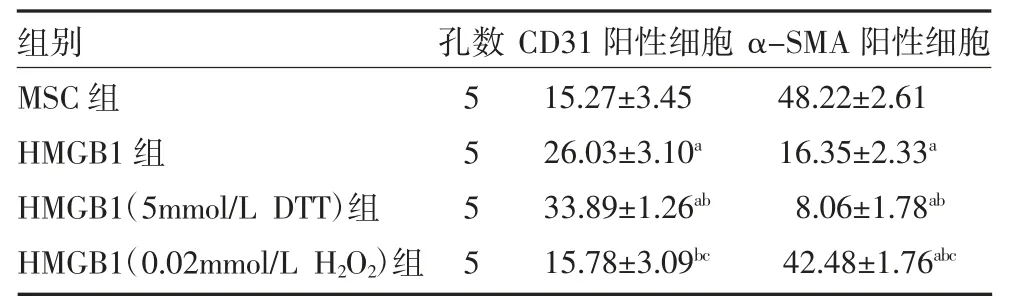
表2 各组CD31 阳性细胞及α-SMA 阳性细胞比较(%,)
注:MSC 组为未经处理的MSC;HMGB1 为未经H2O2、DTT 处理的HMGB1;HMGB1(5mmol/L DTT)组为5mmol/L DTT 还原后HMGB1处理的MSC;HMGB1(0.02mmol/L H2O2)组为0.02mmol/L H2O2 氧化后HMGB1 处理的MSC;MSC 为间充质干细胞;HMGB1 为高迁移率族1 蛋白;DTT 为二硫苏糖醇;H2O2 为过氧化氢;与MSC 组比较,aP<0.05;与HMGB1 组比较,bP<0.05;与HMGB1(5mmol/L DTT)组比较,cP<0.05
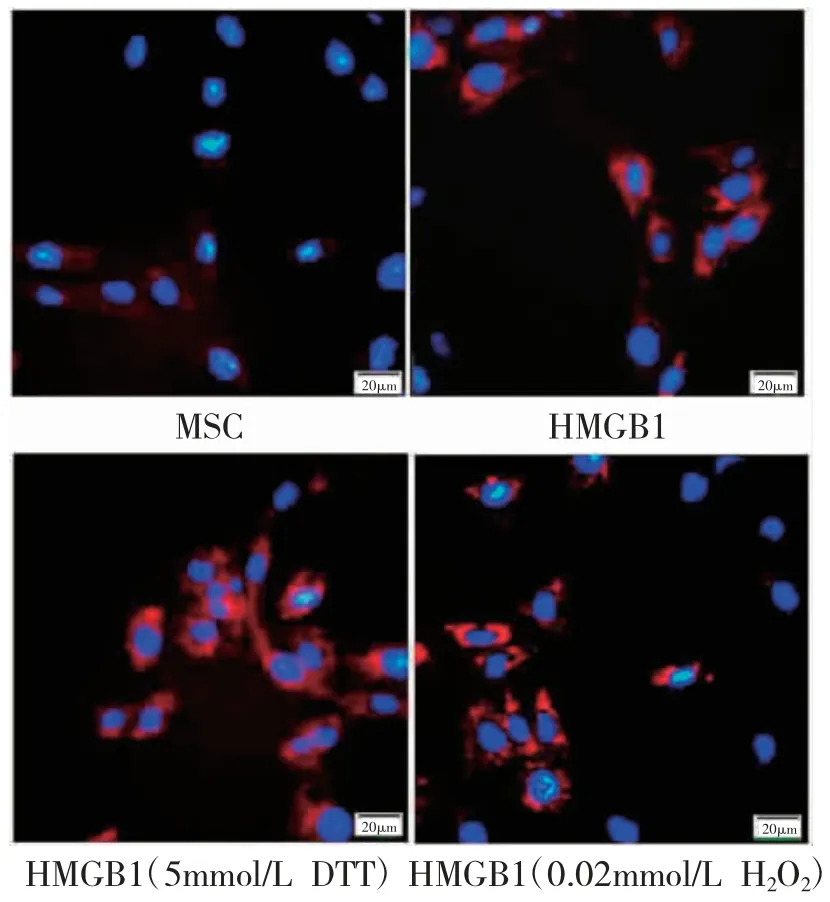
图2 免疫荧光试验检测CD31 阳性细胞
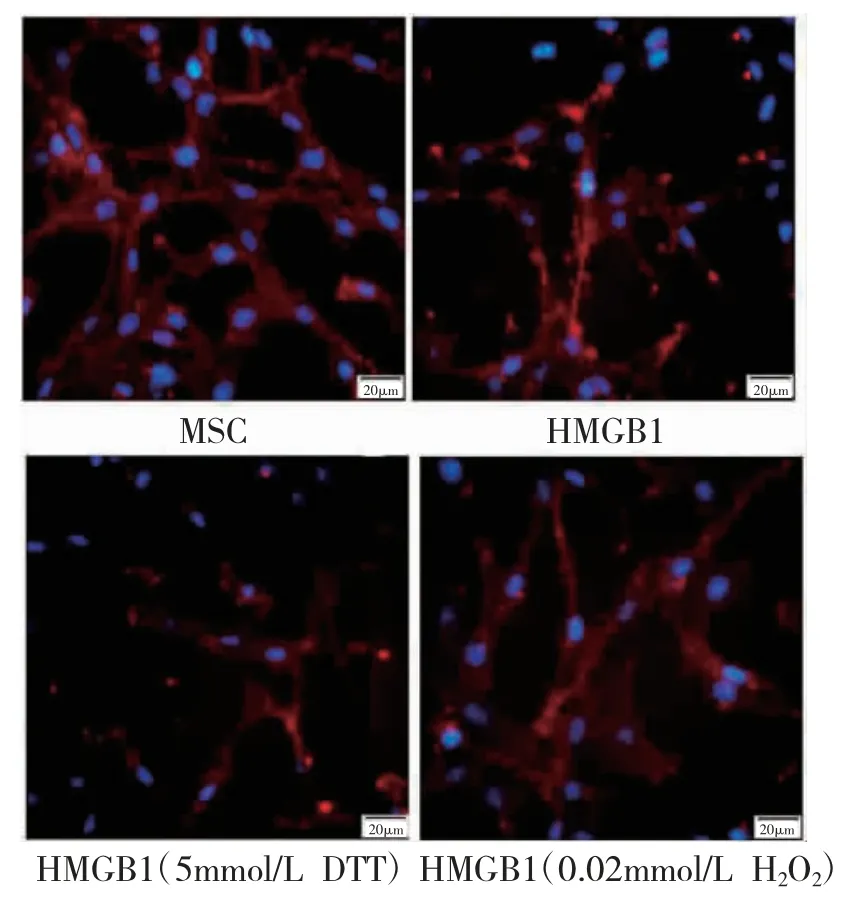
图3 免疫荧光试验检测α-SMA 阳性细胞(细胞免疫荧光染色×400)
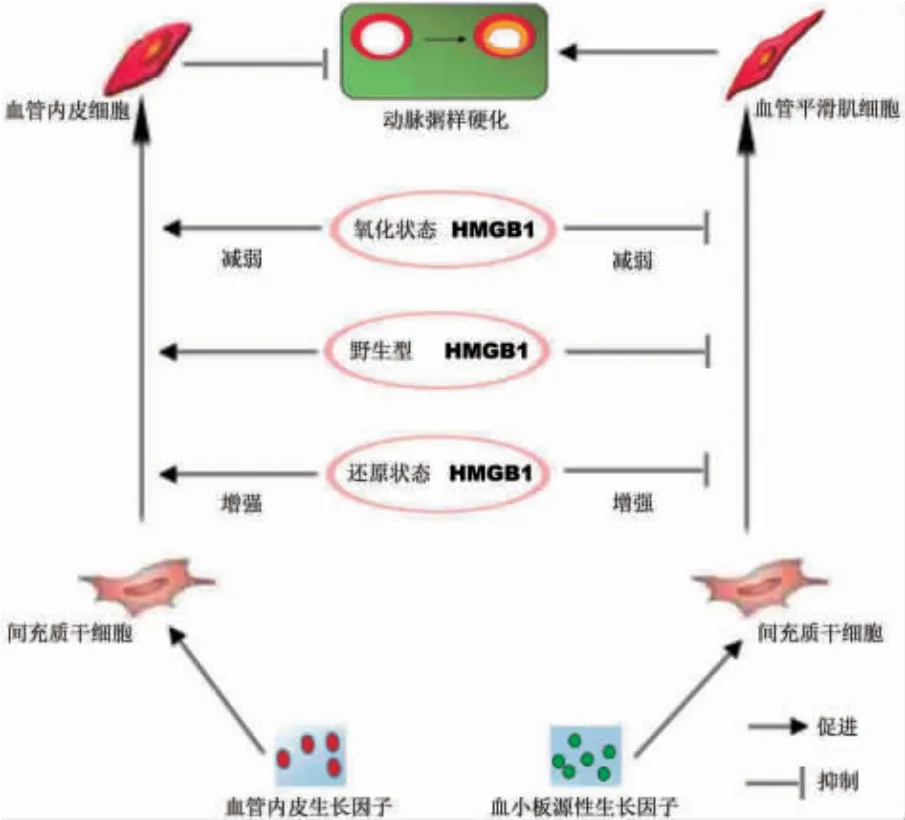
图4 氧化还原状态的HMGB1 在动脉粥样硬化中的作用机制
综上所述,还原状态HMGB1 能够促进MSC增殖,增强其对MSC 迁移及向VEC 分化的促进作用,并且增强其对MSC 向VSMC 分化的抑制作用,进而抑制动脉粥样硬化的发生及发展;而氧化状态HMGB1 对MSC 增殖、迁移及向上述血管细胞分化的影响减弱甚至消失,进而促进动脉粥样硬化。
