甲型肝炎灭活疫苗(MRC-5 细胞)中乙二胺四乙酸二钠残留量HPLC 检测方法的建立及验证
2021-01-19樊雪王一平李璇修雪亮廖辉周荔葆
樊雪,王一平,李璇,修雪亮,廖辉,周荔葆
辽宁成大生物股份有限公司研发部,辽宁沈阳110179
甲型肝炎(hepatitis A,HA)灭活疫苗(MRC-5 细胞)系将甲型肝炎病毒接种至人二倍体细胞中,经培养、收获、病毒纯化及灭活后,加入铝佐剂制成,用于预防甲型肝炎[1]。在HA 灭活疫苗生产工艺中,需加入乙二胺四乙酸二钠(EDTA-2Na)对细胞进行消化,后续工艺中可能有部分残留。EDTA-2Na 易与钙螯合,长期大剂量服用或静脉输注速度过快可引起低钙血症。研究表明,肾损伤、结核病及心脏功能损伤患者应慎用[2]。EDTA-2Na 与 FeCl3在酸性条件下发生络合反应,生成具有紫外吸收的稳定的络合物,因此可采用HPLC 法进行测定。目前,国内外HPLC 法检测EDTA-2Na 残留量主要应用于化学药品和食品领域[3-6],疫苗中EDTA-2Na 残留量检测的参考文献较少。
本文建立了检测HA 灭活疫苗(MRC-5 细胞)中EDTA-2Na 残留量的HPLC 法,并对方法进行验证。
1 材料与方法
1.1 供试品及对照品 3 批HA 灭活疫苗原液供试品(批号:HAV20170202-原、HAV20170301-原及HAV20170302-原)由辽宁成大生物股份有限公司生产;EDTA-2Na 对照品(批号:K1424041)购自美国阿拉丁公司。
1.2 主要试剂及仪器 乙腈(批号:137696)及磷酸(批号:158625)购自美国Fisher 公司;磷酸二氢铵(批号:C10079253)购自上海 Macklin 公司;40%四丁基氢氧化铵(批号:A1703020)购自美国阿拉丁公司;FeCl3(批号:STBG6072)购自美国Sigma 公司;LC-2010A 型高效液相色谱仪购自日本SHIMADZU 公司;C18 色谱柱(250 mm × 4.6 mm,5 μm)分别购自美国Thermo 公司和Waters 公司;所有试剂均为色谱纯。
1.3 色谱条件及优化 采用反相色谱柱。流动相为水相-有机相,水相为四丁基氢氧化铵的磷酸盐溶液(离子对试剂)[7-8],用磷酸调 pH,经 0.22 μm 滤膜过滤,超声,有机相为乙腈;流速为1.0 mL / min;检测波长为 257 nm[9-11];进样量为 20 μL;柱温为30 ℃;保留时间为10 min。供试品中EDTA-2Na 色谱峰的保留时间在7 ~9 min之间,分离度大于1.5的色谱条件为最适条件。
1.3.1 色谱柱的选择 因EDTA-2Na 与FeCl3反应生成的络合物与反相色谱柱上的非极性键合相之间有保留[7-8],分别考察美国 Waters 及 Thermo 公司的C18 色谱柱。
1.3.2 流动相的优化
1.3.2.1 水相与有机相的比例 因络合物的极性较大,考察不同比例的水相与有机相(8 ∶2、9 ∶1、9.5 ∶0.5)对色谱条件的影响。
1.3.2.2 pH 络合物在酸性条件下稳定,考察流动相不同pH(2.0、2.4 及3.0)对色谱条件的影响。
1.3.2.3 磷酸盐确定 分别取浓度为0.005、0.01及0.02 mol / L 的磷酸二氢钠及磷酸二氢铵,加水溶解至1 000 mL,再加入0.4 mol / L 四丁基氢氧化铵60 mL,考察不同磷酸盐对色谱条件的影响。
1.4 溶液的配制
1.4.1 FeCl3溶液 称取0.06 g FeCl3,溶于预先用磷酸调pH 至2.4 的500 mL 超纯水中,配制为0.012%FeCl3溶液。
1.4.2 对照品储备液 精密称取EDTA-2Na 对照品100 mg,置100 mL 容量瓶中,用超纯水溶解摇匀并定容,配制为 1 000 μg / mL EDTA-2Na 对照品储备液。
1.4.3 对照品工作液 精密量取对照品储备液1、0.5、0.25 及 0.1 mL,分别至 50 mL 容量瓶中定容,配制浓度为 20、10、5、2 μg /mL 对照品工作液。精密量取 10 μg / mL 对照品工作液 5、2.5、1、0.25 mL,分别至50 mL 容量瓶中定容,配制浓度为1、0.5、0.2、0.05 μg / mL 对照品工作液。
1.4.4 供试品溶液 取HAV20170302-原批供试品1 mL,加入 1 mL 0.012% FeCl3溶液,涡流混合 30 s,0.45 μm 滤膜过滤后备用。
1.4.5 空白溶液 取1 mL 超纯水,加入1 mL 0.012%FeCl3溶液,0.45 μm 滤膜过滤后备用。
1.5 方法的验证
1.5.1 系统适用性及专属性 取5 μg/mL 对照品工作液1 mL,加入1 mL 0.012% FeCl3溶液,涡流混合30 s,0.45 μm 滤膜过滤。按确定的色谱条件进样6 次,记录色谱图,测定理论塔板数及分离度。
1.5.2 线性范围 分别取 0.2、0.5、1、2、5、10、20 μg/mL对照品工作液1 mL,加入0.012% FeCl3溶液1 mL,涡流混合30 s,0.45 μm 滤膜过滤,按确定的色谱条件进行检测。以对照品工作液浓度为横坐标,峰面积为纵坐标,进行线性回归,绘制标准工作曲线。
1.5.3 准确度 精密量取3 份HAV20170302-原批供试品各 1mL,分别加入 2、5、10 μg / mL 对照品工作液1 mL,再加入等体积的 0.012% FeCl3溶液,涡流混合30 s,0.45 μm 滤膜过滤后,按确定的色谱条件进行检测,计算加标平均回收率及RSD。接受标准:RSD < 5% 。
1.5.4 精密度 精密量取6 份HAV20170302-原批供试品各 1 mL,加入 5 μg / mL 对照品工作液,再加入 1 mL 0.012%FeCl3溶液,涡流混合 30 s,0.45 μm滤膜过滤,按确定的色谱条件进行检测,验证重复性;次日由2 名试验员再次测定,验证中间精密度。计算平均EDTA-2Na 峰面积及RSD。接受标准:RSD <5%。
1.5.5 定量限及检测限 逐步稀释 5 μg / mL 对照品工作液,按确定的色谱条件进行检测。以信噪比(S / N)≥ 10 确定定量限,S / N ≥ 3 确定检测限。
1.5.6 耐用性 分别配制 pH 为 2.0、2.4 及 3.0 的流动相,取 5 μg / mL EDTA-2Na 对照品工作液,在每种流动相条件下进样6 次,计算色谱峰面积的RSD及相对误差(RE)。接受标准:RSD < 5%,RE 在95% ~105%之间。
1.6 方法的应用 取3 批供试品,按1.4.4 项制备供试品溶液,按确定的色谱条件进样检测,记录峰面积,计算EDTA-2Na 残留量。
2 结 果
2.1 色谱条件的确定
2.1.1 色谱柱 两厂家色谱柱上供试品中EDTA-2Na 的保留时间均为7 ~8 min、分离度均大于1.5、色谱峰对称性和柱效(理论塔板数大于10 000)均相似,均能达定量检测的要求,图略。综合考虑选用Thermo 公司的C18 色谱柱。
2.1.2 流动相
2.1.2.1 水相与有机相的比例 随着有机相比例的减少,EDTA-2Na 保留时间逐渐增加,水相与有机相比例为 8 ∶2、9 ∶1、9.5 ∶0.5 时,保留时间分别为5 ~ 6 、7 ~ 8 和 10 ~ 11 min,色谱峰分离度均大于1.5,图略。选择9 ∶1 为水相与有机相比例。
2.1.2.2 pH 流动相在 pH 为 2.0、2.4 及 3.0 条件下,供试品中EDTA-2Na 保留时间分别为5 ~6、7 ~ 8 和 10 ~ 11 min,分离度均大于 1.5,图略。选择2.4 为最适pH 值。
2.1.2.3 磷酸盐 磷酸二氢钠及磷酸二氢铵配制的流动相中,EDTA-2Na 的保留行为相近,二者浓度0.005、0.01 及 0.02 mol / L 时,保留时间均分别为4 ~ 5、7 ~ 8 和 11 ~ 12 min,分离度分别小于 1.5、大于1.5 和大于1.5,图略。综合考虑选择0.01 mol/L磷酸二氢铵为最适磷酸盐。
2.2 方法的验证
2.2.1 系统适用性及专属性 EDTA-2Na 对照品色谱峰的理论塔板数不低于10 000,分离度大于1.5,表明方法适用性良好。对照品溶液仅有EDTA-2Na色谱峰,无其他色谱峰干扰,空白溶液及供试品溶液未见该色谱峰,见图1,表明方法专属性良好。
2.2.2 线性范围 EDTA-2Na 对照品在 0.2 ~20 μg / mL 范围内,回归方程为 Y = 20 482.18 X +0.512 6,R2= 0.999 9,线性关系良好。标准曲线见图2。
2.2.3 准确度 3 个浓度加标样品的平均回收率分别为97.44%、100.6%及100.4%,RSD 为1.6%,见表1。表明方法准确度良好。
2.2.4 精密度 试验员A 重复检测6 次测得EDTA-2Na 峰面积的RSD 为1.4%;试验员A 及B 测得中间精密度的RSD 为1.6%。见表2。表明方法的精密度良好。
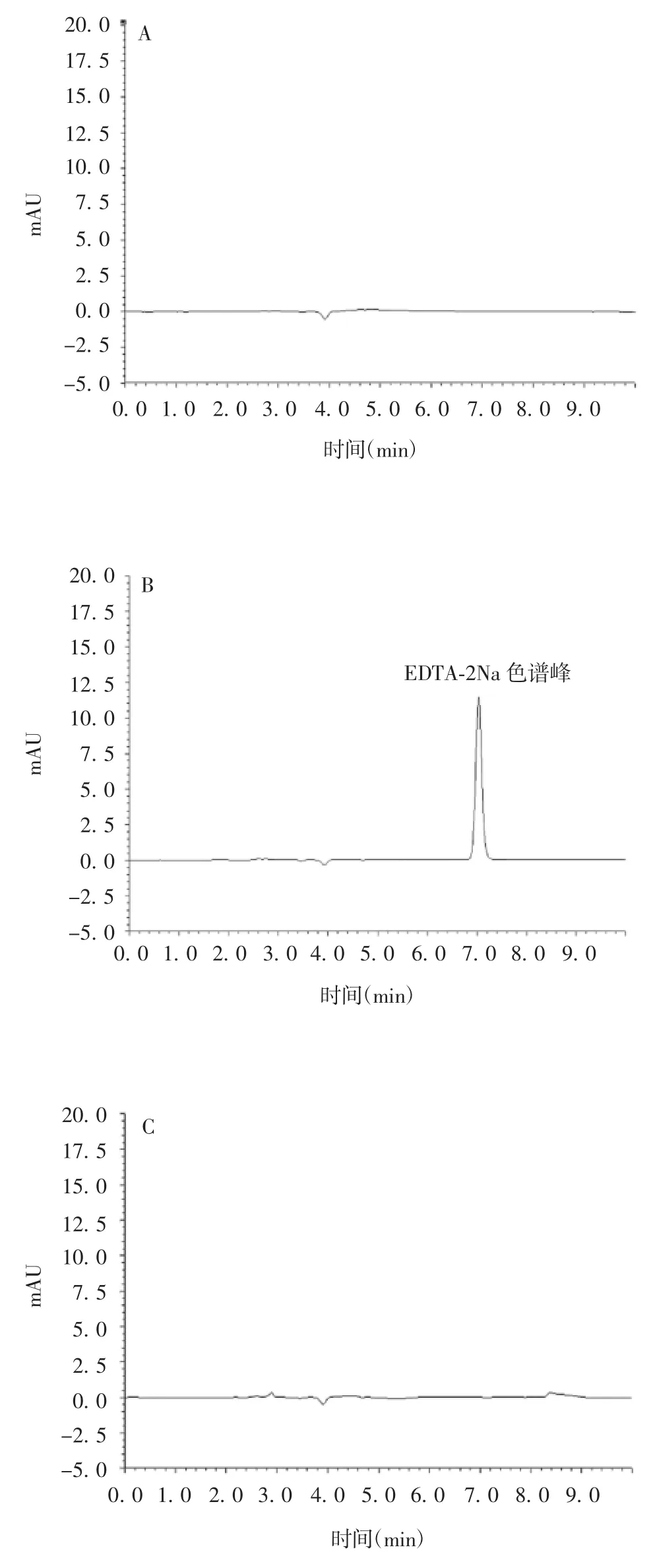
图1 空白溶剂(A)、对照品溶液(B)及供试品溶液(C)的高效液相色谱图Fig.1 HPLC profiles of blank solvent(A),reference(B)and test sample solution(C)

图2 EDTA-2Na 对照品的标准曲线Fig.2 Standard curve for reference for DETA-2Na
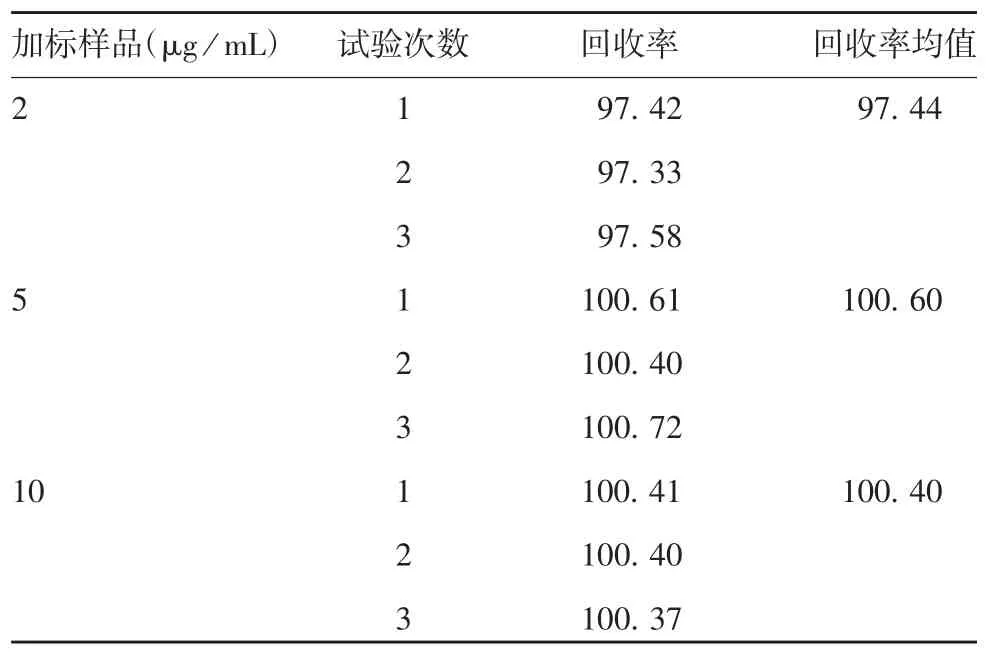
表1 加标样品的回收率(%)Tab.1 Recovery rates of spike samples(%)

表2 加标样品的精密度验证结果Tab.2 Precision test on spike samples
2.2.5 定量限及检测限 S / N 为 10 时,EDTA-2Na浓度为 0.2 μg / mL,即为方法的的定量限,S / N 为3 时,EDTA-2Na 浓度为 0.05 μg / mL,即为方法的的检测限。
2.2.6 耐用性 3 种pH 流动相检测6 次的色谱峰面积RSD 分别为0.24%、0.31%及0.18%;RE 分别为99.25%、99.12%及99.33%。见表3。
2.3 方法的应用 3 批供试品中均未检出EDTA-2Na。
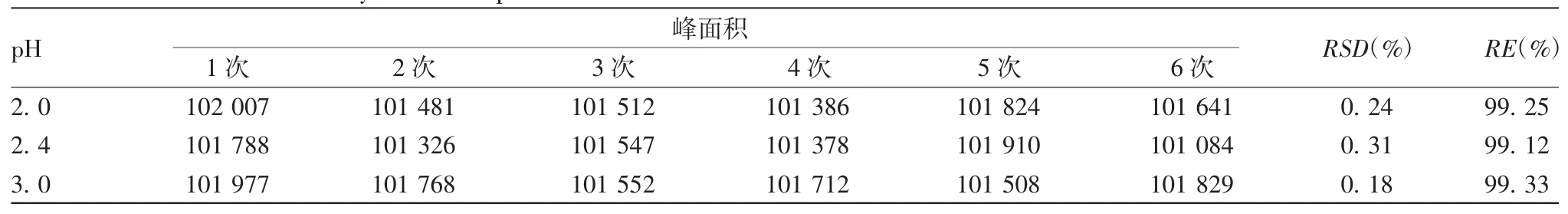
表3 流动相的耐用性验证结果Tab 3.Validation for durability of mobile phase
3 讨 论
本研究建立了检测HA 灭活疫苗(MRC-5 细胞)中EDTA-2Na 残留量的 HPLC 法,根据 EDTA-2Na 与FeCl3在酸性条件反应生成络合物的性质,采用反向色谱法,用四丁基氢氧化铵作为离子对试剂,调节流动相pH 值至酸性,考察磷酸二氢钠及磷酸二氢铵两种磷酸盐、不同浓度缓冲溶液(0.005、0.01 及0.02 mol / L)、水相与有机相不同比例、流动相的不同pH 值等条件,最终选择由0.01 mol / L 磷酸二氢铵缓冲液配制的四丁基氢氧化铵溶液作为水相,与乙腈比例9 ∶1 组成的流动相为最适条件[12]。本实验对流动相的不同pH(2.0、2.4 和3.0)进行分析,结果显示随pH 升高,待测物的保留时间逐渐增加,但各pH 条件下均能将待测物与杂质有效分离,且专属性良好,不干扰测定。但pH 为2.0 时已接近色谱柱的pH 耐受下限,长时间会影响色谱柱寿命,pH为3.0 时保留时间较长,影响分析效率。综合考虑选择2.4 为最适pH 值。
样品的前处理过程中需将配制好的酸性FeCl3溶液与供试品进行充分反应,生成稳定的络合物。本文将供试品进行充分旋涡混合,待反应完全后,再采用微孔滤膜过滤除去络合物沉淀及其他不溶性杂质,避免进样过程中堵塞色谱柱及色谱仪系统。
本研究成功建立了HA 灭活疫苗中EDTA-2Na 残留量的HPLC 检测方法,该方法具有良好的专属性、线性、准确度、精密度和耐用性,可用于测定本公司生产的HA 灭活疫苗(MRC-5 细胞)中EDTA-2Na 的残留量。
