3 种不同Protein A 亲和层析填料纯化抗CD52 单克隆抗体的比较
2021-01-19南建军秦海艳宋宪铭安晨宋兰兰赵晓瑞陈继军
南建军,秦海艳,宋宪铭,安晨,宋兰兰,赵晓瑞,陈继军
兰州生物制品研究所第四研究室甘肃省疫苗工程技术中心,甘肃兰州730046
Protein A 亲和层析填料一般是在琼脂糖或其他微球基架上连接Protein A 配基构成的聚合物微球,能特异性地与人免疫球蛋白的Fc 结构域结合[1]。Protein A 亲和层析填料以其高效的特异性捕获作用广泛用于单克隆抗体生产纯化工艺中,经一步捕获,多数单克隆抗体纯化可达90%以上[2]。不同厂家生产的Protein A 填料有各自不同的基架及键合技术[3],造成其填料对抗体的捕获载量及纯化效果的差异。
CD52 抗原分子广泛分布于B 淋巴细胞、T 淋巴细胞、NK 细胞、单核细胞、巨噬细胞表面,尤其在淋巴细胞上表达水平较高。抗CD52 单克隆抗体是一种靶向人CD52 抗原的基因工程抗体,可用于治疗慢性淋巴细胞白血病、T 细胞淋巴瘤等疾病[2]。
兰州生物制品研究所在抗CD52 单克隆抗体生产纯化方法中选择常用的Protein A 填料亲和层析。该方法捕获效率高,获得的抗体纯度理想,但所用填料需进口,货源单一,仅有美国GE 公司的Mab-Select SuRe 可选,且价格比较昂贵。
目前,随着技术的发展,中国市场出现了国产化的Protein A 亲和层析填料,常见的有Protein A Diamond 及 UniMab 50,其中 Protein A Diamond 与 Mabselect SuRe 填料均以交联琼脂糖作为基架,属软胶,UniMab 50 填料的基架为一种刚性物质,属硬胶。本文比较这3 种层析填料在抗CD52 单克隆抗体亲和纯化上载量及纯化效果,以期为生产工艺中填料的选择提供依据。
1 材料与方法
1.1 样品 3 批抗CD52 单克隆抗体培养上清样品(表1)及已纯化的抗CD52 单克隆抗体(浓度为1.24 mg / mL)均由兰州生物制品研究所第四研究室制备。

表1 3 批样品信息Tab.1 Data on three batches of samples
1.2 主要试剂及仪器 填料MabSelect SuRe(预装层析柱柱体积为4.7 mL)、AKTA avant 150 层析系统及微量分光光度计NanoVue 均购自美国GE 公司;Protein A Diamond 及 UniMab 50 分别购自 B 和N 公司,预装层析柱柱体积分别为4.2 及5.0 mL;残留宿主蛋白检测试剂盒、外源 DNA 检测试剂盒及Protein A 检测试剂盒均购自美国 Cygnus 公司;定量 PCR 预混试剂及ABI 7500 Fast 定量 PCR仪购自美国Thermo 公司;高效液相色谱仪购自沃特世科技(上海)有限公司;深层过滤器3M Zetaplus购自美国3 M 公司;MiliporePellicon 2 Mini Cassette 50 KD 膜包购自美国密理博公司;抗体纯度检测色谱柱(TSKgel Protein A-5PW)购自日本东曹株式会社。
1.3 样品处理 3 批样品用深层过滤器3M Zetaplus澄清过滤,过滤后用MiliporePellicon 2 Mini Cassette 50 KD 膜包超滤浓缩,抗体浓度控制在0.8 ~1.5 g/L范围。
1.4 填料载量的检测 填料载量以流穿液中抗体浓度达上样浓度10%时的上样量确定。3 种填料的标示载量均>30 mg / mL。每种填料载量检测时均上样抗CD52 单克隆抗体200 mg,确保其可流穿。分2 步上样,第 1 步上样 140 mL,不收集;第 2 步上样60 mL,收集流穿液,检测抗体浓度。计算每毫升填料达10%流穿时层析柱捕获的抗体量,即为最大动态载量,该最大动态载量的80%即为填料载量。
1.5 填料纯化效果的检测 使用3 种填料分别纯化3 批样品,每种填料按其测得的载量上样。按1.4 项每种填料的载量和每批样品的浓度确定3 批样品上样量(表2)。除样品上样量外,3 种填料纯化工艺参数保持一致,样品保留时间为4 min,洗脱pH 为3.70,检测波长为280 nm,当吸光度升至50 mAu 时开始收集,降至50 mAu 时停止。分别对洗脱收集液中各项指标进行检测。
浙江省水利工程管理改革、基层水利服务体系建设等2项全国水利改革试点已取得实质性进展。大中型水利工程项目法人制、中小型水利工程相对集中式项目法人及小微型水利工程农民自治管理模式等改革已取得初步成效。全省成立了1 023家基层水利服务机构、377个农村水利合作组织,在编在岗基层水利员2 560人,村级水务员12 724人。同时,连续几年多轮深化水行政审批改革,省级审批项目从20项减少到13项,非行政许可事项清理到2项,加快审批服务中介机构改革,省级审批承诺办理时间从20个工作日压缩到12个工作日。
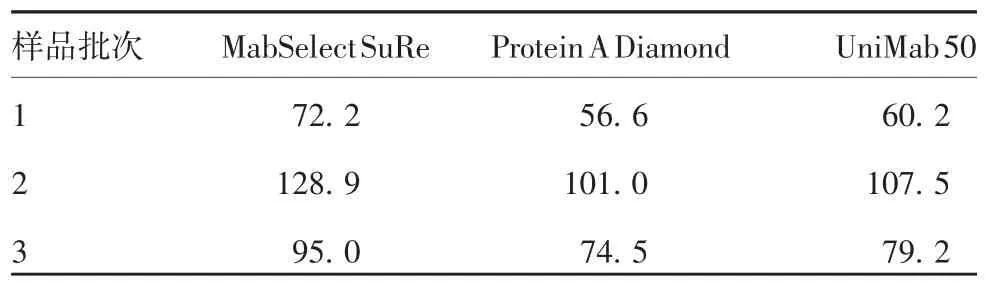
表2 3 批样品的上样量(mL)Tab.2 Loading of three batches of samples(mL)
1.5.1 洗脱体积 在AKTA avant 150 层析系统中,运行Evaluation 对应层析图谱,进行洗脱体积的积分。
1.5.2 抗体浓度 纯化后样品使用NanoVue 微量分光光度计检测抗体浓度,并按下式计算抗体回收率。
抗体回收率(%)= 洗脱收集液中抗体总量 / 上样的抗体总量× 100%
1.5.3 抗体纯度 采用分子排阻高效液相色谱(SECHPLC)法。抗体纯度主要指样品中单体含量。抗体纯度检测色谱柱用PBS 平衡后上样,使用PBS 缓冲液对样品进行分离,通过高效液相色谱仪系统中分析软件对波长280 nm 吸收色谱图进行积分,分析单体含量。计算3 批填料分别对同批样品纯化后单体含量的RSD。
1.5.4 电荷异质性 采用阳离子交换高效液相色谱(CEX-HPLC)法[4]。用高效液相色谱仪系统中分析软件对波长280 nm 吸收色谱图进行积分,分析洗脱收集液中中性、酸性及碱性电荷变异体的含量。
1.5.5 宿主蛋白残余量 采用 ELISA 法[5]。按残留宿主蛋白检测试剂盒说明书进行检测。
1.5.6 宿主 DNA 残余量 采用实时定量 PCR 法[6-7]。按外源DNA 检测试剂盒说明书进行检测。
2 结 果
2.1 填料的载量 填料MabSelect SuRe 载量最高,达38.4 mg /mL;UniMab 50 载量最低,为 30.1 mg /mL;ProteinADiamond载量介于以上两者之间,为33.8mg/mL。见表3。

表3 3 种填料的载量Tab.3 Loading capacities of three media
2.2 填料对样品的纯化效果
2.2.1 洗脱体积及抗体浓度 结果显示,3 批样品中,填料MabselectSuRe 的洗脱收集液体积最大,抗体浓度居中;填料Protein A Diamond 的洗脱收集液体积居中,抗体浓度最低;填料UniMab 50 的洗脱收集液体积最小,抗体浓度最高。见图1 和图2。
2.2.2 抗体回收率 结果显示,3 批样品经3 种填料纯化后的抗体回收率均大于85%,第3 批样品经填料Protein A Diamond 纯化后的抗体回收率略低于 UniMab 50 及 MabSelect SuRe,见图 3。

图1 3 种填料的洗脱收集液体积Fig.1 Volumes of eluate of three media

图2 3 种填料洗脱收集液中抗体浓度Fig.2 Antibody concentrations in eluate of three media
图3 3 种填料的洗脱收集液中抗体回收率Fig.3 Antibody recoveries in eluate of three media
2.2.3 抗体纯度 结果显示,3 种填料对同批样品纯化后单体含量均 >97%,RSD 均≤0.13%,见表4。
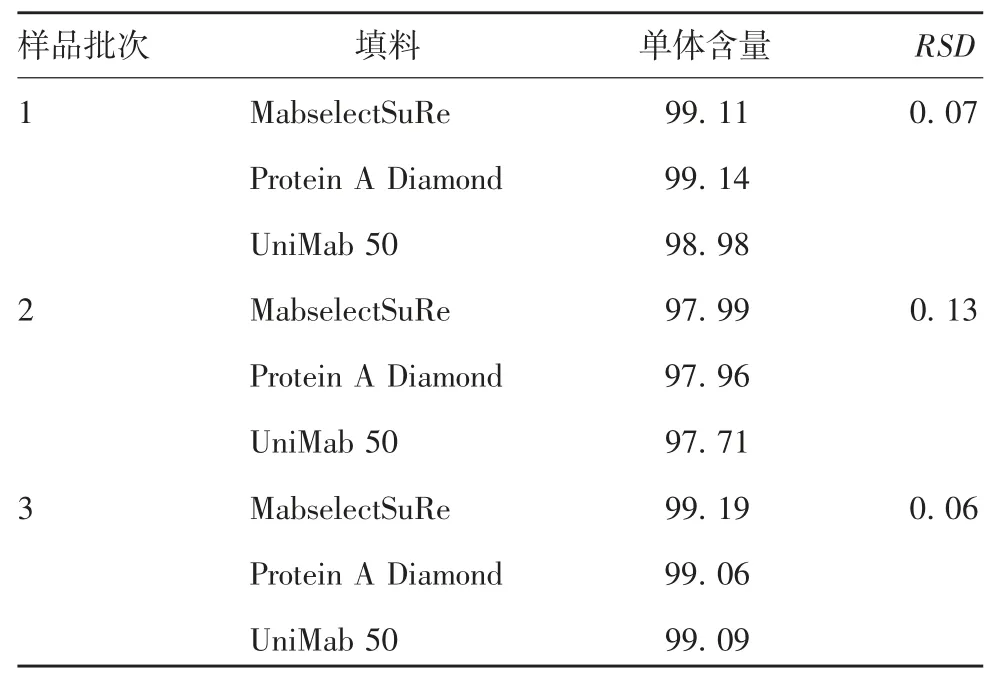
表4 3 种填料的洗脱收集液中单体含量(%)Tab.4 Monomer contents in eluate of three media(%)
2.2.4 电荷异质性 所有样品中,3 种填料的洗脱收集液中酸性及中性变异体含量接近,RSD 均<5%;碱性变异体含量均<5%。见表5。
2.2.5 宿主蛋白残余量 与纯化前样品比较,3 种填料对纯化后样品的宿主蛋白去除率均达2 log 以上,其中填料 Protein A Diamond 与 MabSelect SuRe 的残余宿主蛋白含量相当,均低于UniMab 50,见图4。
2.2.6 宿主DNA 残余量 与纯化前样品比较,3 种填料对纯化后样品的宿主DNA 去除率达3 log 以上,在同批样品中,3 种填料去除宿主DNA 效果相当;第3 批样品纯化后残余DNA 含量比其他2 批样品高,但仍在可接受范围内。见图5。
2.2.7 填料配基Protein A 脱落量 结果显示,3 批样品中,填料UniMab 50 的纯化样品中配基Protein A的脱落量均较Protein A Diamond 及MabSelect SuRe填料高,见图6。

图4 3 种填料的洗脱收集液中宿主蛋白残余量Fig.4 Residual host protein contents in eluate of three media
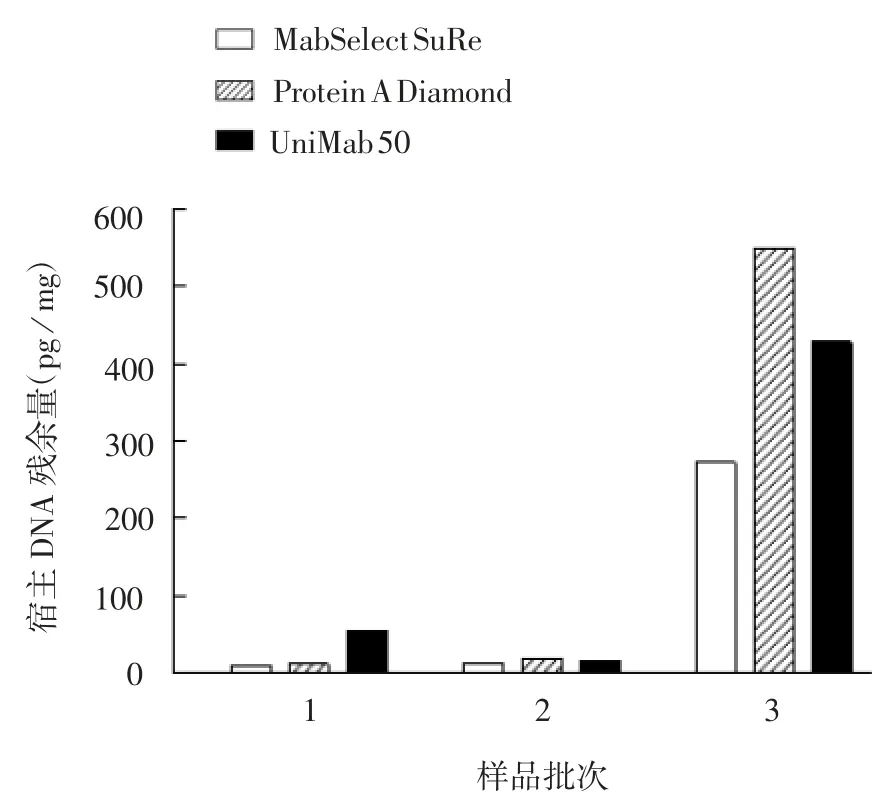
图5 3 种填料的洗脱收集液中宿主DNA 残余量Fig.5 Residual host DNA contents in eluate of three media

表5 3 种填料的洗脱收集液中电荷变异体含量(%)Tab.5 Charge variant contents in eluate of three media(%)

图6 洗脱收集液中3 种填料的配基Protein A 脱落量Fig.6 Protein A abscission in eluate of three media
3 讨 论
本研究选取的3 种填料均以Protein A 为配基来捕获抗体。填料Protein A Diamond 和MabSelect SuRe以交联琼脂糖作为基架,这种结构上的相似很可能是二者纯化效果接近的重要原因。填料UniMab 50以刚性介质为基架,意味着其拥有更好的耐压性能,从而能实现更高的柱床高度且能耐受更大的流速,液体在填料中的流动阻力较小,该填料表现出更小的洗脱体积及更高的洗脱收集液浓度,很可能与此有关。
3 批样品中,用3 种填料纯化第2 批样品时,洗脱收集液中聚体含量更高一些,纯化第3 批样品时,洗脱收集液中宿主DNA 残余量更高一些,这可能与样品本身如pH 值、电导率、物质成分等方面的差异相关。
本次3 种亲和层析填料对比试验是在MabSelect SuRe 填料优化后的工艺基础上进行的,未做过针对填料Protein A Diamond 及UniMab 50 的纯化工艺优化。适合填料MabSelect SuRe 的纯化条件,对Protein A Diamond 及UniMab 50 可能并不是最优的,很可能未达到最适的纯化效果。
3 种填料亲和纯化样品后,在抗体纯度、电荷异质性、残余宿主DNA 方面表现相当;填料Protein A Diamond 及 MabSelect SuRe 在载量、Protein A 脱落量、残余宿主蛋白方面表现相当,而UniMab 50 在这几方面的表现略差一些,但其在回收率、洗脱体积及抗体浓度上表现更好。
综上所述,3 种填料在抗CD52 单克隆抗体亲和纯化上各有优劣,但各项参数检测结果均在可接收范围内,均可满足该步纯化的要求[10],可根据工艺状况和质控要求的不同进行选择[11]。
