辽宁省2017—2019 年肠道病毒71 型灭活疫苗上市后疑似预防接种异常反应监测数据分析
2021-01-19常琳孙静王燕丛博方兴
常琳,孙静,王燕,丛博,方兴
辽宁省疾病预防控制中心,辽宁沈阳110005
肠道病毒 71 型(enterovirus type,EV71)为单股正链 RNA 病毒,小 RNA 病毒科,肠病毒属[1],1969年首次从美国加利福尼亚州一出现中枢神经系统感染症状婴儿粪便中分离得到[2]。EV71 在人体中存在广泛的受体,可与不同组织靶器官中的受体相结合[3],是导致重症手足口病的主要病原体。重症手足口病病情凶险,可迅速发展成脑炎、脑膜炎,呼吸衰竭。2007 年在山东临沂[4],2008 年在安徽阜阳[5]均发生过手足口病暴发疫情,在安徽阜阳有婴儿因此死亡。多项研究发现,我国每年防治由EV71 感染所致手足口病费用可达数亿至数十亿元[6-7]。目前尚无特异性的治疗方法,接种EV71 疫苗是预防EV71感染所致手足口病最有效的措施[8]。本文对辽宁省2017—2019 年报告的EV71 疫苗疑似预防接种异常反应(adverse event following immunization,AEFI)进行分析,以评价其预防接种的安全性,为本省科学使用EV71 疫苗提供依据。
1 资料与方法
1.1 数据来源 本文AEFI 监测数据来源于中国免疫规划信息管理系统,疫苗接种信息来源于辽宁省儿童全程免疫规划预防接种信息系统。
1.2 疫苗及免疫程序 Vero 细胞EV71 灭活疫苗[EV71 疫苗(Vero)]分别为武汉生物制品研究所有限责任公司和北京科兴生物制品有限公司生产,接种年龄段为6 月龄~3 周岁;人二倍体细胞EV71 灭活疫苗[EV71 疫苗(HD)]为中国医学科学院医学生物学研究所生产,接种年龄段为6 月龄 ~5 周岁。两种疫苗基础免疫程序均为2 剂次,间隔1 个月。目前在辽宁省为非免疫规划疫苗,遵循“知情,自愿,自费”原则接种。
1.3 AEFI 监测范围 24 h 内出现的过敏性休克、不伴休克的过敏反应、晕厥、癔症等;5 d 内出现的如发热(腋温 ≥ 38.5 ℃)、接种部位发生的红肿、硬结(直径 >2.5 cm)、全身或局部化脓性感染;15 d 内出现的如麻疹样或猩红热样皮疹、过敏性紫癜、局部过敏坏死反应、热性惊厥、癫痫、多发性神经炎、脑病、脑炎和脑膜炎等;6 周内出现的如血小板减少性紫癜、格林巴利综合征等;3 个月内出现的如臂丛神经炎、接种部位发生的无菌性脓肿等;怀疑与预防接种有关的其他AEFI。
1.4 AEFI 病例分类 报告的AEFI 经各级疾控机构、异常反应调查诊断专家组调查诊断或医学会鉴定后,可分类为不良反应(包括一般反应、异常反应)、疫苗质量事故、接种事故、偶合症和心因性反应。
1.5 统计学分析 采用描述性方法对EV71 疫苗AEFI 报告、发生特征及分类等情况进行分析。主要分析指标为EV71 疫苗AEFI 报告发生率,按下式计算,并采用χ2检验、Fisher 确切概率法等方法进行统计学检验,以P <0.05 为差异有统计学意义。使用微软电子表格(Microsoft Excel)和 SPSS 22.0 软件对数据进行管理和统计分析。本文所述所有发生率均为报告发生率。
AEFI 报告发生率( / 10 万剂次)= AEFI 病例报告数(例)/ EV71 疫苗接种数(剂次)× 10 万剂次
2 结 果
2.1 EV71 疫苗AEFI 发生特征分布情况
2.1.1 人群分布 2017—2019 年共报告EV71 疫苗AEFI 病例 83 例,男性 36 例,占 43.37%,女性 47例,占56.63%,男女性别比为0.74∶1。其中接种年龄小于 2 岁的 58 例(69.88%,39.29 / 10 万剂次),2 岁及以上的 25 例(30.12%,13.03 /10 万剂次)。见表 1。
2.1.2 时间分布 第1 季度报告EV71 疫苗AEFI病例 14 例(16.87%,15.40 / 10 万剂次),第 2 季度31 例(37.35%,19.71 / 10 万剂次),第 3 季度 23 例(27.71%,13.28/10 万剂次),第4 季度15 例(18.07%,11.78 / 10 万剂次)。见表 2。
2.1.3 接种-反应发生间隔分布 83 例EV71 疫苗AEFI 中,87.95%(73 例)在接种后 ≤ 1 d 发生,9.64%(8 例)在接种后 2 ~ 3 d 发生,2.41%(2 例)在接种后≥4 d 发生。
2.1.4 接种剂次分布 报告的83 例AEFI 中,发生在接种第 1 剂次后的有 54 例(65.06%,18.68 / 10 万剂次),第 2 剂次后的有 29 例(34.94%,11.17 / 10万剂次)。
2.2 AEFI 报告及分类情况 辽宁省2017 — 2019年共接种EV71 疫苗548 751 剂次,AEFI 报告发生率为 15.13 / 10 万剂次,其中 2017 年报告 10 例,报告发生率为 16.23 / 10 万剂次(接种 61 606 剂次);2018 年报告 48 例,报告发生率为 20.17 / 10万剂次(接种 237 997 剂次);2019 年报告 25 例,报告发生率为10.03 / 10 万剂次。全省总体疫苗AEFI 报告发生率为 31.01 / 10 万剂次(6 783 例),EV71 疫苗与总体疫苗AEFI 报告发生率差异有统计学意义(χ2= 44.32,P < 0.05)。EV71 疫苗 AEFI病例中分类为一般反应的 74 例(89.16%,13.49 / 10万剂次);异常反应的 3 例(3.61%,0.55 / 10 万剂次);偶合症 6 例(7.23%,1.09 / 10 万剂次);无心因性反应、疫苗质量事故和接种事故报告。EV71 疫苗(Vero)和EV71 疫苗(HD)AEFI 病例报告发生率分别为17.68 和13.55 / 10 万剂次,差异无统计学意义(χ2=1.46,P > 0.05)。见表 3。
2.3 不良反应临床损害分布情况 2017—2019 年EV71 疫苗不良反应报告发生数为77 例,发生率为14.13 / 10 万剂次。一般反应 74 例,其中出现发热的最多,为 64 例,发生率为 15.29 / 10 万剂次;注射局部红肿和硬结各1 例,发生率均为0.18 / 10 万剂次;报告的3 例异常反应病例临床诊断均为过敏性皮疹。见表4。

表1 辽宁省2017—2019 年EV71 疫苗AEFI 报告发生率年龄分布Tab.1 Distribution of reported incidence rate of AEFI of EV71 vaccine by age in Liaoning Province from 2017 to 2019
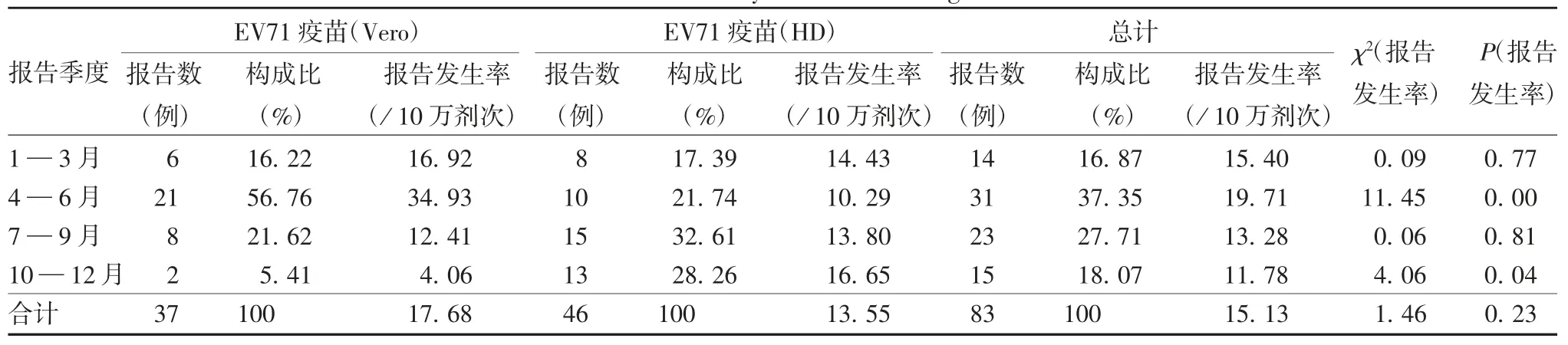
表2 辽宁省2017—2019 年EV71 疫苗AEFI 报告发生率时间分布Tab.2 Distribution of incidence rate of AEFI of EV71 vaccine by time in Liaoning Province from 2017 to 2019

表3 辽宁省2017—2019 年EV71 疫苗AEFI 报告发生率分类分布Tab.3 Classification of incidence rate of AEFI of EV71 vaccine in Liaoning Province from 2017 to 2019

表4 辽宁省2017—2019 年不同种类EV71 疫苗AEFI 不良反应临床损害分布Tab.4 Distribution of clinical lesion caused by adverse reactions in AEFI of EV71 vaccines of various kinds in Liaoning Province from 2017 to 2019
2.4 不良反应预后情况 77 例EV71 疫苗不良反应中,痊愈22 例,占28.57%;好转49 例,占63.64%;治疗5 例,占6.49%;不详1 例,占1.30%。
3 讨 论
EV71 疫苗作为我国具有自主知识产权的疫苗,在上市前的临床试验中已被证实具有良好的安全性和有效性[9-10]。辽宁省2017—2019 年EV71 疫苗 AEFI 报告发生率(15.13 / 10 万剂次)低于全省总体 AEFI 报告发生率(31.01 / 10 万剂次),且差异有统计学意义(χ2= 44.32,P < 0.05),低于 2016 —2017 年在浙江和湖北省进行的上市后被动监测研究报告发生率(119.56 和 57.11 / 10 万剂次)[11-12],一方面说明辽宁省EV71 疫苗安全性在预期范围内,另一方面也提示辽宁省EV71 疫苗AEFI 监测水平有待进一步提高。
报告EV71 疫苗AEFI 中以一般反应为主,74例,占 89.16%,反应发生率为 13.49 / 10 万剂次,一般反应临床损害以发热为主(64 例,86.49%)。分类为异常反应的EV71 疫苗AEFI 病例3 例,临床诊断均为过敏性皮疹,2017 — 2019 年辽宁省未收到江西省在2016—2018 年报告的过敏性紫癜、热性惊厥[13]等EV71 疫苗相关严重异常反应报告,可能与辽宁省EV71 疫苗接种剂次数较少有关。EV71 疫苗(Vero)和 EV71 疫苗(HD)两种疫苗 AEFI 报告发生率、不良反应报告发生率及不良反应各临床损害发生率差异均无统计学意义(P >0.05)。无导致死亡和严重残疾的不良反应报告。
本研究结果显示,辽宁省报告EV71 疫苗AEFI中,春季(4— 6 月)报告发生率较其他季节高,可能与春季儿童呼吸道传染病高发,一旦发热症状与接种疫苗存在时间关联,易误报为AEFI 病例有关。65.06%的病例发生在首剂接种后,与浙江省[11]、湖北省[12]研究结果一致,考虑或与首剂接种发生AEFI的病例第2 剂次接种意愿降低相关。大部分AEFI病例(87.95%)发生在接种后1 d 以内,提示接种后应告知家长重点关注受种儿童接种后1 d 内的健康状况。
综上所述,本研究认为辽宁省EV71 疫苗接种安全性在预期范围内,EV71 疫苗(Vero)与 EV71 疫苗(HD)安全性无差异。但目前辽宁省AEFI 监测方式主要为被动监测,监测敏感性较低,如需进一步明确本省EV71 疫苗不良反应的特征,应开展更为主动和全面的监测研究。
