沉默lncRNA CTD-2510F5.4抑制Huh-7人肝癌细胞增殖侵袭及RACGAP1表达
2021-01-19吴贤建王安民
吴贤建,路 远,石 凤,王安民,张 亚,浦 涧
(1.右江民族医学院研究生学院,广西 百色 533000;2.右江民族医学院附属医院肝胆外科,广西 百色 533000)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌类型,也是全球第六大最常见的癌症[1]。肝癌被认为是导致癌症死亡的第二大原因,全世界每年有700 000多例肝癌死亡[2]。早期肝癌患者通常没有任何症状,大多数肝癌患者在晚期被诊断出来,因此预后较差,5年总生存率低于10%[3]。HCC肿瘤发生和发展的分子机制尚未完全了解,揭示这些问题有助于开发HCC的新诊断与治疗方法。
长的非编码RNA(long noncoding RNA,lncRNA)是长度超过200个核苷酸的非蛋白质编码RNA[4]。越来越多的证据表明,lncRNA参与了许多基因调控的基本过程,包括对miRNA功能的调节[5-7],直接转录调控[8],基因沉默和染色质结构修饰[9]。lncRNA在许多肿瘤发生和发展中起着至关重要的作用[10-12]。CTD-2510F5.4 是最近被发现在肺癌[13]与胃癌[14]中显著高表达的lncRNA,但CTD-2510F5.4在肝癌中的研究未见相关报道。本研究通过TCGA数据库分析、沉默试验,检测CTD-2510F5.4沉默对体外Huh-7肝癌细胞增殖、侵袭、凋亡及RACGAP1的表达的影响,以探讨CTD-2510F5.4在肝癌发生发展中的作用及其可能机制。
1 材料与方法
1.1 实验材料与主要仪器
Huh-7人肝癌细胞购自上海生科院,RNA提取试剂盒购自天根生化科技(北京)有限公司,CCK8试剂盒购自北京全式金生物技术有限公司(FC101-03),DMEM培养基购自Hyclone公司(SH30022.01), lipo 3000购自Thermo Fisher公司(货号:L3000015),胎牛血清购自Gibco(42F7180K),Annexin V-PE/7-AAD双染细胞凋亡检测试剂盒购自Biolegend公司(640934),迁移小室购自Coring公司(3422),基质胶购自Coring公司(货号:354248), CTD-2510F5.4 siRNA与阴性对照载体购自湖州河马生物科技有限公司,序列:5'-GCAATATAGCAAGACACTGACTCTA-3', RACGAP1抗体(ab2270)与actin抗体(ab8226)购自abcam公司。
CO2培养箱购自Thermo Fisher公司(3111),流式细胞仪购自BECKMAN公司(CogtoFLEX),倒置荧光显微镜购自尼康公(DS-Fi3)。
1.2 实验方法
1.2.1TCGA数据库分析 本研究采用GEPIA数据库(http://gepia.cancer-pku.cn/index.html)对TCGA数据库中肝癌(Liver hepatocellular carcinoma,LIHC)进行分析,其中肝癌样本369例,正常样本50例。针对肝癌与正常样本中 CTD-2510F5.4与RACGAP1表达进行统计分析,并统计CTD-2510F5.4与RACGAP1表达相关性。
1.2.2细胞培养与转染 Huh-7人肝癌细胞培养在含10%胎牛血清的DMEM培养基,培养条件为5%CO2、37℃;胰酶消化后制成悬液,接种在细胞板中并进行后续处理。设计分组:CTD-2510F5.4沉默组与阴性载体对照组,使用lipo 3000将CTD-2510F5.4 siRNA和空载对照转染细胞,24 h后收集细胞进行后续检测。
1.2.3RT-PCR检测 各组处理后的细胞,加入20倍体积的TRIzol试剂进行裂解,用一次性注射器反复抽打细胞使得裂解充分,采用RNA提取试剂盒提取总RNA,反转录为cDNA,采用荧光定量PCR仪器进行检测。设计CTD-2510F5.4引物:GAPDH上游引物:5′- CCAGGTGGTCTCCTCTGA -3′,下游引物5′-GCTGTAGCCAAATCGTTGT-3′,RACGAP1上游引物:5′-AAGAGGTCTGACTGAGACAG-3′,下游引物:5′-GAAGGCTACAGATAGCATGG-3′采用2-ΔΔct法比较组间表达。
1.2.4CCK8检测 胰蛋白酶消化细胞,计数并以每孔中接种5×103个细胞,接种到96孔板中,每组3个重复。将包含CCK8试剂的100 μL培养基添加到每个孔中,并孵育4 h,吸出培养基,并添加150 μL二甲基亚砜以溶解,后将细胞置于酶标仪上,读取450 nm处的吸光值。
1.2.5流式检测凋亡 转染后的Huh-7细胞,每组3个复孔重复,1 500 r/min离心5 min后弃去上清,PBS 洗涤后重悬细胞,取细胞悬液 100 μL,加入5 mL Annexin V-7AAD染料进行染色15 min,后使用流式细胞仪进行检测。
1.2.6Transwell检测侵袭 无血清培养基重悬转染后细胞,加500 μL的含有10% FBS的培养基至下室,加300 μL已调节好细胞密度的细胞悬液(5×104个)至侵袭小室内;置于37℃、5% CO2细胞培养箱中培养48 h,取出小室,用4%多聚甲醛固定20 min,加500 μL结晶紫染色10 min,PBS冲洗100倍显微镜拍照。
1.2.7Western blot检测 转染后的细胞,在具有蛋白酶抑制剂的RIPA裂解缓冲液中裂解,通过8%的SDS-PAGE凝胶电泳分离总蛋白。将蛋白转移到膜上,并用5%脱脂牛奶封闭。然后将膜与一抗(RACGAP1或actin)孵育过夜,然后与辣根过氧化物酶偶联的第二抗体孵育。用增强的化学发光试剂检测蛋白条带。
1.3 统计学处理
2 结果
2.1 TCGA数据库分析
通过TCGA数据库中肝癌与正常样本进行分析,CTD-2510F5.4在肝癌样本中显著高表达,见图1A;RACGAP1在肝癌样本中显著高表达,见图1B;CTD-2510F5.4与RACGAP1在TCGA数据库肝癌样本中表达正相关(r=0.85),见图1C。
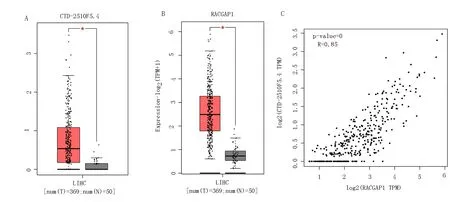
A: CTD-2510F5.4在TCGA数据库肝癌与正常表达;B:RACGAP1在TCGA数据库肝癌与正常表达;C:CTD-2510F5.4与RACGAP1在TCGA数据库肝癌中表达相关性图1 CTD-2510F5.4在TCGA数据库肝癌中的表达及与RACGAP1表达的相关性分析Fig 1 CTD-2510F5.4 is specifically and highly expressed in liver cancer cases from TCGA database and is positively correlated with RACGAP1 expression
2.2 CTD-2510F5.4沉默验证与增殖检测
转染后的细胞,转染效率均在90%以上,见图2A、2B。RT-PCR检测沉默组(si-CTD-2510F5.4)与对照组(NC)中CTD-2510F5.4表达,沉默组中CTD-2510F5.4相对表达为0.260±0.025,明显低于NC组中CTD-2510F5.4相对表达1.027±0.041(t=16.06,P<0.001),沉默效率为76.7%,见图2C。沉默后CCK8结果提示,沉默组相对NC组细胞增殖被抑制(t=20.02,P<0.001),见图2D。
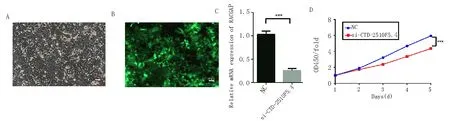
A:转染后Huh-7细胞(白光,100X);B:转染后Huh-7细胞(绿色荧光,100X);C:RT-PCR验证沉默效率;D:CCK8检测;与对照组比较,***P<0.001 vs. NC。图2 CTD-2510F5.4沉默后抑制肝癌细胞增殖Fig 2 CTD-2510F5.4 inhibits the proliferation of liver cancer cells after silencing
2.3 CTD-2510F5.4沉默后促进凋亡
采用流式细胞仪检测CTD-2510F5.4沉默后凋亡变化,结果提示,沉默组(si- CTD-2510F5.4)凋亡率为(7.243±0.049)%,明显高于对照组(NC)的凋亡率(3.113±0.139)%(t=28.09,P<0.001),见图3,提示CTD-2510F5.4沉默可以促进肝癌细胞Huh-7细胞凋亡。
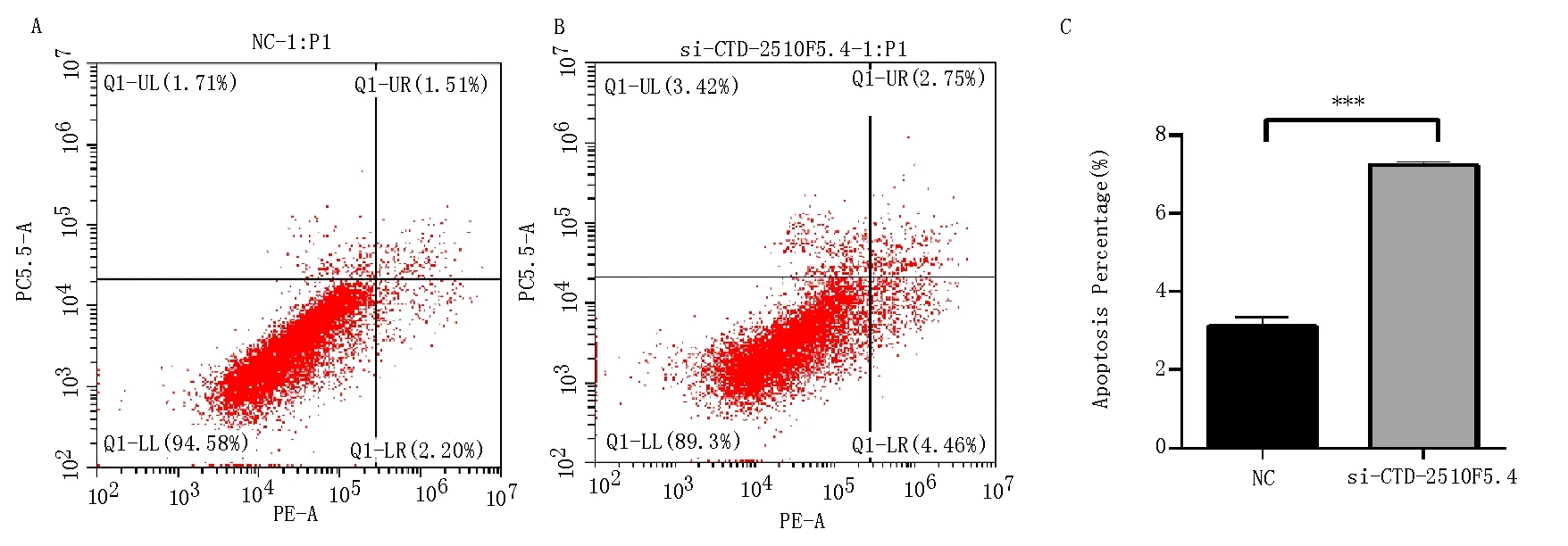
A:NC组;B:si-CTD-2510F5.4组;C:凋亡率统计图;与对照组比较,***P<0.001 vs. NC。图3 CTD-2510F5.4沉默后促进肝癌细胞凋亡Fig 3 CTD-2510F5.4 silencing promotes apoptosis of liver cancer cells
2.4 CTD-2510F5.4沉默后抑制侵袭
采用Transwell检测CTD-2510F5.4沉默后侵袭变化,结果提示,CTD-2510F5.4沉默组迁移细胞为(104.0±5.196)个,明显低于对照组(200.6±6.269)个(t=11.86,P=0.000 3),见图4,提示CTD-2510F5.4沉默可以抑制Huh-7肝癌细胞侵袭。
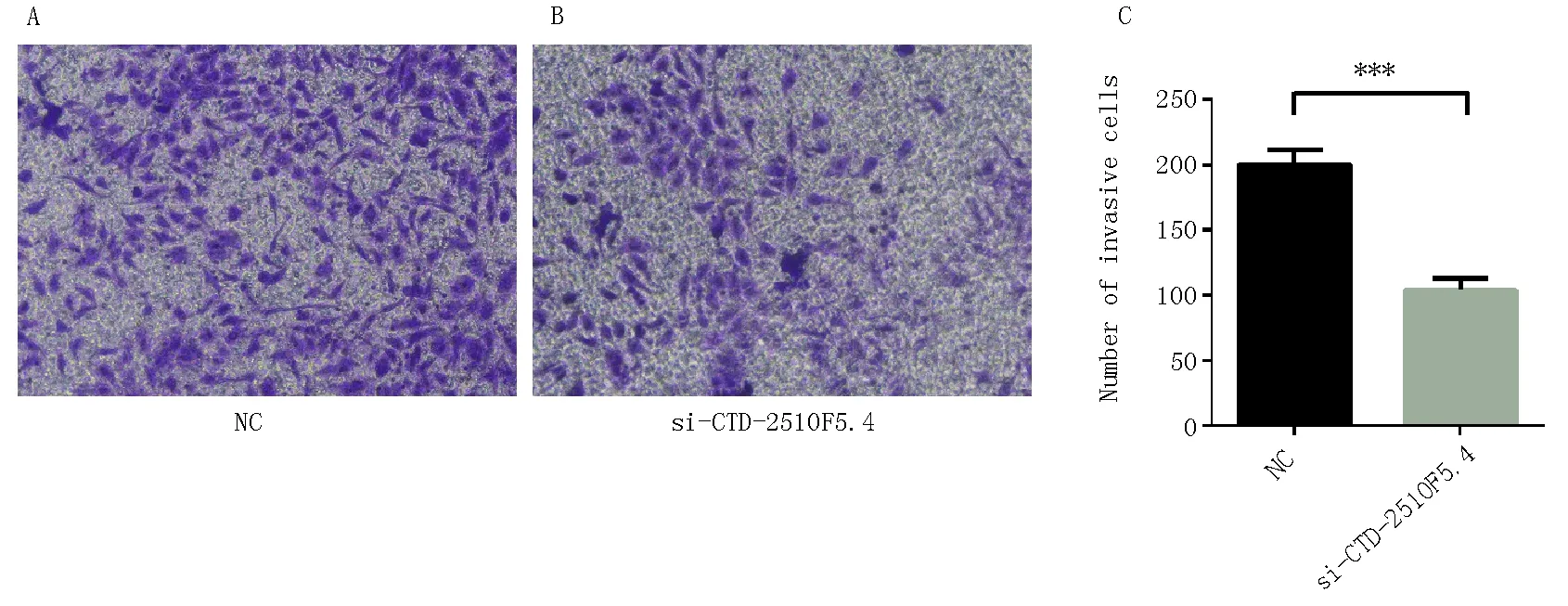
A:NC组;B:si-CTD-2510F5.4组;C:凋亡率统计图,拍摄倍数 100×;***P<0.001 vs. NC。图4 CTD-2510F5.4沉默后抑制肝癌细胞侵袭Fig 4 CTD-2510F5.4 suppresses invasion of liver cancer cells after silencing.
2.5 CTD-2510F5.4沉默后抑制RACGAP1表达
为探讨CTD-2510F5.4对增殖侵袭的可能机制,CTD-2510F5.4沉默后采用RT-PCR与Western blot检测RACGAP1表达影响。结果显示,CTD-2510F5.4沉默组中RACGAP mRNA相对表达为0.236±0.023,明显低于对照组中的1.006±0.075 2(t=9.799,P=0.006),见图5A,沉默组中RACGAP蛋白相对表达为0.591±0.020,明显低于对照组的0.934±0.088(t=3.789,P=0.019 3),见图5B、5C。提示,CTD-2510F5.4沉默后抑制RACGAP1 mRNA与蛋白表达。

A:RACGAP1 mRNA表达;B:RACGAP1蛋白表达条带;C:RACGAP1蛋白表达统计图;*P<0.05,***P<0.001 vs. NC。图5 CTD-2510F5.4沉默后抑制RACGAP1表达Fig 5 CTD-2510F5.4 inhibits RACGAP1 expression after silencing
3 讨论
肝细胞癌是人类最普遍和最具侵略性的恶性肿瘤之一[15]。尽管目前使用了各种治疗方法,HCC的临床预后仍然很差,尤其是在这些具有淋巴结转移或晚期肿瘤的HCC患者中[16]。缺乏适用于HCC诊断和治疗的分子标记是早期诊断率低及临床预后差的主要原因[17]。迫切需要更好地理解与评估肝癌的发病,以开发更具疗效的靶标疗法。
近年来,lncRNA在肝癌中重要作用已有较多报道[18-20]。在胃癌[14]中,CTD-2510F5.4是一种与恶性表型相关的lncRNA。但CTD-2510F5.4在肝癌发生发展中的作用尚未见研究报道。本研究通过对TCGA数据库分析发现,lncRNA CTD-2510F5.4在肝癌高表达。沉默试验发现,沉默CTD-2510F5.4能抑制Huh-7人肝癌细胞增殖及侵袭,并促进凋亡。提示,lncRNA CTD-2510F5.4可能是肝癌的致癌lncRNA。
RACGAP1是Rac GTPase激活蛋白1,可以负调控Rho蛋白[21],已被报道在多种肿瘤中具有重要作用[22, 23]。RACGAP1在肝癌中异常上调与肝癌的不良预后相关[24]。但CTD-2510F5.4与RACGAP1是否存在调控关系,目前尚不清楚。笔者对TCGA数据库研究及对CTD-2510F5.4沉默研究表明,lncRNA CTD-2510F5.4与RACGAP1表达呈正相关;抑制lncRNA CTD-2510F5.4可导致Huh-7人肝癌细胞的RACGAP1 mRNA与蛋白表达降低,提示RACGAP1可能是lncRNA CTD-2510F5.4的作用靶点。但lncRNA CTD-2510F5.4是否通过或如何通过RACGAP1影响肝癌细胞的增殖、侵袭及凋亡,尚需后续的进一步试验论证。
总之,本研究表明沉默lncRNA CTD-2510F5.4能抑制Huh-7人肝癌细胞增殖、侵袭,促进凋亡,并抑制RACGAP1表达。推测lncRNA CTD-2510F5.4可能是肝癌的致癌lncRNA,RACGAP1可能是lncRNA CTD-2510F5.4的作用靶点。这为进一步理解肝癌发病机制与开发诊断指标提供了参考。
