α1-抗胰蛋白酶联合骨髓间充质干细胞通过p38 MAPK/NF-κB信号通路调节糖尿病大鼠视网膜病变的研究
2021-01-19李春花王文军闫欢欢
陈 红,李春花,王文军,曾 戎,闫欢欢,张 宏
(1.西安市第四医院眼科,陕西 西安 710004;2.西安交通大学基础医学院,陕西 西安 710049)
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病最常见的并发症之一,由其导致的失明的发生率也越来越高[1]。越来越多的证据表明,微血管并发症是常见的糖尿病性视网膜病之一。慢性高血糖症会导致视网膜内皮细胞功能障碍,使周细胞减少和无细胞毛细血管形成,血管通透性增加和白细胞黏附[2,3]。尽管控制好血糖可以降低发生糖尿病视网膜病的风险,但是仍有血糖控制良好的患者中,疾病继续发展至晚期[4]。因此,迫切需要实施能够预防或减轻糖尿病视网膜病进展的新的有效治疗策略。近年来,干细胞疗法为临床治疗糖尿病视网膜疾病提供了新的治疗思路[5]。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSC)是来源于骨髓的一类非造血干细胞,具有增殖力强、分化潜力大与免疫原性低等优点,已有研究表明,其在DR中能够发挥一定的作用[6,7]。α1-抗胰蛋白酶(α1-antitrypsin)是一种主要由肝细胞滑面内质网联合高尔基复合体共同参与合成的糖蛋白[8],可抑制蛋白酶过度活化引发的组织损伤,在炎症急性期α1-抗胰蛋白酶血清水平明显增高以减轻炎性反应对机体的损害[9]。本研究运用α1-抗胰蛋白酶联合BMSC移植对DR大鼠进行干预,探究其对DR的治疗效果及作用机制。
1 材料与方法
1.1 材料
实验动物:SPF级雄性Wistar大鼠购自西安交通大学实验动物中心,体重为200~250 g,饲养在温度为20~25 ℃,湿度为35%~40%的动物饲养箱内,饲养室定期进行消毒。本研究所做实验获得伦理委员会批准,符合实验动物管理条例。
主要试剂:α1-抗胰蛋白酶(美国 Sigma公司),Wistar大鼠BMSC(美国ATCC公司),IL-1β、IL-6、TNF-α ELISA试剂盒及胰岛素检测试剂盒(北京索莱宝科技有限公司),苏木素-伊红(HE)染色试剂盒(北京百奥莱博公司),免疫组化试剂盒(北京中杉生物公司),TUNEL凋亡检测试剂盒(美国 Roche 公司),Trizol试剂、PrimeScriptTM RT试剂盒与SYBR Premix ExTaqTM PCR试剂盒(日本Takara 公司),山羊抗小鼠CD45单克隆抗体(美国 R&D 公司),RIPA 裂解缓冲液、BCA试剂盒与ECL化学发光液(上海碧云天生物研究所),兔抗p38、p-p38、p65、p-p65、p-IκBα、IκBα及辣根过氧化物酶标记羊抗兔IgG抗体(美国Abcam 公司)。
1.2 方法
1.2.1造模及分组 将50只体重为200~250 g的健康雄性Wistar大鼠随机分为两组,对照组10只,实验组40只。实验组大鼠参考文献[10]方法建立DR模型,使用高脂高糖的饲料喂养8周,对照组大鼠使用基础饲料进行喂养。8周后所有大鼠均禁食12 h,实验组腹腔注射60 mg/kg链脲佐菌素,对照组注射等体积的生理盐水,连续注射5 d,第7天时断尾并采集大鼠尾部静脉血进行血糖检测,当血糖>11.1 mmol/L时说明建模成功。将造模成功的36只大鼠给予基础饲料进行喂养自由活动4周后,观察大鼠眼底出现视网膜出血、毛细血管扩张及动静脉异常等情况。
1.2.2给药处理 将糖尿病视网膜病变模型建模成功的30只大鼠随机分为模型组、BMSC组、联合组(BMSC+α1-抗胰蛋白酶),每组10只。将BMSC与LG-DMEM混匀,制备细胞悬液,造模后24 h,BMSC组经视网膜注射300 μL BMSC悬液(含5×106个细胞),并注射生理盐水。联合组注射BMSC悬液的同时,给予腹腔注射α1-抗胰蛋白酶(100 mg/kg),每天注射一次,连续注射3 d。持续4周正常饲养后,将大鼠禁食过夜,次日麻醉后通过心脏穿刺收集血液,并迅速解剖视网膜,在预冷的磷酸盐缓冲盐水中冲洗,以去除视网膜上的血渍,将左视网膜组织固定于10%福尔马林液中,右视网膜组织在液氮中速冻后,保存于-80℃。
1.2.3大鼠血清血糖值、胰岛素水平检测 实验结束后,处死大鼠前测定各组大鼠血糖和血清胰岛素水平。使用罗氏血糖仪测定大鼠血糖,采用胰岛素检测试剂盒测定胰岛素含量,具体步骤按说明书进行。
1.2.4大鼠血清炎症因子IL-1β、IL-6和TNF-α检测 将处死大鼠后收集的各组大鼠血液在低温离心机中以3 000 r/min离心20 min,静置后收集分离的上层血清,ELISA法测定血清液中IL-1β、IL-6 和TNF-α的含量,具体步骤按说明书进行。
1.2.5大鼠视网膜组织病理学观察 将固定于在福尔马林缓冲液中各组大鼠视网膜组织,进行石蜡包埋,切成厚度约为5 μm的切片,常规脱蜡,在梯度酒精中水化。苏木精染色5 min,流水冲洗后,伊红染色液染色3 min,经脱水、透明后,使用中性树胶封片,光镜下观察并拍照。
1.2.6TUNEL染色 各组大鼠视网膜组织石蜡切片在60℃下烤片2 h脱蜡,加入20 μg/mL 不含 DNase 的蛋白酶 K,室温孵育 30 min,滴加50 μL TUNEL 检测液于样品上,在37℃下孵育 1 h,再加入过氧化物酶转化剂37℃孵育30 min,冲洗后滴加DAPI染液,室温避光孵育10 min后封片。于光学显微镜下观察计数TUNEL阳性细胞数,视网膜神经节细胞的阳性凋亡细胞表现为细胞质凝集,胞核固缩,核染呈绿色。
1.2.7免疫组织化学染色 将各组大鼠视网膜组织石蜡切片脱蜡脱水,采用柠檬酸在高温下进行组织抗原修复,将切片在3%H2O2中孵育10 min来封闭内源性过氧化物酶活性。然后加入山羊血清在37 ℃下孵育1 h以阻断非特异性标记,滴加CD45单克隆抗体(1∶100)在4 ℃孵育过夜。次日,用PBS洗涤3次后,在室温下与二抗孵育1 h。PBS洗涤,加 DAB染色,苏木精复染,二甲苯透明后中性树胶封片,光镜下观察并拍照。
1.2.8实时荧光定量 PCR检测各组大鼠视网膜组织中VEGF、HIF-1α、ANGⅡ mRNA的表达 使用Trizol试剂提取视网膜组织总RNA,根据PrimeScriptTM RT试剂盒反转录得到cDNA。以cDNA为底物进行 qRT-PCR 扩增,根据SYBR Premix ExTaqTM PCR试剂盒进行操作,以GAPDH为内参基因。扩增条件是在95 ℃下进行10 min,并在以下参数下进行40个循环:95°C 30 s, 56°C 30 s,72°C 1 min。具体序列如下:VEGF(上游引物: 5'-GGCGAGGCAGCTTGAGTTAC-3', 下游引物:5'-CTGTCGACGGTGACGATGGT-3'),HIF-1α(上游引物:5'-CGCGAACGACAAGAAAAAGGC-3', 下游引物:5'-CGTATATAAAGATGCGAACTCAC-3'),ANG Ⅱ(上游引物:5'-CAGAAGAATGGAAGAGTCTCAG-3', 下游引物:5'-CAGATATGCAGGGAGTCACC-3'),GAPDH(上游引物:5'-AGTATGACTCCACTCACG GCAA-3',下游引物:5'-TCTCGCTCCTGGAAGATGGT-3')。使用2-ΔΔCt法来计算各基因mRNA的相对表达量。
1.2.9Western blot法检测各组大鼠视网膜组织中p38MAPK/NF-κB信号通路相关蛋白表达 使用RIPA 裂解缓冲液对视网膜组织总蛋白进行裂解提取,BCA试剂盒进行检测定量。以25 μg蛋白加样并用10% SDS-PAGE凝胶分离蛋白质,电转印至硝酸纤维素膜上。5%脱脂奶粉室温封闭2 h,TBST洗膜。加入稀释后的兔抗p38、p-p38、p65、p-p65、p-IκBα与IκBα为一抗,4℃下孵育过夜。TBST洗膜后,加入稀释的二抗,室温孵育1 h,TBST洗膜,采用ECL液显色,凝胶成像系统拍照,Image Pro Plus分析蛋白条带。
1.3 统计学处理
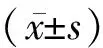
2 结果
2.1 各组血糖与胰岛素的变化
与对照组比较,模型组血糖明显增加,胰岛素水平则明显下降;与模型组比较,BMSC组和联合组血糖明显降低而胰岛素含量明显增加,且联合组血糖的降低与胰岛素含量的增加较BMSC组更为明显,差异均有统计学意义(P<0.05),见表1。

表1 各组血糖与胰岛素含量比较
2.2 各组血清中IL-1β、IL-6 和TNF-α含量比较
模型组血清中IL-1β、IL-6 和TNF-α含量较对照组明显升高;与模型组比较,BMSC组和联合组血清中IL-1β、IL-6 和TNF-α含量均明显下降,且联合组IL-1β、IL-6 和TNF-α含量小于BMSC组,差异均有统计学意义(P<0.05),见表2。

表2 各组血清中IL-1β、IL-6 和TNF-α含量比较
2.3 各组视网膜病理组织学观察
对照组视网膜各层细胞结构清楚、排列整齐;模型组视网膜内出现明显水肿,各层细胞排列杂乱;BMSC组视网膜内水肿有所减轻,但仍出现内外核层细胞排列不整齐;联合组大鼠视网膜内界膜水肿明显减轻,各层细胞排列趋于规则,未见明显异常。见图1。
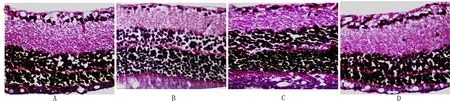
A:对照组 B:模型组 C: BMSC组 D: 联合组 图1 各组视网膜病理组织学观察图 (HE染色,×200)Fig 1 Histopathological observation of retina of rats in each group (HE staining, ×200)
2.4 各组视网膜神经细胞凋亡检测
对照组视网膜未见阳性细胞;模型组视网膜内大量阳性细胞表达,细胞凋亡指数(AI) 明显高于对照组;BMSC组和联合组视网膜发现部分阳性细胞,BMSC组、联合组视网膜细胞AI 明显低于模型组,而联合组视网膜阳性细胞数明显低于BMSC组,差异均有统计学意义(P<0.05), 见表 3、图 2。
2.5 各组视网膜组织CD45表达比较
CD45在对照组大鼠视网膜中表达很弱,而在模型组大鼠视网膜中表达较强,染色为棕黄色和褐色。与模型组比较,BMSC组和联合组大鼠视网膜中CD45的表达明显减弱,与BMSC组比较,联合组减弱更明显,见图3。

表3 各组视网膜神经细胞AI比较
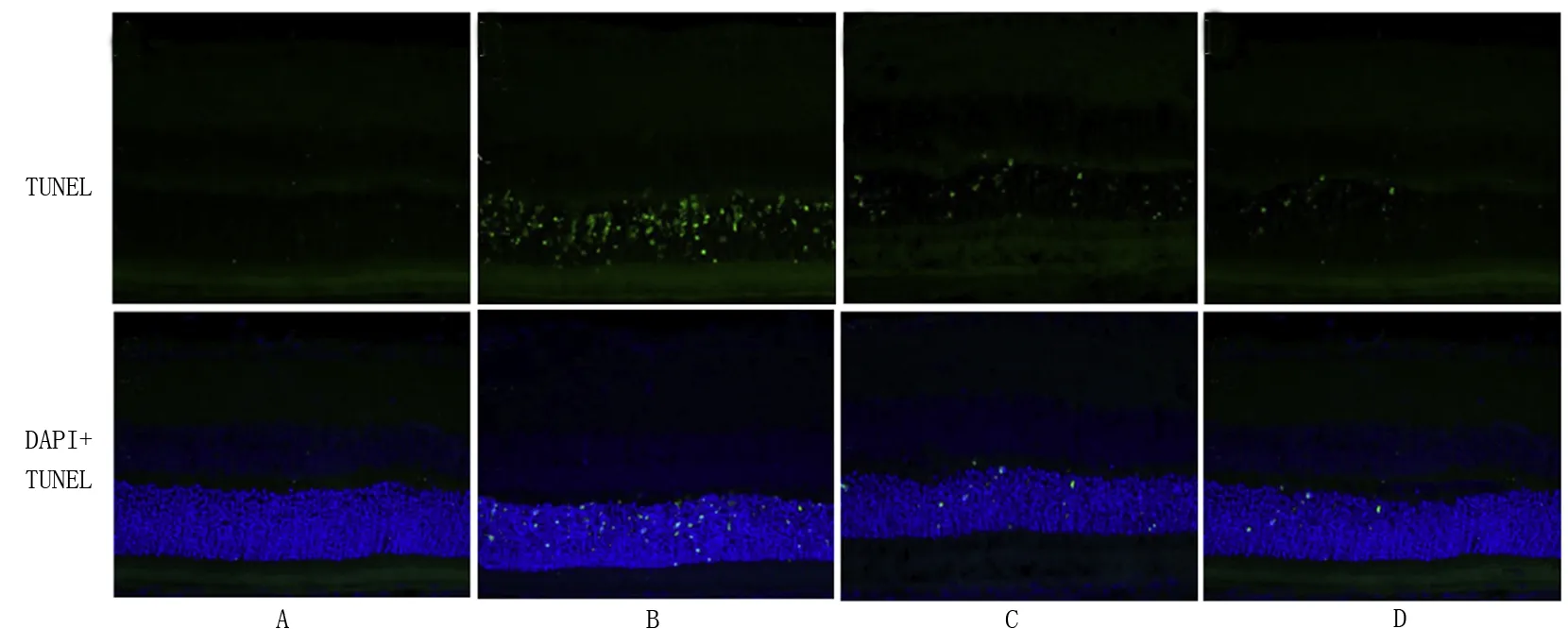
A:对照组; B:模型组; C: BMSC组; D: 联合组 图2各组视网膜神经细胞凋亡检测(TUNEL染色,×100)Fig 2 Detection of apoptosis of retinal nerve cells in each group (TUNEL staining, ×100).
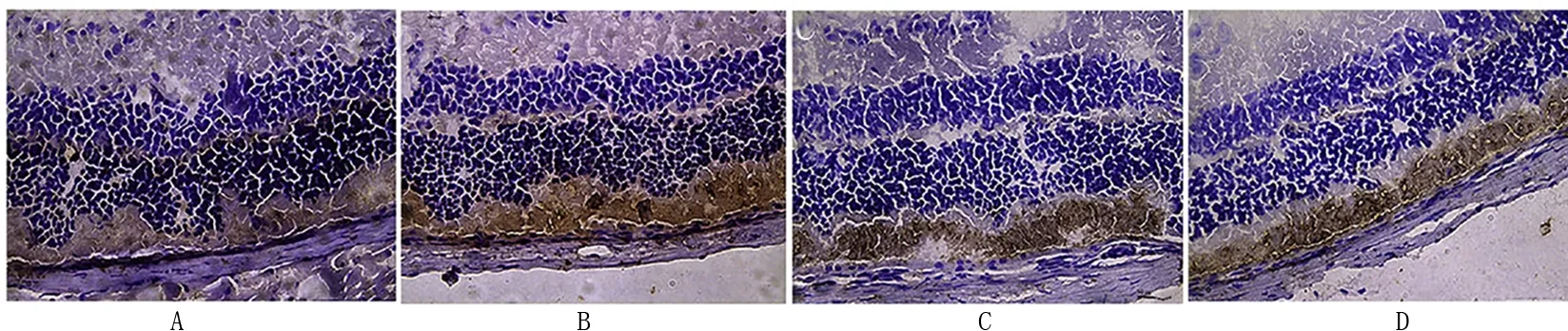
A:对照组; B:模型组; C: BMSC组; D: 联合组 图3 各组视网膜组织 CD45表达检测(免疫组化染色,×200)Fig 3 The expression of CD45 in retina of rats in each group (immunohistochemistry staining, ×200)
2.6 各组视网膜组织VEGF、HIF-1α、ANGⅡ mRNA的表达比较
实时荧光定量 PCR检测结果显示,与对照组比较,模型组视网膜组织中VEGF、HIF-1α及ANGⅡ mRNA表达明显升高;而BMSC组和联合组视网膜组织中VEGF、HIF-1α及ANGⅡ mRNA的表达水平有所下降,且联合组较BMSC组下降更明显,差异均有统计学意义(P<0.05), 见表 4。

表4 各组视网膜组织中VEGF、HIF-1α、ANGⅡmRNA表达比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与 BMSC组比较,▲P<0.05。
2.7 各组视网膜组织p38 MAPK/NF-κB信号通路相关蛋白表达比较
Western blot检测结果显示,模型组视网膜组织中p-p38、p-p65、p-IκBα蛋白表达较对照组明显升高;与模型组比较,BMSC组和联合组p-p38、p-p65、p-IκBα蛋白表达明显下降,且联合组较BMSC组下降更明显,差异均有统计学意义(P<0.05),而各组间p38、p65与IκBα蛋白表达无明显变化,差异无统计学意义(P>0.05),见图4、表5。

表5 各组视网膜组织中p38 MAPK/NF-κB信号通路相关蛋白表达比较
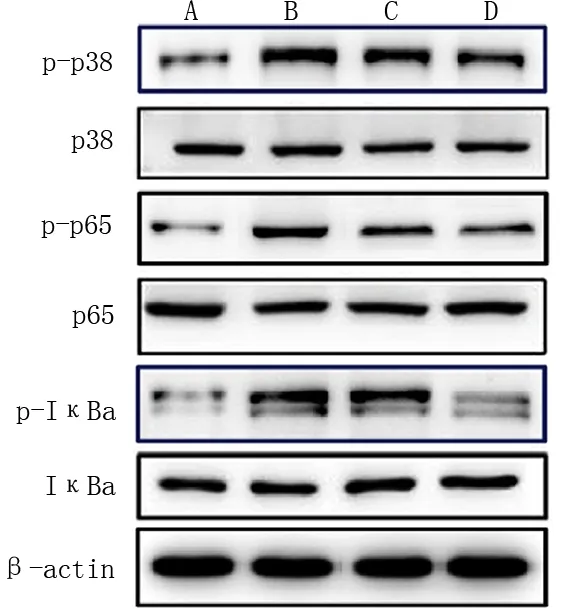
A:对照组; B:模型组; C: BMSC组; D: 联合组 图4 各组视网膜组织中p38 MAPK/NF-κB信号通路相关蛋白表达检测Fig 4 Expression of p38 MAPK / NF-κ B signaling pathway related proteins in retina of rats in each group
3 讨论
糖尿病视网膜病变作为引起致盲的多因素微血管疾病,是糖尿病最常见并发症之一,其发病率也不断上升[4]。DR发病机制非常复杂,其发生发展与持续性代谢紊乱有关,由其引起的血液中炎性细胞因子水平升高会导致视网膜微血管渗漏和水肿,视网膜血管基底膜逐渐增厚以及周细胞丢失等现象[2,11]。为了阐明DR的复杂性,以及探究诊治该疾病的新药物或有效的疗法,使用糖尿病动物模型进行研究是必不可少的。目前,使用链脲佐菌素诱导是常见的糖尿病模型构建方法之一,已广泛用于常规的基础研究和药物治疗实验中[12]。本研究采用此方法来构建大鼠糖尿病模型,观察大鼠视网膜病变情况。研究结果显示,经链脲佐菌素诱导后,模型组血糖明显增加,胰岛素水平明显下降,大鼠血清中炎性因子IL-1β、IL-6 和TNF-α含量均明显升高,通过组织病理学检测也发现大鼠视网膜组织发生明显病变。以上结果均说明成功构建了大鼠DR模型。
目前,BMSC在不同疾病如肿瘤、伤口愈合过程和自身免疫性疾病中均具有治疗作用[13,14]。BMSC能够分泌多种生长因子,这些生长因子可以调节其周围微环境,有利于细胞与细胞之间的相互作用以及与不同细胞类型间的交流。BMSC的分化潜能与其多能性也密切相关,这种效力使其能够分化为受损或丢失的细胞类型,以便在损伤部位短暂地替换细胞,促进细胞修复和对抗应激细胞损伤[15]。已有研究表明,在糖尿病视网膜病变中注射BMSC具有降低炎症细胞因子、细胞凋亡和ROS水平的作用[16]。
已知α1-抗胰蛋白酶通过抑制胱天蛋白酶活性和氧化应激来保护肝细胞、肺细胞和β细胞,并减少促炎细胞因子的分泌[9]。此外,α1-抗胰蛋白酶还可以抑制某些细胞因子和趋化因子的产生。研究表明,α1-抗胰蛋白酶能够使自身胰岛素抗体水平降低[17],将α1-抗胰蛋白酶基因导入小鼠体内能够明显减少T细胞对胰岛B细胞的损害[18]。在胰腺移植模型中,α1-抗胰蛋白酶治疗的糖尿病小鼠血清中TNF-α水平降低,且淋巴细胞浸润的减少。
高血糖、炎症反应和神经元功能障碍是糖尿病视网膜病变的主要因素[19]。在本研究中,通过α1-抗胰蛋白酶和BMSC作用的糖尿病视网膜病变大鼠模型中,血糖降低、胰岛素含量增加,血清中炎症因子含量下降,视网膜水肿明显减轻,各层细胞排列趋于规则,视网膜神经细胞凋亡减少。CD45广泛存在于除成熟红细胞和血小板外所有白细胞上,是细胞膜上信号传导的关键分子[20]。本研究结果显示,α1-抗胰蛋白酶和BMSC联合组视网膜组织中CD45表达明显减弱,同时VEGF、HIF-1α、ANGⅡ mRNA的表达水平均明显下降。VEGF作为促进血管新生的关键性因子,HIF-1α、ANG Ⅱ参与DR的发生[21]。此结果说明α1-抗胰蛋白酶联合BMSC抑制了VEGF、HIF-1α、ANGⅡ的异常表达从而发挥视网膜保护作用。
综上所述,α1-抗胰蛋白酶联合BMSC能够有效保护DR大鼠的视网膜组织,可能通过作用于p38 MAPK/NF-κB信号通路抑制炎症因子IL-1β、IL-6 和TNF-α水平,抑制CD45 以及降低VEGF、HIF-1α、ANGⅡ 的表达,改善DR严重程度。本研究为临床上治疗DR提供了理论依据。
