新型冠状病毒肺炎患者Mg2+水平对CD8+T淋巴细胞和NK细胞功能的影响
2021-01-19龚国富
谢 玲,程 丰,龚国富
(鄂州市中心医院检验科,湖北 鄂州 436000)
2019新型冠状病毒肺炎(Corona virus disease 2019,COVID-19)是由SARS-CoV-2病毒感染引发的一种具有极强传染性和致病性的新型传染病。众多研究报道表明[1],免疫系统紊乱是COVID-19患者的重要临床表现,也是导致患者进展为重症的重要因素。淋巴细胞是机体免疫系统的核心成分,具备抵御和清除细菌、病毒等外来病原微生物的功能。然而,COVID-19患者表现出外周血T淋巴细胞和NK细胞亚群显著减少以及功能衰竭的现象[2-5],说明COVID-19患者存在严重的免疫缺陷。镁是人体正常新陈代谢所需的重要微量元素,具有重要的生理功能,而Mg2+缺乏与冠心病、X连锁镁离子通道缺陷原发性免疫缺陷病(XMEN)、高血压等多种疾病相关。有研究显示[6],胞内游离Mg2+减少可以导致CD8+T淋巴细胞和NK细胞表面活化受体NKG2D表达缺陷,进而降低免疫系统的抗病毒作用。林晓娥等[7]研究显示,Mg2+内流障碍可能是导致慢性HBV感染者CD8+T淋巴细胞功能耗竭的重要原因。Iotti等[8]根据COVID-19患者临床表现和病理特征与Mg2+缺陷疾病所描述的症状和体征有相似之处,猜测Mg2+匮乏可能是导致COVID-19患者疾病进程加重的重要原因。因此,人体内Mg2+水平变化可能对COVID-19患者疾病进程有重要影响。然而COVID-19患者血清或免疫细胞内Mg2+变化如何?其与COVID-19患者淋巴细胞减少及部分淋巴细胞功能衰竭有无关联?目前还不明确。为此本研究初步分析COVID-19患者血清和外周血单个核细胞(PBMCs)中Mg2+水平变化情况,并探讨其变化对CD8+T淋巴细胞和NK细胞功能的影响。
1 资料与方法
1.1 一般资料
选取2020年1月20日~2月20日期间在鄂州市中心医院收治的经确诊为COVID-19患者165例。COVID-19诊断标准符合由国家卫生健康委办公厅和国家中医药管理局办公室联合发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》,根据该诊疗方案中临床分型标准将患者分为轻型/普通型组和重型/危重型组。轻型/普通型组98例,其中男性53例,女性45例,平均年龄(57.15±11.35)岁;重型/危重型组67例,其中男性32例,女性35例,平均年龄(59.74±13.64)岁。同时选取34例健康体检者作为对照组,其中男性18例,女性16例,平均年龄(57.81±14.15)岁。所有患者年龄、性别、基础病史(高血压、糖尿病、心脑血管疾病等)等基本资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 仪器与试剂
FITC-CD3、APC-Cy7-CD8、PE-Cy7-CD56、APC-PD-1和PE-NKG2D荧光抗体购自美国BD公司;荧光探针Mag-Fura4-AM购自美国Thermo Fisher Scientific公司;流式细胞仪(型号:DxFLEX)和全自动生化分析仪(型号:AU5800)均购自美国Beckman Coulter公司。
1.3 外周血PBMCs分离
采集患者和健康体检者空腹静脉血样5 mL,置于含有肝素钠的抗凝管中,采用Ficoll-Hypaque密度梯度离心法分离PBMCs,并将细胞重悬于RPMI-1640培养基中,4℃保存备用。
1.4 CD8+T淋巴细胞和NK细胞计数
取100 μL抗凝血,加入20 μL荧光抗体(FITC-CD3、APC-Cy7-CD8、PE-Cy7-CD56),室温避光孵育15 min。加入2 mL溶血剂,混匀,室温避光孵育10 min,300 g离心5 min,弃上清,再加入2 mL PBS重悬细胞,300 g离心5 min,弃上清。加入1 mL含有1%多聚甲醛的PBS重悬细胞,上流式细胞仪检测并计数,以“CD3+CD8+”双阳性细胞表示CD8+T淋巴细胞,以“CD3-CD56+”细胞表示NK细胞。
1.5 血清及PBMCs细胞中Mg2+水平检测
采用全自动生化分析仪直接检测血清中Mg2+水平。取分离的PBMCs细胞,经HEPES缓冲液重悬细胞并计数,取0.5 mL细胞悬液(5×105个)于EP管中,再加入10 μL终浓度为3 μmol/L的镁离子荧光探针Mag-Fura4-AM溶液,室温避光孵育30 min,300 g离心5 min,弃上清,加入0.5 mL HEPES缓冲液重悬细胞,采用流式细胞仪进行检测。
1.6 CD8+T淋巴细胞和NK细胞表面抑制受体PD-1和激活受体NKG2D水平检测
取分离的PBMCs细胞,经HEPES缓冲液重悬细胞并计数,取0.5 mL细胞悬液(5×105个)于EP管中,依次加入FITC-CD3、APC-Cy7-CD8、PE-Cy7-CD56、APC-PD-1、和PE-NKG2D荧光抗体,混匀后室温孵育1 h,300 g离心5 min,弃上清,加入0.5 mL HEPES缓冲液重悬细胞,采用流式细胞仪进行检测。以“CD3+CD8+PD-1+”和“CD3+CD8+NKG2D+”细胞亚群比例分别表示CD8+T淋巴细胞表面抑制受体PD-1和活化受体NKG2D表达水平;以“CD3-CD56+PD-1+”和“CD3-CD56+NKG2D+”细胞亚群比例分别表示NK细胞表面抑制受体PD-1和活化受体NKG2D表达水平。
1.7 统计学处理
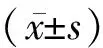
2 结果
2.1 COVID-19患者外周血CD8+T细胞和NK细胞计数变化
与对照组比较,轻型/普通型组和重型/危重型组患者外周血CD8+T淋巴细胞和NK细胞计数明显降低,同时重型/危重型组患者外周血CD8+T淋巴细胞和NK细胞计数明显低于轻型/普通型组,差异均具有统计学意义(P<0.05)。见表1。
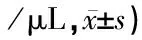
表1 外周血CD8+T淋巴细胞和NK细胞计数比较(个
2.2 COVID-19患者血清及PBMCs中Mg2+水平变化
与对照组比较,轻型/普通型组和重型/危重型组患者血清及PBMCs中Mg2+水平均明显降低,而重型/危重型组患者血清及PBMCs中Mg2+水平均低于轻型/普通型组,差异均具有统计学意义(P<0.05)。见表2。
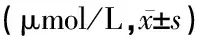
表2 各组Mg2+水平比较
2.3 COVID-19患者CD8+T淋巴细胞和NK细胞表面受体表达变化
与对照组比较,轻型/普通型组和重型/危重型组患者CD8+T淋巴细胞和NK细胞表面抑制受体PD-1表达水平明显升高,而活化受体NKG2D表达水平明显降低,差异均具有统计学意义(P<0.05)。与轻型/普通型组比较,重型/危重型组CD8+T淋巴细胞和NK细胞表面抑制受体PD-1表达水平升高,活化受体NKG2D表达水平降低,差异均具有统计学意义(P<0.05)。见表3。
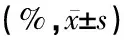
表3 各组细胞表面抑制受体PD-1和活化受体NKG2D表达水平比较
2.4 COVID-19患者Mg2+水平与细胞表面受体表达相关性分析
COVID-19患者血清和PBMCs中Mg2+水平与CD8+T淋巴细胞和NK细胞表面抑制受体PD-1表达水平呈负相关性(P<0.05),而与活化受体NKG2D表达水平呈正相关性(P<0.05)。见表4。
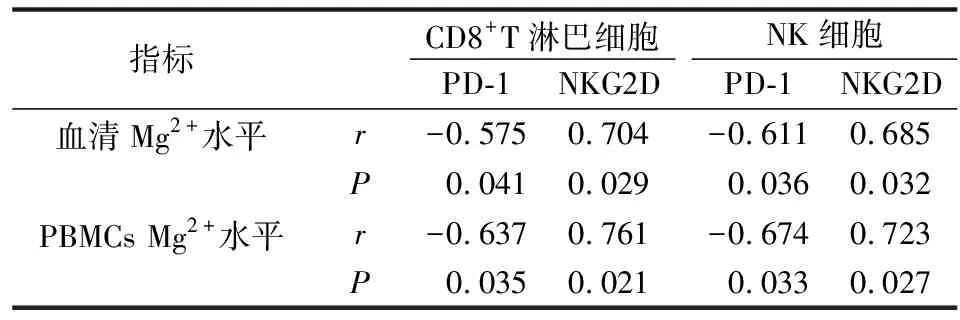
表4 Mg2+水平与CD8+T淋巴细胞和NK细胞表面受体PD-1和NKG2D表达相关性
3 讨论
在病毒早期感染过程中,NK细胞可无需抗原预先致敏就可以杀死靶细胞,而在病毒持续性感染过程中T淋巴细胞介导的细胞免疫反应起着重要作用[9]。CD8+T淋巴细胞的活化可以释放穿孔素、颗粒酶、IFN-γ等小分子物质,特异性介导靶细胞裂解或凋亡,从而有效清除宿主病毒。而CD4辅助T细胞可辅助CD8+T淋巴细胞活化,增强其病毒清除能力。然而大多数COVID-19患者出现外周血淋巴细胞减少的现象[10],具体原因还不明确。本研究结果显示,COVID-19患者外周血CD8+T淋巴细胞和NK细胞减少,并且在重型/危重型患者中表现的更为显著。而李泉等[11]研究显示,在SARS-CoV-2病毒感染的无症状患者中并未表现出外周血淋巴细胞减少的现象。据此推测,COVID-19患者出现外周血淋巴细胞减少的现象可能是因淋巴细胞功能缺陷导致自身大量被消耗所致。
众所周知,在病毒持续性感染的过程中普遍存在T淋巴细胞和NK细胞功能缺陷的现象,最终导致疾病进展较快[12]。目前,普遍认为该现象与免疫细胞表面PD-1、T细胞免疫球蛋白黏蛋白3(Tim-3)、NKG2A等抑制受体高表达以及NKG2D、CD38、人类白细胞DR抗原(HLA-DR)等活化受体低表达相关[13]。淋巴细胞功能缺陷将导致机体对病毒感染的控制能力降低,使患者病情难以控制以及进一步恶化。Zheng等[5]研究显示,COVID-19患者CD8+T淋巴细胞和NK细胞计数明显减少以及出现明显的功能耗竭,而恢复期患者CD8+T和NK细胞数量及功能逐渐恢复。与此同时,Diao等[14]研究也显示,COVID-19患者T淋巴细胞计数明显减少,T淋巴细胞表面抑制性受体PD-1和Tim-3表达明显升高。提示,COVID-19患者也出现不同程度的淋巴细胞功能耗竭的现象。而本研究结果也显示,COVID-19患者CD8+T淋巴细胞和NK细胞表面抑制性受体PD-1表达水平升高,而活化性受体NKG2D表达水平降低,说明COVID-19患者存在CD8+T淋巴细胞和NK细胞耗竭的现象,并且在重型/危重型患者中尤为突出。淋巴细胞功能耗竭一方面可导致其抗病毒能力减弱,另外一方面其表面抑制受体的高表达可导致细胞死亡[15]。因此,COVID-19患者T淋巴细胞减少可能与细胞功能耗竭有关。
Mg2+可作为第二信使通过淋巴细胞受体通路调节淋巴细胞活性,对淋巴细胞的抗病毒活性具有重要的调节作用[6]。Diao等[16]研究证实,胞内Mg2+水平降低可导致HBV患者外周血CD8+T 细胞和NK细胞的功能耗竭。林晓娥等[7,17]研究显示,Mg2+转运蛋白1(MagT1)表达下调介导的Mg2+内流障碍可能是导致CD8+T细胞功能耗竭的重要原因。然而,COVID-19患者CD8+T淋巴细胞和NK细胞功能耗竭是否与患者体内Mg2+水平变化有关,目前还不明确。本研究结果显示,COVID-19患者血清及PBMCs中Mg2+水平显著降低,而且在重型/危重型患者Mg2+水平降低地更为明显。随后相关性分析结果显示COVID-19患者血清及PBMCs中Mg2+水平变化与CD8+T淋巴细胞和NK细胞表面抑制分子PD-1表达水平呈负相关性,而与激活分子NKG2D表达水平呈正相关性。说明,COVID-19患者CD8+T淋巴细胞和NK细胞功能耗竭可能与Mg2+水平降低有关。
综上所述,COVID-19患者外周血CD8+T淋巴细胞和NK细胞明显减少并出现明显的功能耗竭,其原因可能与体内Mg2+水平降低有关,当然该结论还需要更多的研究予以验证,但可提示补充Mg2+摄入量或许对COVID-19治疗有辅助作用。
