miR-381靶向TMEM16A对胃癌细胞增殖和侵袭的影响
2021-01-18周红见李全富
柯 超,蒋 斌,周红见,李全富
胃癌在全球范围内均有较高的致死率,胃癌细胞的无限增殖和局部、远处转移是预后不佳的主要原因[1],然而,胃癌增殖侵袭机制的研究尚无突破性进展。大量证据[2-3]表明,miRNA在多种癌症中存在表达异常,可能参与细胞增殖、凋亡、侵袭和迁移等过程。因此,识别肿瘤特异性miRNA,将有利于肿瘤的诊断、治疗及预后。据报道[4],miR-381在胃癌中低表达,可调控LRH-1、Twist1表达抑制胃癌细胞的增殖和侵袭。调控跨膜蛋白16A(transmembrane protein 16A,TMEM16A)属于钙离子激活的氯离子通道蛋白,参与细胞信号转导、平滑肌收缩等[5]。研究[6]发现,miR-381可靶向TMEM16A抑制胃癌细胞上皮间质转化。该研究旨在明确miR-381和TMEM16A的靶向关系,观察miR-381是否通过TMEM16A影响胃癌细胞AGS生物学行为,为胃癌的治疗提供有效分子靶点。
1 材料与方法
1.1 研究对象
1.1.1组织 选取2018年3月—2019年3月行手术切除的胃癌患者34例,采集其癌组织及癌旁正常组织(距癌低于3 cm),组织样本保存于液氮罐中;患者经术后病理检测确诊为胃癌,知情且同意本次采集,本研究经武汉市第三医院伦理委员会批准。
1.1.2细胞株 胃癌细胞AGS、MKN45、SGC7901和正常人胃黏膜细胞GES-1购自上海生物细胞研究所,胃癌细胞的生物学特性见表1。

表1 胃癌细胞AGS、MKN45、SGC790的生物学特性
1.2 主要试剂与仪器胎牛血清、RPMI1640培养基、DMSO(美国Gibco公司),引物序列由江苏百奥迈科生物技术有限公司合成,脂质体3000试剂盒(美国Invitrogen公司),逆转录试剂盒(美国GeneCopoeia公司),荧光素酶报告系统(美国Promega公司),MTT粉末(上海广锐生物科技有限公司),FITC-Annexin V/PI试剂盒(德国Miltenyi公司),Transwell小室(上海子起生物科技有限公司),蛋白一抗(美国Cell Signaling公司),细胞培养箱(上海轩仪仪器设备有限公司),qRT-PCR仪(美国BioRad公司),流式细胞仪(美国BD公司)。
1.3 方法
1.3.1细胞培养 用含10%胎牛血清的RPMI1640培养基重悬细胞,置于37℃、5%CO2细胞培养箱中孵育;待细胞融合至80%~90%时,消化传代培养;取生长状况良好的细胞用于后续实验。
1.3.2细胞分组与转染 将AGS细胞分为空白对照组、miR-381过表达组(miR-381-mimics)、TMEM16A干扰组(TMEM16A-siRNA),采用脂质体3000试剂盒,分别将miR-381-NC、miR-381-mimics、TMEM16A-siRNA转染AGS细胞,采用流式细胞仪检测转染效率,筛选转染效率在60%的细胞用于后续实验。
1.3.3qRT-PCR检测组织和细胞中miR-381和TMEM16A mRNA的表达 采用TRIzol法提取组织、细胞中的总RNA,应用逆转录试剂盒合成cDNA,混入荧光染料后进行qRT-PCR,采用2-ΔΔCt法,以U6为内参定量,计算miR-381的表达;以GADPH为内参定量,计算TMEM16A mRNA的表达。各基因引物序列[7-8]见表2,作5次独立重复实验。

表2 基因引物序列
1.3.4双荧光素酶实验 应用生物信息学预测软件TargetScan3.1对miR-381和TMEM16A的靶向关系进行预测;根据预测结果,合成含有结合位点DNA片段的野生型(wild type,wt)以及含有结合位点突变体DNA片段的突变型(mutant,mut),构建荧光素酶报告载体;采用脂质体3000试剂盒,将TMEM16A 3′-wt、TMEM16A 3′-mut及miR-381-mimics转染AGS细胞,培养48 h后检测各组细胞荧光素酶活性。
1.3.5MTT法检测细胞增殖 将各组细胞接种至96孔板,分别培养24、48、72 h,加入MTT溶液,继续培养4 h,弃液后加入DMSO,轻微震荡6 min,于570 nm处检测各孔吸光度(optical density,OD)值,OD值越大表明细胞密度越大。
1.3.6流式细胞仪检测细胞凋亡 收集各组细胞,重悬于孵育缓冲液,离心后加入FITC-Annexin V和PI染液混匀,室温下避光反应5 min;孵育缓冲液清洗后,加入荧光SA-FLOUS溶液,避光条件下4 ℃孵育 20 min;应用流式细胞仪检测细胞凋亡情况。散点图结果:左下象限(FITC-/PI-)显示活细胞,右上象限FITC+/PI+)为坏死细胞,右下象限(FITC+/PI-)为凋亡细胞。
1.3.7Transwell小室法检测细胞侵袭 将基质胶包裹Transwell小室,凝固后接种各组细胞于上室,并在下室中接入含20%的RPMI1640培养基;培养48 h后,吸弃Transwell小室上室中培养液,并拭去膜内侧多余细胞;取出小室固定于4%多聚甲醛中,反应20 min;滴加DAPI染色,于显微镜下观察、计数侵袭细胞数。
1.3.8Western blot检测细胞中蛋白的表达 收集各组细胞,加入裂解液充分提取细胞中总蛋白,经BCA法检测蛋白浓度,各组取等量蛋白进行SDS-PAGE凝胶电泳分离并转膜,将PVDF膜置于5%脱脂奶粉中封闭2 h,分别加入相应蛋白一抗(1 ∶1 000)于4 ℃过夜,再置于 HRP标记的二抗(1 ∶8 000)中37 ℃反应1 h;最后滴加ECL发光显示蛋白条带,应用Image J软件灰度分析各蛋白条带,以β-actin为内参,计算含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase-3、caspase-9)、E钙黏素(E-cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶(matrix metalloproteinase,MMP-2、MMP-9)的表达量(目标蛋白表达量=目标蛋白灰度值均值/β-actin灰度值均值)。

2 结果
2.1 不同组织和细胞中miR-381和TMEM16A mRNA表达的比较采用TRIzol法提取不同组织和细胞中的总RNA,用qRT-PCR分析miR-381和TMEM16A mRNA的相对表达水平,结果显示,胃癌组织miR-381的相对表达水平为0.37±0.06,癌旁正常组织为0.82±0.12;与癌旁正常组织相比,胃癌组织中miR-381表达降低(t=19.558,P<0.001)。胃癌细胞AGS、MKN45、SGC7901和正常细胞GES-1中miR-381相对表达水平分别为0.29±0.05、0.47±0.09、0.82±0.07和1.00±0.11,差异有统计学意义(F=75.676,P<0.001);与人正常胃黏膜细胞GES-1相比,胃癌细胞AGS、MKN45、SGC7901中miR-381表达均下降(qAGS=19.113,P<0.001;qMKN45=14.267,P<0.001;qSGC7901=4.845,P=0.004)。
胃癌组织TMEM16A mRNA的相对表达水平为0.98±0.12,癌旁正常组织为0.30±0.07;与癌旁正常组织相比,胃癌组织中TMEM16A mRNA表达升高(t=28.541,P<0.001)。胃癌细胞AGS、MKN45、SGC7901和正常细胞GES-1中TMEM16A mRNA相对表达水平分别为1.65±0.15、1.32±0.10、1.19±0.14和1.00±0.12,差异有统计学意义(F=22.516,P<0.001);与人正常胃黏膜细胞GES-1相比,胃癌细胞AGS、MKN45、SGC7901中TMEM16A mRNA表达均升高(qAGS=11.272,P<0.001;qMKN45=5.550,P=0.003;qSGC7901=3.295,P=0.033)。
2.2 过表达miR-381对AGS细胞中miR-381和TMEM16A mRNA表达的影响将miR-381-mimics、TMEM16A-siRNA转染AGS细胞,经流式细胞仪测得转染效率分别为62.37%和65.38%,可用于后续实验;采用TRIzol法提取各组细胞中的总RNA,用qRT-PCR分析miR-381和TMEM16A mRNA的相对表达水平,结果如表3所示,与空白对照组相比,miR-381-mimics组细胞中miR-381的表达上升(q=94.524,P<0.001), TMEM16A mRNA表达下降(q=16.045,P<0.001);TMEM16A-siRNA组TMEM16A mRNA表达下降(q=26.407,P<0.05),但miR-381的表达无变化(q=0.247,P=0.864);联合转染组miR-381的表达上升(q=92.300,P<0.001),但与miR-381-mimics组比较无差异(q=2.224,P=0.136),TMEM16A mRNA表达下降(q=29.415,P<0.001),且明显低于miR-381-mimics组、TMEM16A-siRNA组(qmiR-381-mimics=13.371,P<0.001;qTMEM16A-siRNA=3.008,P=0.049),详见表3。miR-381-mimics对TMEM16A mRNA的沉默效率为(46.6±1.8)%,TMEM16A-siRNA对TMEM16A mRNA的沉默效率为(76.3±2.4)%,miR-381-mimics联合TMEM16A-siRNA对TMEM16A mRNA的沉默效率为(85.4±2.1)%。

表3 各组细胞中miR-381和TMEM16A mRNA表达的比较
2.3 miR-381和TMEM16A靶向关系应用TargetScan3.1软件预测miR-381和TMEM16A的靶向关系,可能的结合位点如图1所示;根据预测结果,构建荧光素酶报告载体验证靶向关系。双荧光素酶实验结果显示,TMEM16A 3′-wt对照组细胞中荧光素酶活性为1.00±0.11,而共转染TMEM16A 3′-wt和miR-381-mimics组为0.37±0.07,其荧光素酶活性低于TMEM16A 3′-mut对照组(t=10.804,P<0.001);TMEM16A 3′-mut对照组细胞中荧光素酶活性为0.98±0.08,共转染TMEM16A 3′-mut和miR-381-mimics组为1.03±0.10,与TMEM16A 3′-mut对照组比较无差异(t=0.329,P=0.751;t=0.451,P=0.664),证实miR-381和TMEM16A的靶向关系。

图1 miR-381和TMEM16A预测结合位点
2.4 miR-381靶向TMEM16A对AGS细胞增殖的影响采用MTT法检测各组细胞的增殖活性,结果显示,与空白对照组相比,miR-381-mimics组、TMEM16A-siRNA组及联合组细胞增殖明显被抑制,具体OD值见表4;采用Western blot法检测各组细胞中p27的相对表达量,结果如图2所示,空白对照组、miR-381-mimics组、TMEM16A-siRNA组及联合组p27的相对表达量分别为1.00±0.11、1.29±0.13、1.34±0.12及1.56±0.14,差异有统计学意义(F=16.854,P<0.001);与空白对照组相比,其余各组p27的表达均增加(qmiR-381-mimics=5.167,P=0.002;qTMEM16A-siRNA=6.058,P=0.002;q联合组=9.978,P<0.001)。

表4 各组细胞OD570nm值的比较
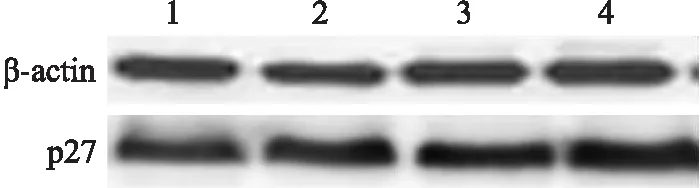
图2 miR-381靶向TMEM16A对AGS细胞中p27表达的影响
1:空白对照组;2:miR-381-mimics组;3:TMEM16A-siRNA组;4:联合组
2.5 miR-381靶向TMEM16A对AGS细胞凋亡的影响采用流式细胞仪检测各组细胞凋亡率,结果显示,空白对照组、miR-381-mimics组、TMEM16A-siRNA组及联合组细胞凋亡率分别为(3.41±0.82)%、(13.54±2.51)%、(16.78±3.16)%及(22.37±3.58)%,差异有统计学意义(F=42.574,P<0.001);与空白对照组相比,miR-381-mimics组、TMEM16A-siRNA组及联合组细胞凋亡率明显增加(qmiR-381-mimics=8.302,P<0.001;qTMEM16A-siRNA=10.958,P<0.001;q联合组=15.539,P<0.001)。采用Western blot法检测各组细胞中caspase-3、caspase-9的相对表达量,结果如图3、表5所示,与空白对照组相比,其余各组细胞中caspase-3、caspase-9的相对表达量明显增加(caspase-3:qmiR-381-mimics=5.912,P<0.001;qTMEM16A-siRNA=6.651,P<0.001;q联合组=9.791,P<0.001。caspase-9:qmiR-381-mimics=3.367,P=0.030;qTMEM16A-siRNA=5.316,P=0.005;q联合组=8.505,P<0.001)。

图3 miR-381靶向TMEM16A对AGS细胞中caspase-3、caspase-9表达的影响
2.6 miR-381靶向TMEM16A对AGS细胞侵袭的影响采用Transwell小室法检测各组细胞侵袭能力,结果显示,空白对照组、miR-381-mimics组、TMEM16A-siRNA组及联合组侵袭细胞数分别为(186.25±22.47)个、(83.46±16.72)个、(41.96±14.08)个及(25.34±6.57)个,差异有统计学意义(F=101.790,P<0.001);与空白对照组相比,miR-381-mimics组、TMEM16A-siRNA组及联合组侵袭细胞数明显下降(qmiR-381-mimics=14.352,P<0.001;qTMEM16A-siRNA=20.147,P<0.001;q联合组=22.467,P<0.001)。采用Western blot法检测各组细胞中E-cadherin、Vimentin、MMP-2及MMP-9的相对表达量,结果如图4、表6所示,与空白对照组相比,其余各组细胞中Vimentin、MMP-2及MMP-9的表达明显下降(Vimentin:miR-381-mimics=4.002,P=0.012;qTMEM16A-siRNA=8.804,P<0.001;q联合组=17.875,P<0.001;MMP-2:miR-381-mimics=6.521,P<0.001;qTMEM16A-siRNA=12.259,P<0.001;q联合组=20.605,P<0.001;MMP-9:miR-381-mimics=9.141,P<0.001;qTMEM16A-siRNA=10.911,P<0.001;q联合组=18.578,P<0.001),E-cadherin的表达明显增加(miR-381-mimics=5.240,P=0.002;qTMEM16A-siRNA=7.569,P<0.001;q联合组=8.927,P<0.001)。

表5 各组细胞中caspase-3、caspase-9相对表达量的比较

图4 miR-381靶向TMEM16A对AGS细胞中E-cadherin、Vimentin、MMP-2及MMP-9表达的影响

表6 各组细胞中E-cadherin、Vimentin、MMP-2及MMP-9相对表达量的比较
3 讨论
miR-381定位于染色体14q32.31位点,该位点还包含有多种肿瘤抑制靶点miR-154、miR-377等。Tang et al[9]研究指出,miR-381在胶质瘤中表达增加,可促进肿瘤的恶性进展。而Xia et al[10]研究发现,miR-381可通过下调YY1抑制上皮性卵巢癌。上述研究表明,miR-381在不同的肿瘤类型中发挥着抗癌或促癌作用,因此,针对miR-381的肿瘤治疗必须考虑其双重调控功能。本研究结果显示,miR-381在胃癌组织和细胞系中呈低表达,与王丽 等[11]研究结果一致。miRNA的调控机制是非常复杂的,可参与DNA拷贝数变化、DNA甲基化、组蛋白修饰等过程,而且调控可发生于多个水平,如转录前、转录时及转录后。
TMEM16A是一种潜在的致癌基因,可调节胞内氯离子浓度激活MAPK信号通路,促进肿瘤的发生发展。Liu et al[12]研究发现,过表达TMEM16A可能通过TGF-β信号通路促进胃癌细胞的增殖和侵袭,提示TMEM16A与胃癌细胞的生物学行为密切相关。本研究通过在线生物信息学预测软件和双荧光素酶实验证实miR-381和TMEM16A的靶向关系,同时过表达miR-381的AGS细胞中TMEM16A mRNA表达下降,进一步验证miR-381可负向调控TMEM16A的表达。
本研究显示, miR-381可靶向TMEM16A抑制胃癌细胞AGS的增殖和侵袭,并促进其凋亡。P27蛋白是细胞周期素依赖激酶抑制剂,可抑制细胞由G1期进入S期[13],因此,P27低表达可以加速细胞周期的进程,促进细胞增殖。本研究结果显示,miR-381可靶向TMEM16A促进P27的表达,提示miR-381可靶向TMEM16A抑制胃癌细胞AGS的增殖,可能与上调P27的表达有关。Caspase家族与真核细胞凋亡密切相关,Caspase-9是凋亡的触发剂,而Caspase-3是凋亡的直接执行者[14]。本研究显示,miR-381可靶向TMEM16A促进Caspase-3、Caspase-9的表达,揭示miR-381可靶向TMEM16A促进胃癌细胞AGS的凋亡,可能与上调Caspase-3、Caspase-9的表达有关。上皮间质转化是肿瘤细胞发生侵袭和迁移过程的重要生物学机制,E-cadherin是肿瘤浸润抑制基因,可增强细胞简单黏附作用,维持细胞骨架的稳定,阻碍肿瘤细胞的侵袭;Vimentin是间质细胞中的纤维蛋白,可用于评估上皮性肿瘤有无转移;MMP家族可有效分解基底膜和细胞外基质的主要成分,促进肿瘤细胞对邻近组织的侵袭[15]。本研究显示,miR-381可靶向TMEM16A促进E-cadherin的表达,抑制Vimentin、MMP-2及MMP-9 的表达,提示miR-381可靶向TMEM16A抑制胃癌细胞AGS的侵袭,可能与调控上皮间质转化相关基因E-cadherin、Vimentin、MMP-2及MMP-9的表达有关。
总之,本研究显示miR-381在胃癌中低表达,并靶向TMEM16A抑制胃癌细胞的增殖和侵袭,促进其凋亡,可能与调控P27、Caspase-3、Caspase-9、E-cadherin、Vimentin、MMP-2及MMP-9的表达有关。后续将选用动物模型,深入探究miR-381靶向TMEM16A对胃癌的影响。
