轮状病毒感染BALB/c乳鼠乳糖不耐受模型的建立
2021-01-18章孝成张晓燕韩毛振黄升海
章孝成,丁 锐,张晓燕,韩毛振,黄升海,
乳糖不耐受症(lactose intolerance,LI)是由机体内乳糖酶缺乏所引起,症状为腹部不适、胀气、和腹泻等。LI是由于机体内乳糖酶缺乏而引起的腹部不适、胀气和腹泻等临床症状。目前LI是影响儿童营养不良、发育迟缓的重要疾病,全球许多人群面临不同程度的LI,严重影响人们的生活质量[1-2]。继发性乳糖不耐受(secondary lactose intolerance, SLI)是一种暂时性LI,常继发于肠道各种病毒或寄生虫感染性疾病、克罗恩病或放射性肠炎等,使肠绒毛受损伤而出现乳糖酶的缺乏,发生LI腹泻;待绒毛恢复能分泌足量乳糖酶后疾病有所恢复[3]。目前,SLI的发生机制研究并不完善,主要原因是缺乏相关的SLI动物模型。该文通过构建轮状病毒(rotavirus,RV)感染7日龄BALB/c乳鼠SLI模型,为SLI的研究提供实验基础。
1 材料与方法
1.1 细胞株与病毒株恒河猴胚胎肾细胞MA104细胞株、轮状病毒VR-2018病毒株均购自武汉病毒研究所,课题组自行培养保存。病毒复苏后在MA104细胞上进行培养增殖,通过半数组织细胞感染剂量(median tissue culture infective dose,TCID50)测定感染剂量为10-4.51/0.1 ml后,用于灌胃感染乳鼠。
1.2 实验动物SPF级1~8周龄BALB/c小鼠36只,由安徽省实验动物中心提供,饲养于独立送风隔离笼具系统内,该系统由安徽医科大学基础医学院动物房提供,等级为P2级。待雌雄鼠自行配种生产乳鼠,随机选取150只7日龄BALB/c乳鼠,3.5 ~4.0 g/只。
1.3 主要试剂DMEM培养基购自美国Gibco公司(批号:1868817);小牛血清购自芜湖天明生物技术有限公司(批号:C0257);二甲基亚砜购自美国biosharp公司(批号:D5879);乳糖酶试剂盒购自南京建成生物工程研究所公司(批号:A082-1);TRIzol试剂盒购自美国Invitrogen公司(批号:15596-026);逆转录试剂盒、Real-time PCR试剂盒购自北京全式金公司(批号:AH311-02、AE411-02);其他各种规格的培养板购自美国Falcon公司。
1.4 RV增毒及感染剂量测定MA104细胞经0.2%EDTA、0.25%胰蛋白酶消化后反复吹打混匀,制成5×105/ml细胞悬液;将细胞悬液接种到24孔细胞培养板,1 ml/孔,在24孔细胞培养板中生长24 h后,细胞单层达90%融合,吸弃培养液,用无血清MEM培养液洗涤2次;每孔加入100 μl含7 μg/ml胰酶的无血清MEM培养液,再加100 μl病毒悬液混匀,37 ℃培养吸附1 h,每隔20 min取出摇匀一次;吸弃接种液,细胞用无血清MEM洗涤2次后加入1 ml含7 μg/ml胰酶的无血清DMEM培养,置于5%CO2、37 ℃培养箱中培养;逐日观察细胞生长状态,当80%以上细胞出现病变时收获病毒。收获的病毒悬液10倍连续稀释,经TCID50测定,RV病毒悬液中感染性病毒为1×10-4.51/0.1 ml。
1.5 RV感染模型的建立将BALB/c乳鼠随机分为3组:实验感染组、PBS阴性对照组和正常对照组,每组5只,实验感染组、PBS阴性对照组采用灌胃的方式接种,其中实验感染组接种TCID50为1×10-4.51/0.1 ml RV病毒悬液,200 μl/只,PBS阴性对照组接种等体积PBS溶液,正常组对照组不接种任何试剂,乳鼠于接种前后各饥饿2 h,每天观察乳鼠的腹泻情况。
1.6 样本的收集及检测接种后每日处死乳鼠,无菌取乳鼠小肠组织,通过qPCR方法检测病毒增殖水平,HE染色和乳糖酶活力检测,观察及检测乳鼠小肠组织中RV的含量及其组织病理变化。
1.7 qRT-PCR法收取乳鼠小肠组织,预冷PBS洗涤3次后用TRIzol试剂提取总RNA,测定其纯度和浓度后,按照EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒操作说明书配置逆转录反应体系和操作;靶cDNA按照TransStart Green qPCR SuperMix试剂盒操作说明书配置RT-PCR反应体系和操作。以GAPDH为本实验的内参。引物序列见表1。

表1 基因的引物序列及扩增片段长度
1.8 乳糖酶活力测定取新鲜的乳鼠肠组织匀浆,并测定其蛋白浓度,设立空白管、标准管、测定管和对照管4个实验管,各管先加入50 μl底物,空白管加入25 μl双蒸水,标准管加入25 μl浓度为5.55 mmol/L葡萄糖液,测定管加入25 μl乳鼠肠组织匀浆液,对照管不加任何物质,混均,37℃孵育20 min后各试验管加入25 μl终止剂,对照管加入与测定管相对应的25 μl乳鼠肠组织匀浆液,各试验管混均,4000 r/min离心10 min,取上清液备用,取96孔酶标板,加入8 μl上述的各试验管的上清液,每个试验管设立两个复孔,每孔加入200 μl显色剂,轻轻震荡孔板,37℃孵育15 min后,酶标仪505 nm处读取各孔吸光度(optical density, OD)值。通过公式:乳糖酶的活力(U/ mgprot )=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(5.55 mmol/L)/反应时间(20 min)/待测样本蛋白浓度(mgprot/ml)×1 000
1.9 统计学处理使用SPSS22.0进行统计差异分析,实验数据均数通过One way ANOVA即单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 RV的增殖轮状病毒VR-2018株感染正常MA104细胞后在细胞内增殖,病变细胞随着病毒不断复制和增殖而加重,细胞出现贴壁能力减弱、大量圆缩、悬浮、变形和破裂等现象,见图1。
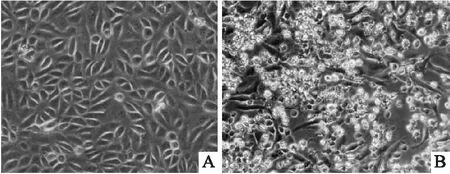
图1 正常MA104细胞和RV感染的MA104细胞 ×400A:正常MA104细胞;B:RV感染的MA104细胞
2.2 qPCR检测乳鼠小肠组织内RV相对含量小肠组织中RV NSP5基因通过荧光定量PCR检测,结果显示,RV感染第一天在小肠组织中即可检测到,RV NSP5基因的mRNA表达含量呈现先升高后逐渐降低的趋势,前4 d在小肠组织中病毒的表达水平均较高,其中第二天最高(P=0.0174,F=13.69),感染第7天以后相对表达水平很低,见图2。

图2 实验组乳鼠小肠组织RV NSP5基因mRNA表达
2.3 乳鼠攻毒后的腹泻情况乳鼠攻毒后每隔24 h观察其体征和腹泻情况,连续观察10 d并记录。按压乳鼠腹部产生应激排便,通过粪便的形态判断腹泻情况,腹泻的评分参考标准分成3个等级:未腹泻、普通腹泻和严重腹泻,通过观察乳鼠粪便形态进行分级,未腹泻:无便或正常固体粪便,记为0分或1分;普通腹泻:黄色颗粒状便,记为2分;严重腹泻:软便或水样便,记为3分。通过观察,正常对照组无腹泻情况,实验感染组感染后前3 d出现严重腹泻,腹泻持续约7 d左右。见图3。

图3 乳鼠腹泻结果
2.4 乳鼠小肠外观性状解剖乳鼠观察小肠组织外观性状:PBS阴性对照组和正常对照组小肠完整,表面光滑透亮;实验感染组小肠色泽较正常对照组灰暗,小肠上皮有很多出血点,见图4。

图4 乳鼠小肠外观性状A:正常对照组;B:PBS阴性对照组;C:实验感染组
2.5 乳鼠小肠组织切片HE染色取实验感染组,正常对照组和PBS阴性对照组小肠组织进行HE染色。正常对照组和PBS阴性对照组整体状态一致,小肠各层结构完整清晰,细胞胞质致密,绒毛排列整齐完整;实验感染组乳鼠肠组织出现病变,表现为空泡,细胞水肿,有炎性细胞浸润,小肠绒毛中分布的血管扩张充血,绒毛出现破损杂乱,绒毛长度较对照组变短。见图5。
2.6 乳糖酶活力检测与正常对照组比较,实验感染组的乳糖酶活力在前4 d逐渐降低,第2天开始,差异有统计学意义(P=0.0173,F=11.26),在第4天达到最低(P<0.01,F=15.88),第5天后逐渐恢复到正常对照组水平。见图6。

图5 BALB/c乳鼠小肠组织 HE ×400

图6 实验组乳鼠小肠组织乳糖酶活力检测
3 讨论
RV是引起全球范围内儿童腹泻的主要病原体,主要经消化道传播,是导致SLI的原因之一[4]。目前,关于RV导致腹泻的动物模型相关报道很多,如牛、狗、猪、兔、羊和鼠等,其中由于鼠易获得、易饲养、繁殖能力强等优点在很多的动物模型中被广泛应用[5]。RV感染人体后在机体肠道的小肠上皮绒毛上端复制,使得肠上皮基底膜中粘连蛋白疏松,导致细胞间连接紧密性下降、小肠上皮微绒毛细胞骨架结构破坏,乳糖酶活性表达下降,进而引起腹泻等一系列临床症状。BALB/c乳鼠因动物体质量轻,易获得,所用的病毒剂量小,实验成本低,适合批量建模;BALB/c乳鼠能够模拟婴幼儿RV感染急性肠炎的临床特征,可快速构建病毒感染动物实验模型,实验稳定性好,可重复。RV病毒感染方式为粪-口途径传播,故本实验采用灌胃感染病毒,为排除人为操作等因素对小鼠机体损伤的干扰,设置PBS阴性对照组表明实验的科学性与严谨性。RV感染后前3 d出现严重腹泻,腹泻约持续7 d左右,对照组阴性,表明病毒的感染能导致乳鼠腹泻。HE染色结果显示RV感染小肠组织后,小肠组织损伤、小肠绒毛结构破坏,出现水肿等炎症反应,从病理学角度证明RV感染会导致小肠组织发生炎症,进而引起位于肠上皮细胞刷状缘上端的乳糖酶活性降低。通过乳鼠小肠组织乳糖酶活性检测,表明RV感染后会影响到乳糖酶活性且使其降低。乳鼠乳糖酶活性的降低和出现腹泻临床症状表明乳鼠产生SLI。从病理结构来看,乳糖酶的活性和数量在空肠中最高,而RV主要侵袭小肠黏膜上皮细胞刷状缘上端,使得肠上皮细胞发生空泡化,出现水肿和绒毛断裂脱落的现象,致使小肠黏膜损伤,小肠组织结构破坏,严重影响到小肠黏膜吸收水分和电解质功能,从而引起腹泻且使得乳糖酶的数量和活性降低[6-7]。本课题组的模型研究结果与之一致。
