新型冠状病毒肺炎合并肝损伤案例报道及文献复习
2021-01-16郑珍川董文红
郑珍川,董文红
(合肥市第一人民医院全科医学科,安徽 合肥 230001)
新型冠状病毒肺炎(COVID-19)传染性强,传播迅速,已被我国纳入《中华人民共和国传染病防治法》规定的乙类传染病,按甲类管理。目前,COVID-19已成为全球共同关注的公共卫生事件。在临床诊疗过程中及现有文献资料中发现,部分COVID-19患者可出现不同程度的肝损伤,多表现为肝生化指标异常,个别病例可表现为严重肝损伤[1-4]。本研究以本院救治的1例COVID-19合并肝损伤病例作为切入点,对COVID-19合并肝损伤相关文献进行了复习、分析和总结。
1 资料与方法
1.1资料
1.1.1临床资料 患者,女,67岁。因新型冠状病毒咽拭子核酸检测阳性1 d于2020年2月16日收入院。其丈夫系COVID-19确诊患者,入院前2 d患者被转运至集中隔离点隔离观察,1 d前市疾控中心检测新型冠状病毒咽拭子核酸阳性,故转入本院进一步诊治。病程中患者无畏寒、发热、咳嗽、咳痰、胸闷、气喘、腹痛、腹泻、咽痛、全身乏力等不适,精神、食欲及睡眠可,二便正常。既往否认糖尿病、高血压、冠心病等慢性病史,否认病毒性肝炎、自身免疫性肝炎、脂肪肝、肝硬化、肝癌等基础肝脏疾病史。入院前14 d内无武汉市及周边地区旅居史。入院查体:体温36.6 ℃,脉搏88次/分,呼吸频率20次/分,血压147/91 mm Hg(1 mm Hg=0.133 kPa)。神清,精神可,呼吸平稳,问答切题,查体合作,全身皮肤、黏膜无黄染及出血点,浅表淋巴结未触及肿大,球结膜无水肿,口唇无发绀,颈软,气管居中,胸廓对称无畸形,双肺呼吸音粗,未闻及明显干湿性啰音,心界不大,心率88次/分,律齐,各瓣膜区未闻及杂音,腹部平软,全腹无压痛及反跳痛,未扪及包块,肝、脾肋下未触及。实验室检查血常规:白细胞7.98×109L-1,淋巴细胞1.86×109L-1,淋巴细胞百分比26.1%,超敏C反应蛋白小于0.5 mg/L,血清淀粉样蛋白30.73 mg/L。生化检查:清蛋白(ALB)42.2 g/L(正常范围40.0~55.0 g/L),总胆红素(TBIL)12.4 μmol/L(正常范围3.0~22.0 μmol/L),谷丙转氨酶(ALT)45 U/L(正常范围9~52 U/L),谷草转氨酶(AST)43 U/L(正常范围14~36 U/L),碱性磷酸酶(ALP)84 U/L(正常范围38~126 U/L),谷氨酰氨基转移酶(GGT)53 U/L(正常范围12~43 U/L),降钙素原小于0.05 ng/mL。肾功能、电解质、血糖、心肌酶未见明显异常。凝血功能:凝血酶原时间(PT)11.3 s(正常范围8.0~12.0 s)。免疫组合:乙型肝炎表面抗原、表面抗体、e抗原、e抗体,以及丙型肝炎抗体、人类免疫缺陷病毒抗体、梅毒螺旋体抗体均阴性。肺部CT:右肺下叶斑片状模糊影,考虑为病毒性肺炎的可能。
1.1.2入院诊断 根据国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案》(试行第七版)诊断标准,患者发病前14 d内有与新型冠状病毒感染者(其丈夫)的接触史,发病早期查血常规白细胞总数正常,淋巴细胞数正常,肺部CT检查符合病毒性肺炎影像学特征,且实时荧光聚合酶链反应检测新型冠状病毒核酸阳性,确诊为COVID-19。患者入院时虽无明显发热或呼吸道症状等表现,但后续住院过程中患者出现发热、咳嗽、咳痰等呼吸道症状,且住院过程中未出现第七版诊疗方案中符合重型及危重型的情况,故定义为普通型。
1.2方法
1.2.1诊治方法 患者入院后给予洛匹那韦利托那韦、阿比多尔口服,α-干扰素雾化吸入抗病毒、抗感染(头孢曲松钠、头孢哌酮钠舒巴坦钠、莫西沙星等)、中成药疏风解毒胶囊、中药汤剂、血必净化瘀解毒等综合治疗。治疗过程中患者出现肝损伤,表现为肝生化指标异常。2020年3月7日肝生化指标异常达峰值,ALT 389 U/L,AST 234 U/L,ALP 165 U/L,GGT 500 U/L,符合COVID-19相关的急性肝损伤诊断[5]。停用可疑致肝损伤的药物,同时给予异甘草酸镁注射液、注射用还原性谷胱甘肽抗炎保肝治疗,好转后改为口服甘草酸二铵肠溶胶囊。
1.2.2文献检索 检索中华医学期刊网、PubMed数据库等调查自2019年12月至今国内外有关COVID-19合并肝损伤的文献报道,收集、整理并汇总成表1。
2 结 果
2.1病情转归 患者出院前复查肝生化指标,除GGT仍升高(103 U/L)外,其余指标在正常值范围内。患者体温恢复正常3 d以上,呼吸道症状明显好转,肺部CT检查急性渗出性病变明显改善,连续2次咽拭子新型冠状病毒核酸检测阴性,按《新型冠状病毒肺炎诊疗方案》(试行第七版)的出院标准予以出院。患者住院时间大于30 d,肝损伤相关生化指标变化见图1~4。

1.ALT;2.AST;3.ALP;4.GGT。
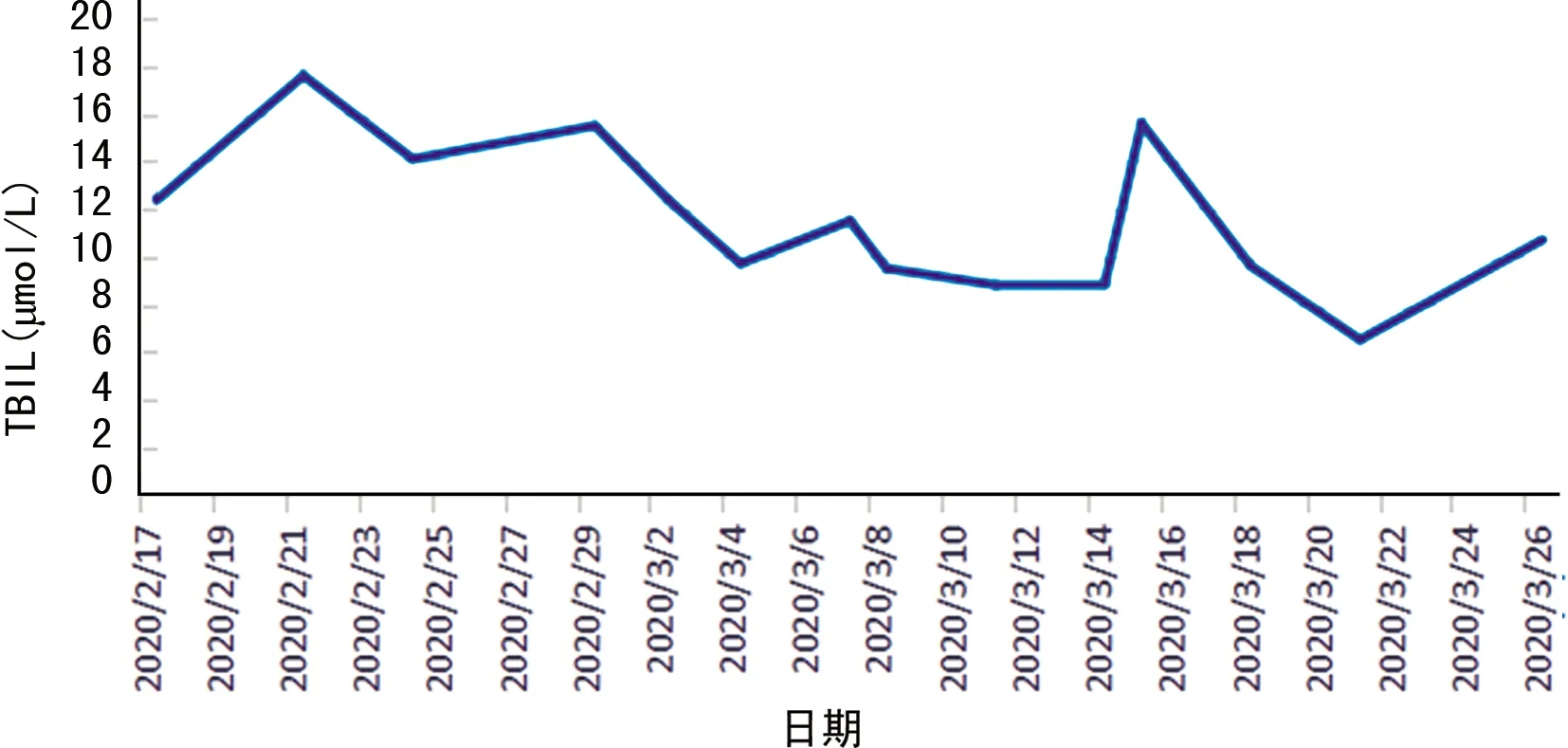
图2 TBIL变化
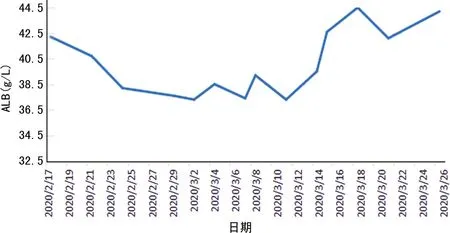
图3 ALB变化
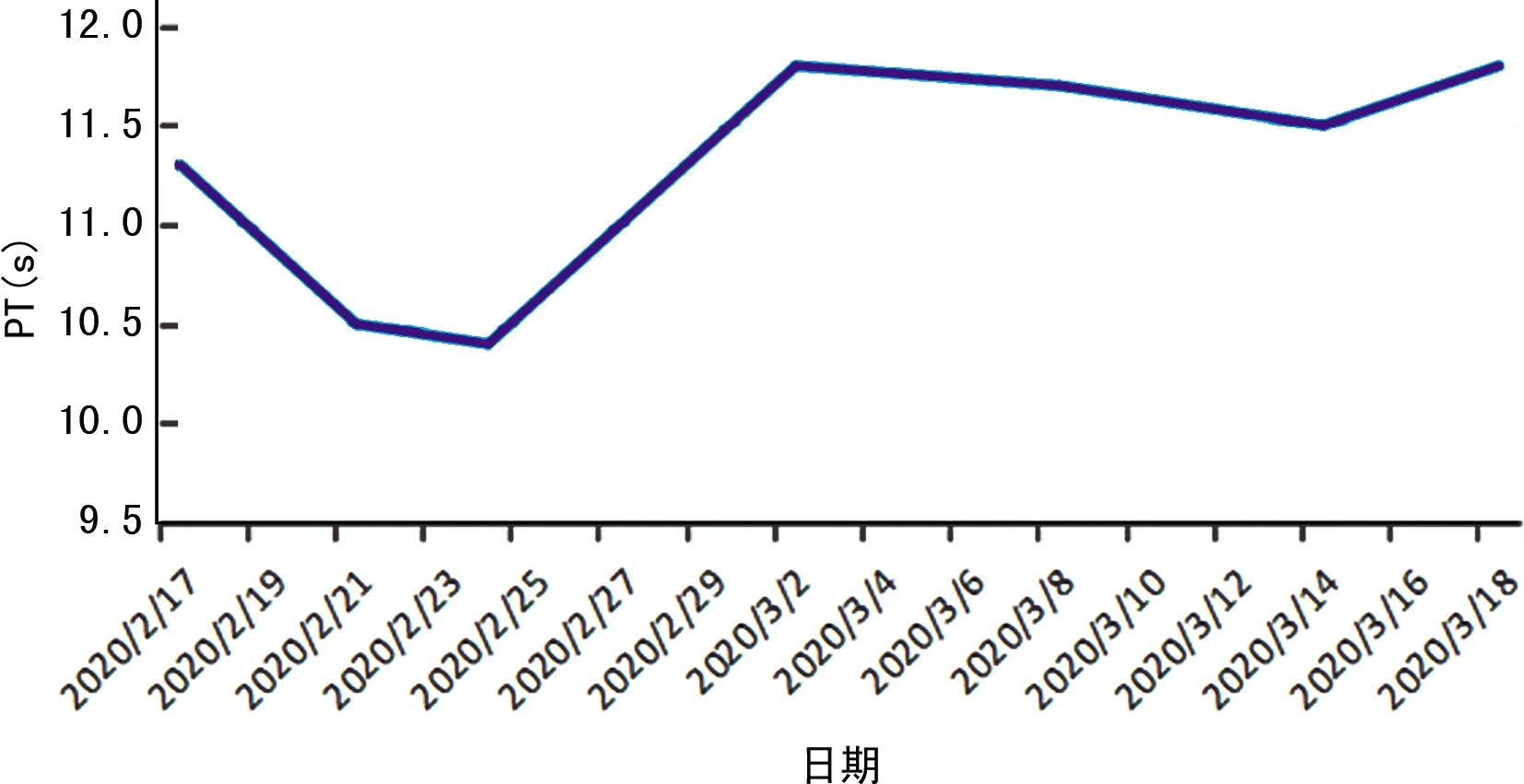
图4 PT变化
2.2文献检索基本情况 共纳入14篇文献[1-4,6-15],其中4篇为多中心研究[2,8-9,14],其余均为单中心研究,收集的样本量为30~1 099例。根据病情严重程度分为非危重组(包括轻型和普通型)和危重组(包括重型和危重型)。纳入研究的患者以非危重组为主,危重组比例较低,除白澎等[10]纳入的研究对象均为58例COVID-19重型和危重型患者外,孙大伟等[11]纳入的研究对象中危重组占比例更高[58.8%(30/51)]。所有研究对象中合并肝脏基础疾病者占少数。文献基本情况见表1。

表1 文献基本情况[n/n(%)或n(%)]
2.3肝生化指标 COVID-19合并肝损伤的发生率较高,主要表现为肝生化指标异常,其中以ALT和(或)AST升高多见,鲜有ALP和GGT异常的文献报道,胆红素升高也较少见,部分患者可出现ALB下降。同时,大部分研究表明,危重组患者肝损伤发生率较非危重组高,且危重组更多见于合并有基础疾病者和老年患者。少有严重肝损伤的发生,只有CHEN等[1]和汪姝惠等[3]分别报道了1例。
2.4凝血指标(PT、PTA) 大部分患者未出现明显凝血指标的变化,也有部分文献报道了出现PT延长或PTA下降,且以危重组病例更多见。
3 讨 论
COVID-19作为一种新发的急性呼吸道传染病,其主要受累靶器官为肺,也可累及肝脏、心脏等器官[16]。本院为COVID-19患者定点收治医院,在临床诊疗过程中发现,部分患者在病程的不同阶段甚至整个病程中均可出现不同程度的肝损伤。汪姝惠等[3]回顾性分析了收治于华中科技大学附属同济医院的333例住院患者的肝生化指标,67.4%患者入院时即存在轻度肝损伤,ALT和(或)AST升高,住院期间复查ALT高于入院时。姚娜等[13]发现,疾病过程中出现肝损伤22例(55.0%),且肝酶指标多在病程第2周开始升高。本例患者从入院至出院整个病程均存在不同程度肝功能异常。目前,有关COVID-19合并肝损伤的定义、发病机制、临床特点、预后等仍存在争议,本例患者定义COVID-19合并肝损伤参照了近期中国医师协会消化医师分会和中华医学会肝病学分会制订的《新型冠状病毒肺炎合并肝损伤的预防及诊疗方案》[5]。
肝损伤主要表现在肝生化指标异常(ALT、AST、ALP、GGT、ALB、TBIL)及PT或PTA异常。GUAN等[2]对全国30个省、自治区、直辖市552家医院收治的1 099例确诊COVID-19患者的临床特征进行了分析,结果显示,ALT、AST、TBIL异常比例分别为21.3%、22.2%、10.5%,而ALP、GGT均未见明显升高,非危重组患者中ALT异常者占19.8%,危重组患者中ALT异常者占28.1%,非危重组、危重组患者中AST异常比例分别为18.2%、39.4%,非危重组、危重组患者中TBIL升高比例分别为9.9%、13.3%。一项对武汉地区COVID-19患者消化系统表现的单中心、描述性研究结果显示,ALT、AST、TBIL异常比例分别为25.0%、31.9%、2.0%,仅1例患者ALT(385 U/L)、AST(588 U/L)显著升高,且ALP(235 U/L)、GGT(224 U/L)也显著升高,危重组患者入院时肝功能异常比例(67.4%)高于非危重组(34.1%)[4]。CHEN等[1]纳入了武汉金银潭医院99例确诊患者,其中出现肝损伤43例,ALT、AST、TBIL、ALB、PT异常比例分别为28.0%、35.0%、18.0%、98.0%、5.0%,也仅有1例患者出现严重肝损伤(ALT 7 570 U/L、AST 1 445 U/L)。一项关于江苏省80例确诊COVID-19患者的多中心描述性研究表明,相较于武汉患者,80例患者中发生肝损伤的比例更低[3.8%(3/80)][8]。白澎等[10]对武汉市58例危重组(重型或危重型)患者的临床特征进行了分析,结果显示,重型和危重型更易发生在老年患者和有基础疾病者中,更易出现肝损伤,ALT、AST、ALB异常分别占55.2%、43.1%、74.1%。孙大伟等[11]采用回顾性队列对照研究方法分析了51例COVID-19合并肝损伤的相关因素,结果显示,ALT、AST、BIL、ALB、PT异常分别占47.1%、47.1%、9.8%、51.0%、19.6%,且出现ALP、GGT升高,分别占13.7%、35.3%;危重组患者发生肝损伤比例(63.3%)高于非危重组(47.6%)。总之,COVID-19合并肝脏损害发生率较高,临床表现多为轻度肝损伤,主要为肝酶中ALT和(或)AST升高,ALP和GGT升高不明显(仅少数文献提及有ALP、GGT升高[4,11]),也较少出现胆红素升高,部分患者可出现ALB下降及PT延长。同时发现,危重组更多见于合并有基础疾病者和老年患者,且肝损伤表现相较于非危重组更突出。此外,武汉地区重症病例和死亡病例比例较非武汉地区明显增高,那么合并肝脏损害的比例是否更高呢?表1中文献的数据大部分来自武汉地区病例,仅WU等[8]数据来源于江苏省、XU等[9]数据来源于浙江省、姚娜等[13]来源于陕西省、刘川等[14]数据来源于非武汉地区7家定点医院。对比数据发现,非武汉地区COVID-19合并肝损伤发生率相对武汉地区低,除陕西省[55.0%(22/40)]外,考虑可能与此部分病例来源于陕西空军军医大学唐都医院,收治的危重症患者更多有关。但尚有待于非武汉地区的更多数据进一步支持。
本例女性患者发病期14 d内无武汉及周边地区旅居史,入院时患者即出现轻度肝功能异常,表现为AST、GGT轻度升高[<2×正常值上限(ULN)],ALT、ALP、TBIL、ALB、PT均在正常范围内,而在疾病发生、发展和治疗过程中患者肝损伤加重,从图1可见,病程第2、3周肝酶指标具有明显上升趋势,2020年3月7日肝生化指标异常值达高峰,ALT、AST、ALP、GGT均异常升高,尤其是GGT(>10×ULN)、ALT(>7×ULN)、AST(>6×ULN)变化显著。经停用可疑致肝损伤的药物,同时,给予异甘草酸镁、还原性谷胱甘肽等药物抗炎保肝治疗后肝酶指标呈下降趋势,出院前复查肝酶指标基本恢复正常,仅GGT仍升高(103 U/L)。同时,从图2、3、4可见,ALB在病程第2、3周出现轻度下降,而PT、TBIL在正常范围内波动。为解释患者出现上述肝损伤特征,需进一步探讨合并肝损伤的可能病因和发病机制。其中一种可能的机制为病毒直接的毒性作用。关贵文等[17]发现,血管紧张素转化酶2(ACE2)在肝组织中只在胆管上皮细胞表达,而在肝细胞含量微乎其微,认为肝组织中的胆管上皮细胞出现代偿性增生,ACE2表达增多,病毒ACE2受体更易与之结合,从而导致肝损伤的发生,可能为病毒直接作用的机制。本例患者入院时即发现AST、GGT(反映胆管损伤的酶)轻度升高,考虑与上述机制相关,但在疾病发生、发展和治疗过程中患者肝损伤加重,考虑病毒的直接作用机制非本例患者的主要发病机制。且目前现有的文献报道中,反映胆管损伤的ALP、GGT在合并肝损伤患者中无明显升高,可能也说明病毒的直接作用不是主要的发病机制。另一种机制为细胞因子风暴学说,病毒侵入机体,激活机体免疫,导致免疫细胞产生大量炎性细胞因子如白细胞介素-1(IL-1)、IL-6、IL-8、肿瘤坏死因子等,最终导致全身炎症反应综合征、急性呼吸窘迫综合征,以及心脏、肝、肾等多器官衰竭[12,18]。严重心功能不全、循环衰竭、急性呼吸窘迫综合征、多器官功能障碍等导致的肝脏缺血、缺氧再灌注损伤也是可能的发病机制之一。这2种情况多见于病情进展迅速的危重症患者或需入住重症监护病房的患者。本例患者住院期间未出现明显缺血、缺氧、低血压、低灌注等表现,期间监测IL-6(受本院实验室条件限制只能检测此项细胞因子)无明显升高,作者考虑细胞因子风暴和缺血、缺氧机制造成本例患者肝损伤的作用很弱。此外,不能忽视治疗过程中药物导致的肝损伤。目前,使用的抗病毒药物,如洛匹那韦利托那韦、阿比多尔、利巴韦林、α干扰素等[19]和抗感染药物,如莫西沙星,以及中成药、中药汤剂等均可导致肝损伤,原有肝脏基础疾病患者使用上述药物发生肝损伤的概率更大。本例患者停用可疑致肝损伤的药物,同时给予保肝降酶治疗后肝损伤减轻,推测药物性肝损伤是导致本例患者发生肝损伤的主要原因,与汪姝惠等[3]观点一致。然而,药物性肝损伤多表现为ALT、ALP异常,本例患者以GGT升高最为显著,推测可能为综合因素导致肝损伤的结果。
COVID-19合并肝损伤的治疗首先是积极治疗原发病。轻度肝损伤者一般不推荐应用抗炎、保肝药物,应动态监测患者肝生化指标,如ALT、AST、ALB、TBIL、PT变化,进行肝功能分级,及时识别肝衰竭的发生;同时,积极寻找导致肝损伤的原因,关注患者其他脏器功能变化,纠正可能存在的缺血、缺氧损伤,停用或减量使用可疑致肝损伤的药物,必要时可使用1~2种经证实的抗炎、保肝药物[5]。
