家蝇乙酰胆碱酯酶基因密码子优化及酶学特性表征
2021-01-15袁巧敏卢海强谷新晰田洪涛
袁巧敏,卢海强,黄 蕾,谷新晰,李 晨,田洪涛,2*
(1 河北农业大学食品科技学院 河北保定071001 2 国家北方山区农业工程技术研究中心 河北保定071001)
我国已经明文禁止有机磷中的甲胺磷、甲基对硫磷、对硫磷、磷胺、久效磷等剧毒、高毒农药用于果蔬的病虫害防治,而有些果农、菜农及相关企业仍使用这些有机磷农药对害虫进行防治[1]。因过量使用或滥用农药而导致的农药残留及急慢性中毒事件屡见不鲜,故做好农药残留的检测,进而保证食品安全刻不容缓[2]。
基于乙酰胆碱酯酶(achetylcholinesterase,AchE)的酶抑制分析方法(简称酶法)快速、简便,尤其是检测成本低,适宜基层大面积现场筛查的需要,是对大型仪器检测方法的补充[3-4]。其中,核心原材料——AchE 的制备是关键,也一直备受研究者的关注。相比从动植物中分离提取,采用基因工程技术进行重组AchE 的制备是未来的发展方向[5]。
自Schumacher 等[6]首次从电鳐克隆得到AchE 的cDNA 以来,研究者已从鼠、鲤鱼、果蝇等生物体内获取了AchE 的cDNA,并开展重组AchE 的表达研究[7-9]。毕赤酵母(Pichia pastoris)作为一种真核表达系统,除了能对外源蛋白进行翻译后的加工修饰外,还能使产物有效分泌,培养方便、经济[10]。目前国内外有多种昆虫ache 基因利用毕赤酵母系统得到很好的表达。例如,Zhou 等[11]利用该系统表达了重组东亚飞蝗乙酰胆碱酯酶;卢临萍[12]利用该系统表达了家蚕乙酰胆碱酯酶;曹雪等[13]利用该系统大量表达了中华蜜蜂乙酰胆碱酯酶。
鉴于毕赤酵母表达系统的优势及应用前景,本试验通过序列分析并根据毕赤酵母密码子偏好性,对家蝇乙酰胆碱酯酶基因进行密码子替换,构建分泌表达载体pPIC9K-mdAchE,进而实现重组酶mdAchE 在毕赤酵母 GS115 中的高效表达,为进一步将mdAchE 应用于有机磷及氨基甲酸酯类农药残留检测提供依据。
1 材料与方法
1.1 材料与试剂
巴斯德毕赤酵母GS115 和质粒pPIC9K,由本实验室保存;大肠杆菌感受态细胞Trans 1-T1,购自北京全式金生物技术有限公司;T4 DNA 连接酶和限制性内切酶EcoRⅠ、NotⅠ、BglⅡ,购自TaKaRa 公司;质粒小提中量试剂盒和DNA 回收试剂盒,购自Biomiga 公司;8 种有机磷农药(100 μg/mL)和8 种氨基甲酸酯类农药(100 μg/mL),购自农业部环境保护科研监测所;碘化硫代乙酰胆碱 (ATC)和 5,5-二硫双 (2-硝基苯甲酸)(DNTB),购自Sigma 公司。根据《毕赤酵母表达手册》制备最小葡萄糖(MD)琼脂板、缓冲复合甘油培养基(BMGY)和缓冲复合甲醇培养基(BMMY);其它化学试剂为进口或国产分析纯级;核酸测序由上海生工生物工程股份有限公司完成。
1.2 仪器与设备
Sigma 3K15 高速台式离心机,德国Sigma 公司;Biometra Tprofessional PCR 仪,德国Biometra公司;DYY-6C 型电泳仪,北京六一仪器厂;JY04S-3E 型凝胶成像系统,君意电泳;酶标仪,美国伯乐公司。
1.3 方法
1.3.1 乙酰胆碱酯酶的密码子优化 参照Gen-Bank 中乙酰胆碱酯酶基因序列(GenBank:GU220395.1),利用密码子数据库(http://www.kazusa.or.jp/codon)分析序列,采用密码子优化软件(http://www.jcat.de/)设计乙酰胆碱酯酶基因,使其与毕赤酵母GS115 的密码子使用频率相匹配,同时在基因序列的5’端与3’端分别引入EcoRⅠ和NotⅠ酶切位点,将优化后的基因序列送河北本元生物科技有限公司合成。
1.3.2 酵母表达载体的构建 用EcoRⅠ/NotⅠ分别对质粒pMDTM19T-mdAchE 和pPIC9K 进行双酶切,利用胶回收试剂盒对目的酶切产物进行回收,并进行mdAchE 和pPIC9K 的连接反应,构建重组质粒pPIC9K-mdAchE。采用5′AOX 和3′AOX 通用引物对转化子进行验证,将阳性转化子送至上海生工生物工程股份有限公司进行测序。
利用质粒提取试剂盒,提取质粒pPIC9KmdAchE,使用限制性酶BglⅡ将pPIC9K-mdAchE线性化,电转化至GS115 感受态,参照《毕赤酵母表达手册》进行阳性克隆子的筛选。
1.3.3 重组菌株诱导表达及SDS-PAGE 分析挑取单阳性转化子至50 mL YPD 培养基中,30℃,250 r/min 培养12 h。以1%的接种量接种于200 mL BMGY 中,在摇床中30 ℃,250~300 r/min生长至OD600=2~6(约16~18 h),室温8 000×g 离心5 min 收集细胞,去除上清,100 mL BMMY 重悬细胞,放入摇床继续培养,维持甲醇终体积分数为0.5%,每隔12 h 取样,培养72 h 后离心收集发酵液,即为粗酶液,进行活力测定及SDS-PAGE分析。
1.3.4 乙酰胆碱酯酶的酶学性质分析 参照Ellman 等[14]的方法,稍加改进。在酶标板中依次加入以下试剂:25 μL 磷酸盐缓冲液 (0.1 mol/L,pH 8.0),25 μL 8 mmol/L 碘化硫代乙酰胆碱,50 μL适当稀释酶液,25 ℃培养箱孵育10 min,加入50 μL 1.0×105mg/L SDS 终止反应,50 μL 2 mmol/L DTNB 显色,空白则在加入DTNB 后,补加50 μL稀释酶液,显色稳定后在波长412 nm 处测定吸光值,并计算酶活力。
1.3.4.1 pH 值对重组酶mdAchE 的影响 分别在pH 值为5.0~9.0 条件下,测定重组酶mdAchE 的酶活力,分析其最适作用pH 值。将重组酶mdAchE 在pH 值2.0~12.0 的条件下,37 ℃处理1 h,对照为未进行处理的酶,按照标准酶活力测定方法测定酶活力,分析其pH 耐受性。缓冲液为pH 2.0~7.0 的100 mmol/L 柠檬酸-柠檬酸三钠和pH 8.0~12.0 的100 mmol/L 甘氨酸-NaOH。
1.3.4.2 温度对重组酶mdAchE 的影响 将重组酶mdAchE 在最适pH 值下,分别在温度为20~90℃范围内测定重组酶mdAchE 的酶活力,分析其最适反应温度。将重组酶在50,60,70 ℃下,孵育0,5,10,20,30 和60 min 后,测定酶活力,分析其热稳定性。
1.3.4.3 金属离子、有机溶剂及表面活性剂对重组酶mdAchE 的影响 在标准反应条件下,分别测定终浓度1.35×105mol/L、2.70×105mol/L 和6.75×105mol/L 丙酮;2.16×105mol/L、2.15×105mol/L 和2.14×105mol/L 乙醇;0.42×103mol/L 和0.84×103mol/L 吐温;4 mol/L 和6 mol/L 尿素;0.5×104mg/L CTAB 和1.0×104mg/L CTAB;1 mmol/L 和5 mmol/L 的金属离子(Fe3+、Cu2+、K+、Zn2+、Na+、Mg2+、Ca2+、Li+和Mn2+)、EDTA 和SDS 下的乙酰胆碱酯酶酶活力。
1.3.5 重组乙酰胆碱酯酶mdAchE 对农药的敏感性的应用试验 在酶标板中依次加入以下试剂:25 μL 8 mmol/L 碘化硫代乙酰胆碱,75 μL 磷酸盐缓冲液(0.1 mol/L,pH 8.0)稀释的不同浓度农药,50 μL 适当稀释酶液,25 ℃培养箱孵育10 min,加入50 μL 1.0×105mg/L SDS 终止反应,50 μL 2 mmol/L DTNB 显色,显色稳定后在412 nm 波长处测定吸光值ΔAx。对照管为不含农药的正常测定管ΔA0。根据下式计算抑制率:
抑制率(%)=(ΔA0-ΔAx)/ΔA0×100
以农药对mdAchE 的抑制率对农药浓度的对数作图,并计算农药对mdAchE 的抑制中浓度IC50。
1.3.6 数据分析及处理 每组试验平行测定3次,利用SPSS 19.0 软件对结果进行统计分析,平均值±标准差的形式表示所得结果。
2 结果与分析
2.1 乙酰胆碱酯酶的密码子优化
利用密码子在线分析软件发现,家蝇乙酰胆碱酯酶的DNA 序列中有些密码子编码的氨基酸,如GGG/C(Gly),CTA/C(Leu),TAT(Tyr),AGC/T,TCA/G(Ser),GTA(Val),GCA(Ala),ACA/T(Thr),CCG(Pro)等,它们在毕赤酵母中的使用率低于15%,通过基因设计使乙酰胆碱酯酶基因与毕赤酵母GS115 的密码子使用频率相匹配,从而提高mdAchE 的表达水平。将毕赤酵母表达系统中氨基酸最常用的密码子质量值设置为100,其余的密码子质量值相应缩小[15]。密码子优化前密码子质量处于50 以上的约75%,密码子质量处于90以上的约20%;密码子优化后,密码子质量处于50 以上的约99%,密码子质量处于90 以上的约70%,密码子质量明显提高。同时,对乙酰胆碱酯酶各个区段GC 含量进行优化,使GC 含量均保持在45%~55%。每个氨基酸的优化密码子总结见表1。

表1 野生型(wt)和合成型(syn)ache 基因密码子的比较Table 1 Comparison of wild-type (wt)and synthetic (syn)ache gene condons
2.2 乙酰胆碱酯酶基因mdAchE 工程菌株的构建
对质粒pMDTM19T-mdAchE 和质粒pPIC9K分别进行双酶切,使用T4 DNA 连接酶连接双酶切产物,热激转化大肠杆菌Trans I -T1 感受态细胞,构建重组质粒pPIC9K-mdAchE。用5′AOX 和3′AOX 通用引物验证正确的阳性克隆,经测序结果正确。将pPIC9K-mdAchE 质粒电转化巴斯德毕赤酵母GS115 产生56 个阳性克隆子。经过对阳性克隆子诱导表达,筛选出3 株高产菌株,分别为mdAchE-2、mdAchE-4 和mdAchE-7。
2.3 重组菌株mdAchE 的诱导表达及其产物的SDS-PAGE 分析
将重组菌株按1.3.4 节的方法进行培养和诱导表达之后,对细胞发酵液进行酶活检测,结果显示,发酵液中乙酰胆碱酯酶的酶活力为8.82 U/mL。进一步对诱导不同时间的重组菌发酵液进行SDS-PAGE 蛋白电泳检测,结果见图1。
图1可见,发酵产物在约63 ku 处出现显著蛋白条带,而这与AfTanA 的蛋白理论分子质量(76.84 ku)存在一定的差异,蛋白分子质量偏小的原因可能是某些氨基酸的组成导致了电泳迁移率变小[16]。
2.4 重组酶mdAchE 酶学性质分析
根据1.3.4.1 节和1.3.4.2 节试验方法进行pH值与温度对重组乙酰胆碱酯酶mdAchE 影响的酶学性质分析,结果见图2。

图1 重组乙酰胆碱酯酶mdAchE SDS-PAGE电泳分析Fig.1 Sodium dodecy sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)analysis of recombinant mdAchE
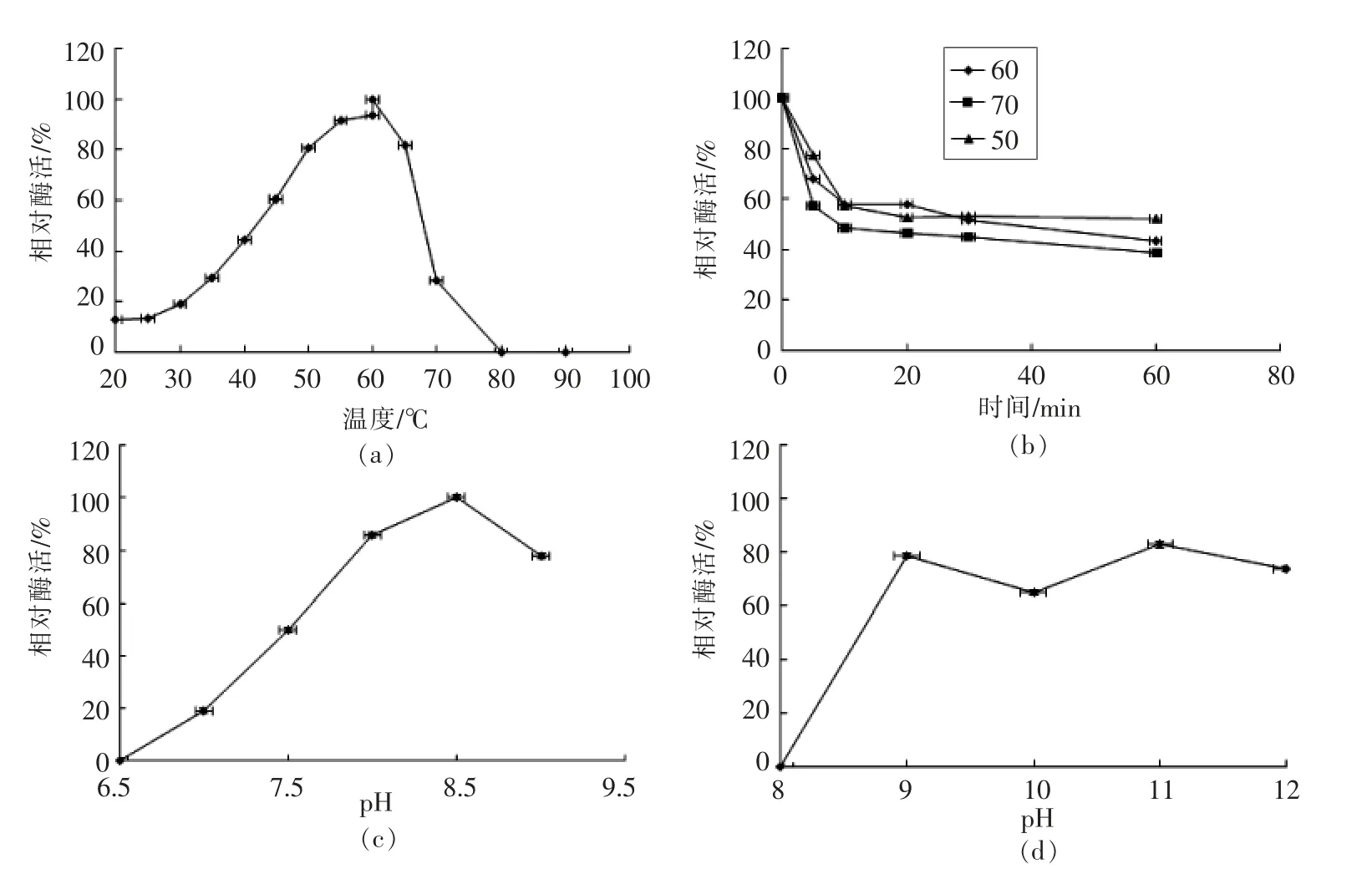
图2 温度和pH 值对重组乙酰胆碱酯酶mdAchE 的影响Fig.2 Effect of temperature and pH on recombinant mdAchE
图2a、图2b 显示,重组酶mdAchE 在20~80℃有活力,在50 ℃和65 ℃酶活力相当,其最适反应温度为60 ℃。在50,60,70 ℃3 个温度处理下的前20 min 其酶活力均下降得非常明显,在50℃处理1 h,mdAchE 酶活性损失了50%;在60 ℃处理1 h 后,mdAchE 相对酶活损失了60%;70 ℃处理1 h,mdAchE 酶活性仅剩38%。
图2c、图2d 表明,重组酶mdAchE 在pH 6.5~9.0 的条件下有活力,最适反应pH 值为8.5。在pH 值2.0~8.0 处理1 h 后,mdAchE 酶活性全部丧失;在pH 9.0 和11.0 处理1 h 后,mdAchE 相对酶活性保持在80%左右;在pH 8.5 和12.0 处理1 h 后,mdAchE 酶活性均保持在65%以上,由此可知重组酶mdAchE 在碱性条件下酶活力较为稳定。
2.5 金属离子、有机溶剂及表面活性剂对重组酶的影响
根据1.3.4.3 节试验方法进行金属离子、有机溶剂及表面活性剂对重组乙酰胆碱酯酶mdAchE影响的酶学性质分析,结果见表2。

表2 各种化学试剂及金属离子对mdAchE 活力的影响Table 2 The effect of various chemical reagents and metal ions on the activity of mdAchE
表2表明,不同种类的金属离子、有机试剂及表面活性剂对酶活力影响存在差异,且不同浓度也存在差异。只有Li+、Na+、K+、EDTA 对mdAchE活性无抑制作用,其余金属离子、有机试剂及表面活性剂对mdAchE 的抑制作用均随着试剂浓度提高而增强。Cu2+、Mn2+、Fe3+和吐温80 在低浓度条件下对mdAchE 活性完全抑制;2.16×105mol/L 和2.14×105mol/L 的乙醇对mdAchE 活性具有轻微的抑制作用,相对活性分别为52.8%和34.8%;1.0×104mg/L 的SDS 对mdAchE 活性具有较强的抑制作用,抑制了将近80%的酶活力;而1.0×105mg/L 的SDS 对mdAchE 活性完全抑制;4 mol/L 尿素对mdAchE 活性具有轻微抑制作用,相对活性为56.7%;6 mol/L 尿素对mdAchE 活性具有较强的抑制作用,抑制作用为84.2%。
2.6 重组乙酰胆碱酯酶mdAchE 对农药敏感性的应用试验
目前多数文献[5,11,17]都用抑制中浓度IC50来评价mdAchE 对农药的敏感性,IC15表示mdAchE 可以检测到农药浓度的最低限,并且IC50越低,mdAchE 敏感性越强。根据1.3.5 节试验方法进行重组乙酰胆碱酯酶mdAchE 对农药的敏感性的应用试验,结果见表3。
表3显示,mdAchE 的活性对农药浓度在一定区间内呈正相关。不同农药对mdAchE 活性抑制存在差异,7 种有机磷和8 种氨基甲酸酯类农药对mdAchE 的IC50由小到大顺序为:马拉硫磷<仲丁威<克百威<叶蝉散<倍硫磷<速灭威<西维因<涕灭威<抗蚜威<残杀威<久效磷<敌敌畏<乐果<草甘磷<毒死蜱。7 种有机磷农药对mdAchE 的IC50差异较大,而氨基甲酸酯类农药对mdAchE 的IC50差异较小,其中mdAchE 对马拉硫磷的敏感性最强,IC50为3.9×10-8μg/mL,而对草甘磷和毒死蜱的敏感性很弱,IC50分别为1.96×109μg/mL 和1.51×1022μg/mL。根据IC15可以进一步说明mdAchE 可以用于多种低浓度有机磷和氨基甲酸酯类农药残留的检测。

表3 有机磷和氨基甲酸类农药抑制mdAchE 的IC50 值比较Table 3 Comparison of IC50 values of organophosphorus and carbamate pesticides inhibiting mdAchE
3 讨论
乙酰胆碱酯酶具有较高的应用价值,但在天然宿主菌和原核表达体系中表达量很低,如王栋[18]曾利用大肠杆菌作为宿主菌表达家蝇乙酰胆碱酯酶,虽能检测到活性,但表达量极低。巴斯德毕赤酵母基因表达系统经过近十年发展,以其高效、实用、简便,表达量高并保持产物生物学活性的优点脱颖而出,已高效表达了HBsAg、TNF、EGF、破伤风毒素片段、基因工程抗体等多种外源基因[19]。密码子优化已被广泛和成功地用于提高外来蛋白质的表达水平,在巴斯德毕赤酵母中已有很多成功应用的实例[20-22]。基于以上两点,在本研究中,根据巴斯德毕赤酵母密码子使用的偏好性优化设计了编码家蝇乙酰胆碱酯酶mdAchE 的基因,基因中大多数密码子是从巴斯德毕赤酵母中最常用的密码子中复制的,以防止编码相同氨基酸的tRNA潜在耗尽[23]。结果表明,根据表达宿主的密码子偏好进行的修饰是有效的,改造后的家蝇乙酰胆碱酯酶在毕赤酵母GS115 中实现了mdAchE 的分泌表达。
本研究利用毕赤酵母表达的mdAchE 具有良好的酶学特性:重组酶mdAchE 最适pH 值为8.5,而抑制试验中所用的中磷酸盐缓冲液的pH 值为8.0,因此重组酶mdAchE 更适用于农药敏感性测定;重组酶mdAchE 最适温度为60 ℃,这就使得mdAchE 在对酶温度要求较高的食品、化学制品应用方面具有更好的优势[24]。不同浓度的金属离子对mdAchE 酶活力的影响差异显著,抑制作用Mg2+>Ca2+>Zn2+>Cu2+>Mn2+>Fe3+,1 mmol/L Fe3+相对酶活力最低,随着离子浓度的增大,相对酶活力基本呈下降趋势;随着有机溶剂体积分数的增大,它们(尿素、乙醇、丙酮)对酶活力的抑制作用增强,其原因可能是一方面酶的“柔性”因含水量的下降而减小[25],导致酶抵抗失活的能力减弱,另一方面有机溶剂的分子会介入酶分子的内部,改变了酶微环境的极性,从而降低酶的催化活性[26]。
mdAchE 对本研究中检测的15 种有机磷和氨基甲酸酯类农药中的10 种表现出高度敏感性。其中对敌敌畏、马拉硫磷和乐果等有机磷农药的最低检测限均低于正在实施的国家标准[27];对克百威、仲丁威等氨基甲酸酯类农药的最低检出限低于李艳芳等[28]采用液相色谱-质谱法测定的农药最低检测限;与李纯睿[29]获得的拟环纹豹蛛AchE相比,重组酶mdAchE 对多数有机磷和氨基甲酸酯类农药表现出更高的敏感性。
本研究将密码子优化后的家蝇乙酰胆碱酯酶基因,在毕赤酵母中进行异源表达,并探究了重组酶mdAchE 的性质,其对于多数有机磷和氨基甲酸酯类农药的最低检测浓度在0.05~0.1 μg/mL,有些浓度甚至低于2.5×10-7μg/mL,低于多种检测方法测得的最低检测浓度[30-32],降低了农药残留检测的最低浓度阈值。这些结果都表明重组酶mdAchE在有机磷及氨基甲酸酯类农药残留检测方面具有很强的应用潜力。虽然重组酶mdAchE 在毕赤酵母中成功表达,但其表达量不高(酶的比活力为47.16 U/mg),一些氨基酸结构[33]、稀有密码子[34]的选用对蛋白质在外源表达系统的表达量也有很大的影响,在之后的试验中将对此进行更加深入的研究,以期提高家蝇乙酰胆碱酯酶的表达量。
