岩藻黄质的抗脂质氧化活性研究
2021-01-15纪晓林孙一含乔昕昱董秀芳
隋 悦,纪晓林,孙一含,乔昕昱,奚 倩,董秀芳,启 航*
(1 大连工业大学食品学院 辽宁大连116034 2 国家海洋食品工程技术研究中心 辽宁大连116034 3 塔里木大学生命科学学院 新疆阿拉尔843300)
脂质氧化是脂质及含油食品败坏的主要原因之一。脂质在储藏期间,因空气中的氧气、光照、微生物和酶的作用,产生一些有毒的化合物[1],这些化合物会对食用油脂的风味、色泽以及组织产生不良的影响,以至于缩短货架期,降低油脂的营养品质,而且在酸败过程中产生对人体有害的过氧化物和自由基,可导致机体衰老,引发肿瘤、心血管病等各种病症[2-3]。选择功能性脂质抗氧化剂对于保持食品品质具有实际意义。
岩藻黄质是一类脂溶性色素,广泛存在于具有光合作用的藻类、海洋浮游植物、水生贝壳类等动植物组织内,而藻类中岩藻黄质广泛分布于褐藻纲、金藻纲、硅藻纲中,在红藻纲以及甲藻纲中只含少部分的种类[4]。在褐藻中岩藻黄质的含量比胡萝卜素和叶黄素的总量之和还要高。国内外对于岩藻黄质活性已有大量研究,岩藻黄质具有抗肥胖活性、抗炎活性、抗肿瘤活性、调节血糖量、抗氧化活性等功效[5-8],是海洋资源中丰富存在的天然抗氧化剂。
电子自旋共振(electron spin resonance,ESR)又称电子顺磁共振,是在磁场中测量未成对的电子[9],可以探测和识别具有未成对电子的分子,是检测自由基最直接、有效的方法[10],其检测灵敏度高,样品消耗量小,效率较高。近年来ESR 技术被逐渐应用到食品行业的质量控制和检测。2016年Qi 等[11-12]用ESR 技术检测UVA 照射下海参刺参体壁匀浆中的ROS 和海参刺参自溶。2017年,李楠等[13]使用ESR 技术研究水产品加工过程中的氧化物质生成及抗氧化剂与其相互作用的关系。2018年,冯丁丁等[14]使用ESR 技术研究海参热加工过程中的氧化物质。董秀芳等[15]使用ESR 技术研究4 种天然提取物在即食海参杀菌工艺中的作用。
本研究以鱼油与猪油为模型检测岩藻黄质的抗氧化活性,采用ESR 检测技术研究岩藻黄质对鱼油、玉米油、亚油酸、亚油酸盐的自由基清除活性的影响,为解决食品中脂质氧化提供了新的天然抗氧化剂。对于利用ESR 技术手段开发海洋来源的天然抗氧化剂,具有重要的意义。
1 材料与方法
1.1 材料与试剂
岩藻黄质(50%,褐藻来源),美仑生物有限公司;脂肪酶(30 000 U/mg)、4-硝基苯基月桂酸酯(98%),北京百灵威科技有限公司;亚油酸钠(95%)、亚油酸、鱼油,上海阿拉丁生化科技股份有限公司;玉米油,上海西陇生化科技有限公司;α-(4-吡啶基-N-氧化物)-N-叔丁基硝酮(POBN),TCI(上海)化成工业发展有限公司;Triton X-100,西格玛奥德里奇公司。其它试剂均为国产分析纯级。
1.2 设备与仪器
台式冷冻离心机 (Sorvall Legend Micro17R型),Thermo Scientific;电子顺磁共振波谱仪(ESR)(A200),德国Bruker Opertics;数显匀浆机(T25),德国IKA 公司;数显恒温水浴锅(HH-4型),常州智博瑞仪器制造有限公司;超低温冰箱(MDF-U53V),SANYO 公司;立式压力蒸汽灭菌器(YXQ-LS-50SII),上海博迅实业有限公司医疗设备厂;漩涡混合器(Ms1),上海精科实业有限公司;干浴器(DRY BLOCK HEATER 2),德国IKA公司。
1.3 方法
1.3.1 原料处理 采用甲醇溶液,在40 ℃下将50%纯度的岩藻黄质粉末提取2 h,离心后收集上清液-30 ℃贮藏备用。根据HPLC 法鉴定,提取液中岩藻黄质的纯度达到90%以上。
1.3.2 岩藻黄质对鱼油氧化模型的抗氧化作用取80 μL 鱼油于1.5 mL EP 管中并向其中添加20 μL 含有岩藻黄质的甲醇溶液,岩藻黄质在鱼油中终质量浓度为4 mg/mL,二者充分振荡混合均匀。将空白组和试验组一同放入恒温振荡水域锅中,150 r/min,在50 ℃温度下,使用恒温振荡器加热不同的时间(0,3,6,9 h),加热过程中保持150 r/min 转速。每组试验进行3 次平行试验。采用传统的TBARS 试验方法对鱼油氧化产生的氧化物进行定量。将15%三氯乙酸以及0.375%硫代巴比妥酸溶于0.25 mol/L 盐酸溶液中。取1 mL 上述溶液添加到氧化后的鱼油中涡旋振荡,随后在80 ℃的水浴中加热15 min,在冰浴中冷却到室温,并在532 nm 下测定粉色色素原溶液吸光值。
1.3.3 岩藻黄质对猪油氧化模型的抗氧化作用参照Wettasinghe 等[16]的方法,并稍作修改。取100 g 五花肉,并向其中添加20%去离子水,再向其中添加甲醇溶解的提取物岩藻黄质,使其质量浓度为0.003 mg/mL,作为试验组,空白组直接加入甲醇即可。随后将其匀浆。将匀浆液至于80 ℃水浴中,加热40 min,每隔5 min 搅拌一次。将加热搅拌后的匀浆液置于4 ℃层析柜中,在第0,10,20天时采用硫代巴比妥酸法进行MDA 检测。
硫代巴比妥酸法:在第0,10,20 天时取2 g肉加入5 mL 10% TCA 溶液高速剧烈振荡2 min,随后加入5 mL 0.02 mol/L 的TBA 水溶液,再高速剧烈振荡30 s。将上述体系进行离心(3 000×g,10 min),将上清夜采用Waterman No.3 进行过滤,将过滤后的上清液至于沸水中45 min 后,在532 nm 下测量吸光值。
1.3.4 基于ESR 技术研究岩藻黄质对4 种油脂氧化模型的自由基清除作用
1.3.4.1 岩藻黄质对鱼油及玉米油氧化模型的自由基清除作用 检测脂质氧化初期所产生的脂质自由基采用由Velasco 等[17]描述的电子自旋共振波谱技术。取1 mL 鱼油或玉米油于2 mL EP 管中,向上述EP 管中加入含有POBN 的甲醇溶液并使体系内POBN 终浓度为(1.00±0.05)mmol/L,POBN 为一种典型的脂类自由基捕获剂,又称叔丁基氮酮。再向EP 管中添加不同浓度的岩藻黄质使其在体系中的终质量浓度为10,50,100,200,300 ng/mL 以及BHT(阳性对照),同时向空白中添加等体积的甲醇。将EP 管置于80 ℃水浴锅中,在第1,2,3 小时采用ESR 对脂质自由基清除情况进行考察。采用毛细管吸取约80 μL 样品溶液,并采用凡士林将管底封住,放入石英玻璃管中随后放入ESR 谐振腔内进行检测。ESR 检测条件:微波功率1.79 mW,扫描宽度80 Gauss,调制频率100 kHz,调制幅度1.0 Gauss,转换时间240 ms,时间常量65.36 ms。波谱图中首个出现峰的峰高与峰谷的距离代表了POBN 与自由基加和产物的量。峰高与峰谷差值越大则产生自由基的量越大,反之亦然。

1.3.4.2 岩藻黄质对亚油酸氧化模型的自由基清除作用 取450 μL 去离子水于2 mL EP 管中,将50 μL 溶解有亚油酸的甲醇溶液添加到EP 管中使其终质量浓度为0.8 mg/mL。添加2.5 μL 浓度为1 mmol/L 的POBN 溶液,再向EP 管中添加不同浓度的岩藻黄质使其终质量浓度为10,50,100,200,300 ng/mL 以及BHT(阳性对照),同时向空白中添加等体积的甲醇。将EP 管置于(80±0.1)℃水浴锅中,在第10,20,30 分钟采用ESR 对脂质自由基清除情况进行考察。
采用毛细管吸取约80 μL 样品溶液,并采用凡士林将管底封住,放入石英玻璃管中,随后放入ESR 谐振腔内进行检测。ESR 检测条件参照1.3.4.1节试验中的检测条件。
1.3.4.3 岩藻黄质对亚油酸盐氧化模型的自由基清除作用 取4 mg 亚油酸盐溶于10 mL 去离子水中并取0.5 mL 于2 mL EP 管中。向上述2 mL EP 管中添加岩藻黄质醇溶液使其在体系中的终质量浓度为50,100,200,300 ng/mL。空白组中添加相同体积不含岩藻黄质的醇溶液,并向所有EP管中添加自由基捕获剂POBN,使其在体系中的终质量浓度为(1.00±0.05)mg/mL。将EP 管置于(80±0.1)℃水浴锅中,在第10,20,30 分钟时采用ESR 对脂质自由基清除情况进行考察。ESR 检测条件参照1.3.4.1 节试验中的检测条件。
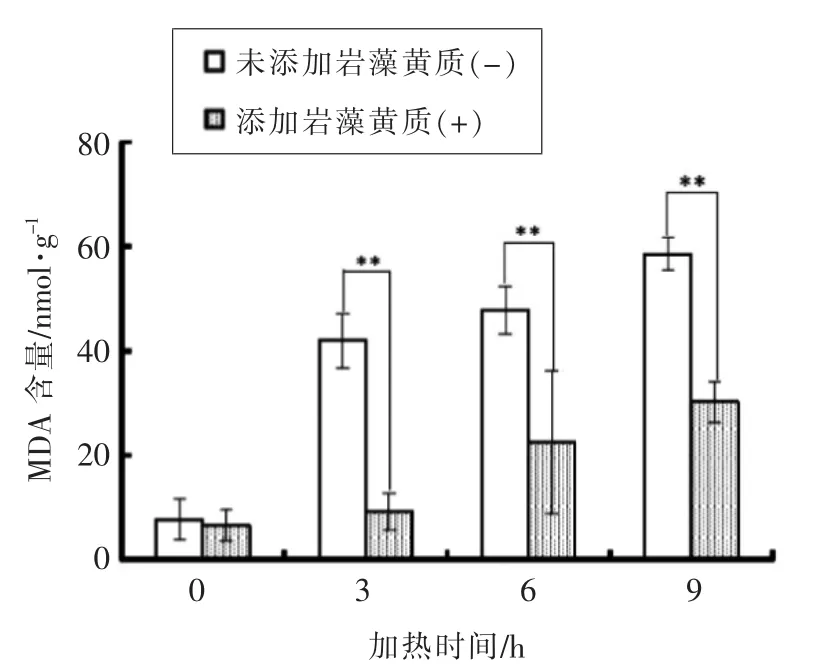
图1 鱼油加热期间MDA 值变化Fig.1 Changes of MDA content during fish oil heating
1.3.5 数据统计 采用Excel 2013 版软件和SPSS 软件对数据进行统计分析,采用单因素方差分析(ANOVA),P<0.05 被认为显著,P<0.01 被认为极显著。
2 结果与分析
2.1 岩藻黄质对鱼油氧化模型的抗氧化作用
鱼油富含n-3 系多不饱和脂肪酸,这些高度不饱和脂肪酸极易被氧化酸败,降低鱼油的营养价值,甚至产生毒害作用。为此向鱼油中加入抗氧化物质成为了研究重点[18]。如图1所示,在加热氧化初期岩藻黄质表现出极强的抗鱼油氧化能力,当加热氧化时间为3 h 时,与空白组相比抑制78.1% MDA 生成,加热氧化时间为6 h 时,与空白组相比抑制52.9% MDA 生成。但随着加热时间的延长岩藻黄质的抑制作用出现减弱,当加热氧化9 h 时,抑制48.5% MDA 生成。这可能是因为岩藻黄质对光、热、pH 值等条件较为敏感[19],使岩藻黄质结构不稳定,导致其抗氧化能力下降。但在整个过程中岩藻黄质均表现出较强的抗鱼油氧化能力。
2.2 岩藻黄质对猪肉油氧化模型的抗氧化作用
目前常用的抗氧化剂如BHT、BHA、TBHQ 等对肉的腐败变质有一定的作用,但因具有潜在的致癌性,发达国家已限制流通使用[20]。人们更加关注安全、高效的天然抗氧化剂[21]。
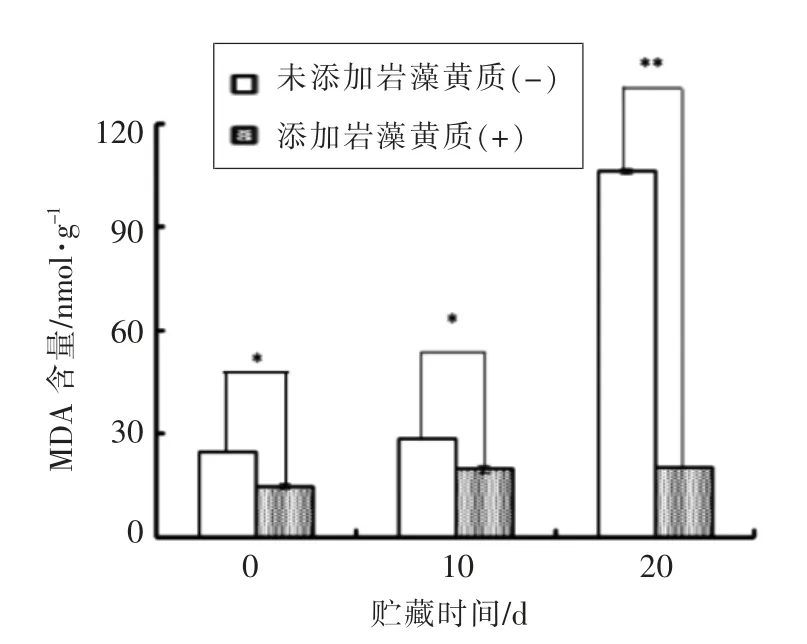
图2 猪肉储藏时期MDA 值的变化Fig.2 Changes of MDA content in pork during storage
如图2所示,贮藏时间的延长会促进五花肉样品中的脂质氧化,使脂质过氧化产物丙二醛(MDA)增高。经岩藻黄质处理的试验组在第10 天到第20 天期间MDA 无明显变化。与鱼油氧化模型不同,猪肉避光贮藏在4 ℃冰箱中为岩藻黄质提供了良好的稳定环境,使岩藻黄质结构稳定,故其抗氧化能力保留时间较长,在第10 天以及第20 天岩藻黄质均表现出良好的抗氧化能力。该结果表明岩藻黄质对猪油脂质氧化具有抑制作用。
2.3 基于ESR 技术研究岩藻黄质对食品氧化模型的抗氧化作用
2.3.1 岩藻黄质对鱼油及玉米油氧化模型的抗氧化作用 ESR 波谱技术能检测自由基中的单电子自旋翻转所产生的共振现象,目前被广泛应用在食品加工贮藏中氧化过程产生的自由基分析[22]。但是由于一些小分子自由基极不稳定,很难直接利用ESR 波谱检测到信号[23]。通过添加自旋捕集剂生成加合物,浓度达到或大于10-7~10-6mol/L 可以检测到该加合物的信号来表征原有自由基。本试验向食品模型中添加POBN 捕获剂以便捕获模型氧化产生的自由基[24]。
如图3和图4所示,当随着岩藻黄质浓度增加,抑制效果也随着明显提升。各浓度岩藻黄质对鱼油氧化抑制效果随着加热时间的增加而有所增强。当岩藻黄质质量浓度为10 ng/mL,加热氧化1 h 时模型中自由基残留率为(91.30±11.86)%,而当加热氧化2 h 时自由基残留率降低到(75.76±9.01)%。试验表明当岩藻黄质质量浓度较低时抑制能力不如BHT 强,但随着质量浓度的增加,当增加到100 ng/mL 时抑制效果明显强于BHT,且随着加热氧化时间延长大浓度岩藻黄质抑制效果明显强于BHT。上述结果表明岩藻黄质能够显著抑制鱼油氧化过程中产生的脂质自由基。
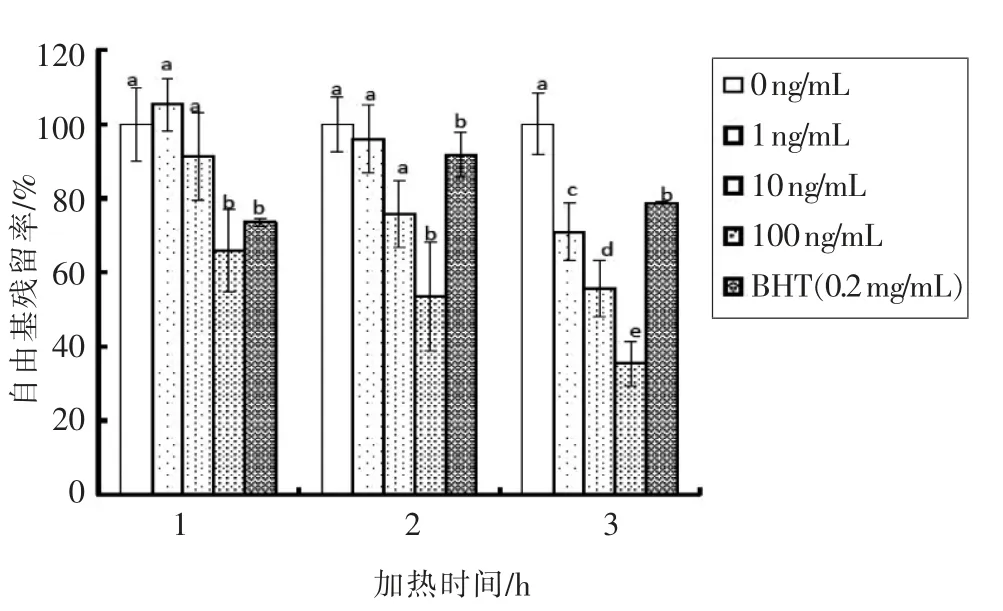
图3 岩藻黄质对鱼油氧化模型加热过程中脂质自由基生成量的影响Fig.3 Effect of fucoxanthin on the amount of lipid free radical production of fish oil model during the thermal processing
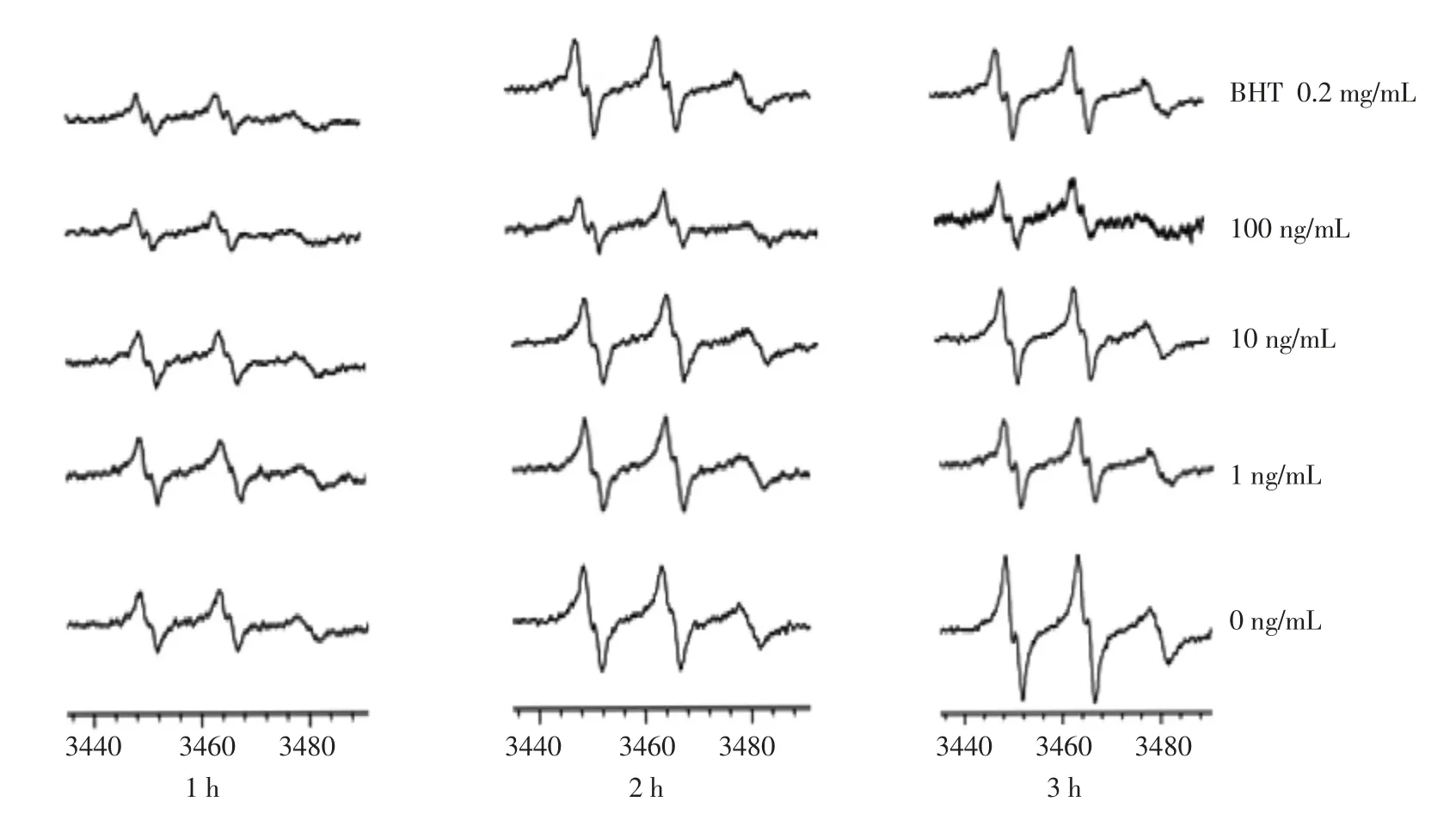
图4 岩藻黄质对鱼油氧化模型加热过程中脂质自由基生成量的ESR 图Fig.4 ESR spectrum of effecting of fucoxanthin on the amount of lipid free radical production of fish oil model during the thermal process
如图5和图6所示,当岩藻黄质质量浓度较低以及加热时间较短时,抑制玉米油产生自由基的效果随质量浓度的变化不大。这可能是由于玉米油中主要的不饱和脂肪酸为亚油酸和亚麻油酸,二者含量占总脂肪酸含量的50%以上[25],使其不饱和度较低。因为玉米油含有较多的维生素E,具有良好的抗氧化作用[26]。且玉米油中的植物甾醇含量也很高,甾醇和甾醇酯总量超过1 000 mg/kg[27]。此外有报导介绍,玉米油甘油酯上第二位酯化的脂肪酸,有98%是不饱和脂肪酸,而外侧第1和第3 位上酯化的几乎全部是饱和脂肪酸[28]。由此在加热时间较短以及岩藻黄质浓度较低时,抑制效果变化不大。在短时间加热时只有当岩藻黄质质量浓度达到100 ng/mL 时表现出明显的抑制作用。长时间加热下高浓度岩藻黄质有较强的抑制能力。图中各个时间点下BHT 抑制效果与岩藻黄质质量浓度为50 ng/mL 时相接近。该研究结果表明高质量浓度的岩藻黄质能够有效抑制玉米油氧化初期所产生的自由基。
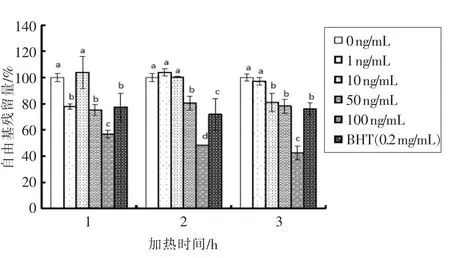
图5 岩藻黄质对玉米油氧化模型加热过程中脂质自由基生成量的影响Fig.5 Effect of fucoxanthin on the amount of lipid free radical production of corn oil model during the thermal processing
图6 岩藻黄质对玉米油氧化模型加热过程中脂质自由基生成量的ESR 图Fig.6 ESR spectrum of effecting of fucoxanthin on the amount of lipid free radical production of corn oil model during the thermal processing
2.3.2 岩藻黄质对亚油酸氧化模型的自由基清除作用 结果如图7和图8所示,在不同加热氧化时间下脂质自由基的抑制效果均随岩藻黄质质量浓度的增加而增强。当加热氧化20 min 时,模型中岩藻黄质质量浓度为100 ng/mL 时脂质自由基残留率为(64.51±7.60)%。当岩藻黄质质量浓度为200 ng/mL 时,自由基残留率下降到(40.76±10.13)%。而当岩藻黄质质量浓度达到300 ng/mL 时,自由基残留率下降到(38.94±0.59)%,但岩藻黄质抑制效果不如人工合成的BHT 作用效果强。赵文恩等[29]研究了5 种类胡萝卜素对亚油酸甲酯氧化的抑制作用,结果发现这种类胡萝卜素均通过自身消耗达到抗氧化效果。

图7 岩藻黄质对亚油酸氧化模型加热过程中脂质自由基生成量的影响Fig.7 Effect of fucoxanthin on the amount of lipid free radical production of linoleic acid model during the thermal processing
图8 岩藻黄质对亚油酸氧化模型加热过程中脂质自由基生成量的ESR 图Fig.8 ESR spectrum of effecting of fucoxanthin on the amount of lipid free radical production of linoleic acid model during the thermal processing
2.3.3 岩藻黄质对亚油酸盐氧化模型的自由基清除作用 如图9和图10各加热时间下随着岩藻黄质质量浓度的增加,抑制效果均得到增强,但当岩藻黄质质量浓度增加到200 ng/mL 后,抑制效果逐渐平缓,达到了抑制的上限。当加热20 min,岩藻黄质质量浓度为200 ng/mL 时,自由基残留率为(54.37±1.72)%,而当岩藻黄质质量浓度为300 ng/mL 时,自由基残留率为(46.66±9.96)%。在加热时间较短时(10,20 min),岩藻黄质表现出较好的抑制自由基效果,加热时间10 min,岩藻黄质质量浓度为300 ng/mL 时,自由基残留率为(33.10±1.06)。随着加热时间的延长,BHT 和VC 表现出了更好的抑制效果。由于VC 为水溶性[30],所以在亚油酸盐模型中重现性不佳。
3 结论
岩藻黄质可以有效抑制鱼油与猪油的氧化。同时,基于ESR 检测方法发现岩藻黄质能够有效抑制鱼油、玉米油、亚油酸、亚油酸盐4 种食品模型氧化初期所产生的脂质自由基,对上述4 种食品模型具有较强的抗氧化作用。本研究为日后开发抗氧化功能食品提供了一定的理论基础和参考方向,有一定的潜在价值。
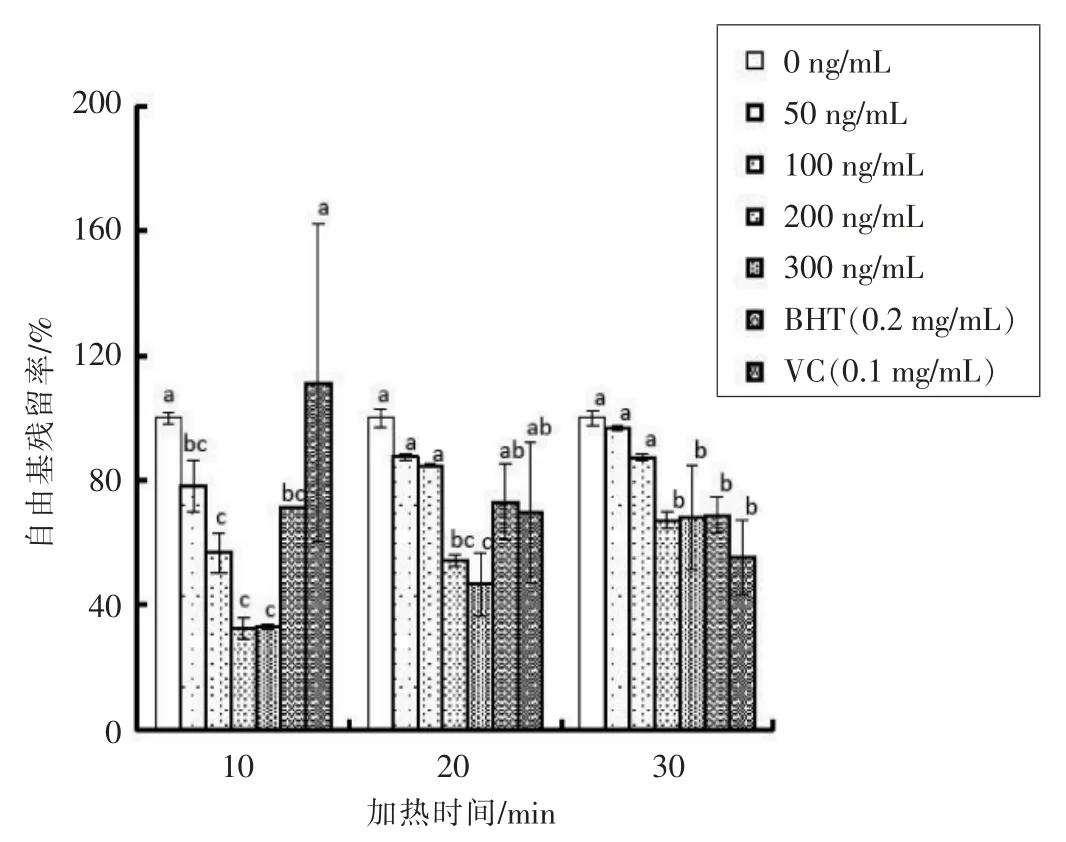
图9 岩藻黄质对亚油酸盐模型加热过程中脂质自由基生成量的影响Fig.9 Effect of fucoxanthin on the amount of lipid free radical production of linoleate model during the thermal processing

图10 岩藻黄质对亚油酸盐模型加热过程中脂质自由基生成量的ESR 图Fig.10 ESR spectrum of effecting of fucoxanthin on the amount of lipid free radical production of linoleate model during the thermal process
