长链非编码RNA SNHG15通过miR-141-3p /KLF9机制调控鼻咽癌细胞增殖的实验研究
2021-01-15易亭伍宿向东
易亭伍,梁 睿,宿向东
(1.四川省乐山市人民医院肿瘤血液科,四川 乐山 614000;2.四川大学华西临床医学院,四川 成都 610041)
鼻咽癌是我国最常见的头颈部恶性肿瘤之一[1]。同步放化疗明显改善了鼻咽癌患者的局部控制率及生存[2]。但晚期或局部晚期鼻咽癌在经过标准治疗后仍常出现复发及远处转移。所以,研究鼻咽癌增殖转移的分子机制,为治疗鼻咽癌寻找新的药物靶点尤为重要。长链非编码RNA(Long non-coding RNA,lncRNA)在恶性肿瘤的发生与发展中起到重要的调控作用[3]。lncRNA主要通过调控相关的microRNA(miRNA)来影响下游基因的表达,从而影响肿瘤细胞的增殖及分化。长链非编码核仁小RNA宿主基因15(Small nucleolar RNA host gene 15,SNHG15)在肝细胞肝癌[4]、结肠癌[5]等多种恶性肿瘤中扮演着促癌的作用,但其在鼻咽癌中的表达及生物学功能尚无相关报道。本研究探究SNHG15在鼻咽癌中的表达,并分析其下游miRNA调控通路,希望为研究鼻咽癌分子生物学行为及潜在治疗靶点提供参考。
1 材料与方法
1.1 研究材料 本研究共收录50例鼻咽癌标本及28例正常组织。所有组织均由四川大学华西医院的病理科诊断。正常鼻咽上皮组织取自非邻近肿瘤组织。所有受试者已签署知情同意书。人鼻咽上皮细胞系NP69和4种鼻咽癌细胞系,CNE1、CNE2、SUNE1、HONE1均购自美国模式培养物集存库(ATCC)。所有细胞均培养在含10%胎牛血清(FBS)和1%青霉素/链霉素的RPMI-1640培养基中,细胞置于5% CO2、37 ℃细胞培养箱中培养。
1.2 研究方法
1.2.1 细胞转染:将CNE1和SUNE1细胞培养在6孔板中达到60%~70%的密度。将si-SNHG15(上海Genepharma公司,C-01-1804121)、阴性对照序列(NC)分别由转染试剂Lipofectamine 2000转染入细胞。
1.2.2 RNA提取与实时定量PCR:总RNA由Trizol试剂按照制造商说明书进行分离。实时定量PCR采用SYBR green real-time PCR试剂盒(上海Genepharma公司,QPG-043)进行分析。所有结果均采用2-ΔΔCt计算。GAPDH和U6被用于内参对结果进行标准化。引物序列如下:①SNHG15上游引物正向:5’-GCTGAGGTGACGGTCTCAAA-3’;下游引物反向:5’-GCCTCCCAGTTTCATGGACA-3’。②miR-141-3p上游引物正向:5’-CCTCGTCTTGAGCTGAGAGC-3’;下游引物反向:5’-AGGGCTCCCTGAAGGTTACT-3’。③Krüppel样因子9(Krüppel-like factor 9,KLF9)上游引物正向:5’-GCCGCCTACATGGACTTCG-3’;下游引物反向:5’-GGATGGGTCGGTACTTGTTCA-3’。④U6上游引物正向:5’-GCTGAGGTGACGGTCTCAAA-3’;下游引物反向:5’-GCCTCCCAGTTTCATGGACA-3’ 。⑤GAPDH上游引物正向:5’-CGGAGTCAACGGATTTGGTCGTAT-3’;下游引物反向:5’- AGCCTTCTCCATGGTGGTGAAGAC-3’。
1.2.3 CCK8实验:将细胞接种于96孔板中,在指定时间点将10 μl CCK-8试剂添加到每个孔中,通过MRXII微孔板读数仪测定450 nm处的吸光度。
1.2.4 克隆形成实验:将SUNE1和CNE1细胞用6孔板培养2周后,用FBS缓冲液冲洗细胞3次。用4%多聚甲醛将细胞固定,0.05%结晶紫在室温下染色15 min,记录细胞数大于50个的细胞克隆。
1.2.5 细胞凋亡实验:收集经SNHG15 siRNA和对应的阴性参照转染的CNE1或SUNE1细胞,碘化丙啶(PI)染色后在流式细胞仪上进行检测。
1.2.6 核质分离实验:将药物处理后的细胞用PBS(4 ℃)洗涤2 遍,弃去PBS 后加入细胞质裂解液(RLA),冰上孵育20 min,3000 r/min 离心15 min,所得上清液为胞质蛋白。用RLA 洗涤沉淀,反复3 次后加入核裂解液(RIPA),冰上孵育20 min,每隔5 min 涡旋振荡30 s,12500 r/min 离心15 min,上清液为核蛋白。
1.2.7 双荧光素酶检测:利用生物信息学网站预测miR-141-3p和SNHG15或KLF9的结合位点。含有miR-141-3p结合位点的SNHG15或KLF9的荧光素酶质粒均由上海GenePharma合成(E-S-1-190121)。肿瘤细胞分别转染野生型/突变型SNHG15或KLF9质粒、miR-141-3p模拟物(mimics)/阴性对照(NC)质粒后,通过标准化方法测质粒转染后相对荧光度值。
1.2.8 Western blot检测:取上述转染的细胞,用缓冲液NP-4裂解。用配制好的SDS-PAGE分离蛋白,转移到PVDF膜上。用5% BSA将滤过膜封闭,然后将膜对应的一抗在4 ℃下孵育1 h,接着将膜与辣根过氧化物酶结合的二抗在室温下孵育1 h。使用ECL类试剂检测蛋白。
1.3 统计学方法 数据采用SPSS 16.0和GraphPad Prism 5.0 统计学软件进行分析。生存分析采用Kaplan-Meier方法,以P<0.05为差异具有统计学意义。lncRNA与miRNA潜在关联通过Starbase进行分析。
2 结 果
2.1 SNHG15在鼻咽癌组织及鼻咽癌细胞中高表达 见图1。与正常组织相比,SNHG15在鼻咽癌组织中的表达显著增高(P<0.001)。Ⅲ-Ⅳ期鼻咽癌患者肿瘤组织中的SNHG15的相对表达量高于低分期组(P<0.01)。此外,Kaplan-Meier分析结果显示,高表达的SNHG15预示着鼻咽癌患者的不良预后。与人正常鼻咽上皮细胞系NP69相比,SNHG15在4种鼻咽癌细胞系中的表达也显著增高(P<0.01)。
2.2 低表达SNHG15抑制鼻咽癌细胞增殖 见图2。我们选择SUNE1和CNE1细胞进行体外细胞实验。通过在SUNE1和CNE1细胞中转染SNHG15 siRNA敲低细胞中SNHG15的表达,并通过qRT-PCR验证转染效率,结果显示,与阴性对照组相比表达水平均明显下降(P<0.01)。CCK8实验及克隆形成实验结果显示,抑制SNHG15表达能够显著抑制SUNE1和CNE1细胞增殖能力及克隆形成能力(P<0.05)。与阴性对照组相比,转染了SNHG15 siRNA的SUNE1和CNE1细胞凋亡比例明显增高(P<0.01)。2.3 SNHG15吸附并促进miR-141-3p表达 见图3。核质分离实验结果显示,SNHG15大多数分布于SUNE1和CNE1细胞的胞质中。我们通过starbase分析预测发现,miR-141-3p与SNHG15具有可能的结合位点,并设计构建了SNHG15野生型过表达质粒(SNHG15-WT)及SNHG15突变型过表达质粒(SNHG15-MUT)。通过双荧光素酶实验发现,miR-141-3p mimics有效降低了SNHG15 WT组的荧光素酶活性,而SNHG15 MUT组则未见明显的改变。qRT-PCR检测结果发现,miR-141-3p在鼻咽癌组织的表达明显低于鼻咽正常组织,并且鼻咽癌组织中SNHG15的相对表达量与miR-141-3p的表达呈负相关关系。在SUNE1和CNE1转染si-NC及si-SNHG15后通过qRT-PCR检测miR-141-3p的表达情况,结果显示si-SNHG15能够显著促进鼻咽癌细胞中miR-141-3p的表达。
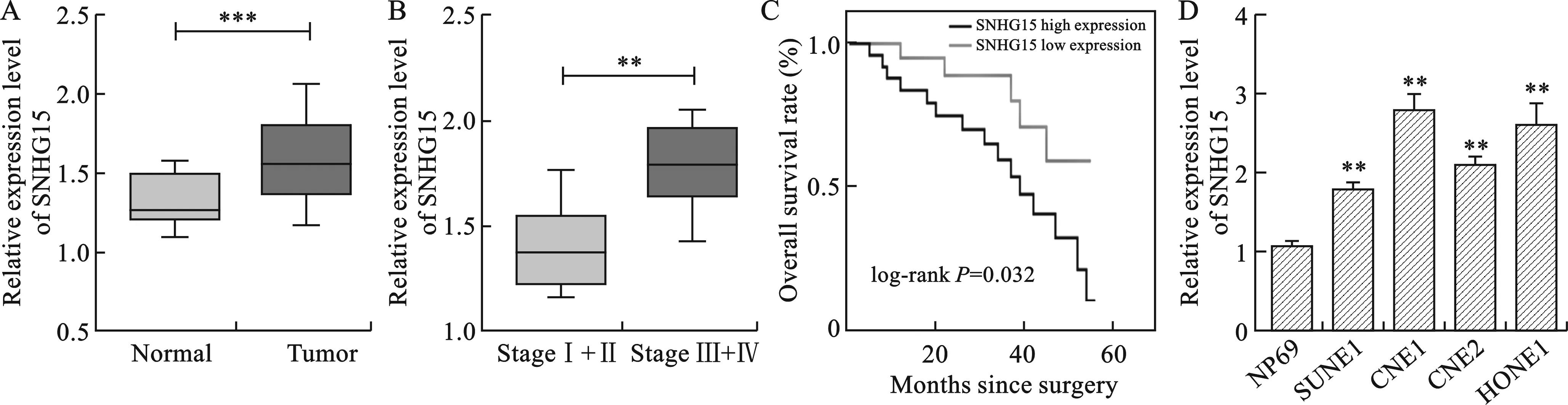
注:A图中,与正常组织相比,***P<0.001;B图中,与Ⅰ-Ⅱ期鼻咽癌患者相比,**P<0.01;D图中,与NP69相比,**P<0.01
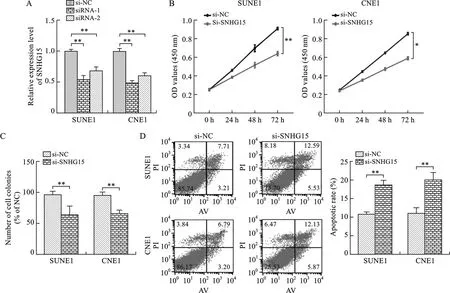
注:A、C、D图中,与阴性对照组相比,**P<0.01;B图中,与阴性对照组相比,*P<0.05,**P<0.01
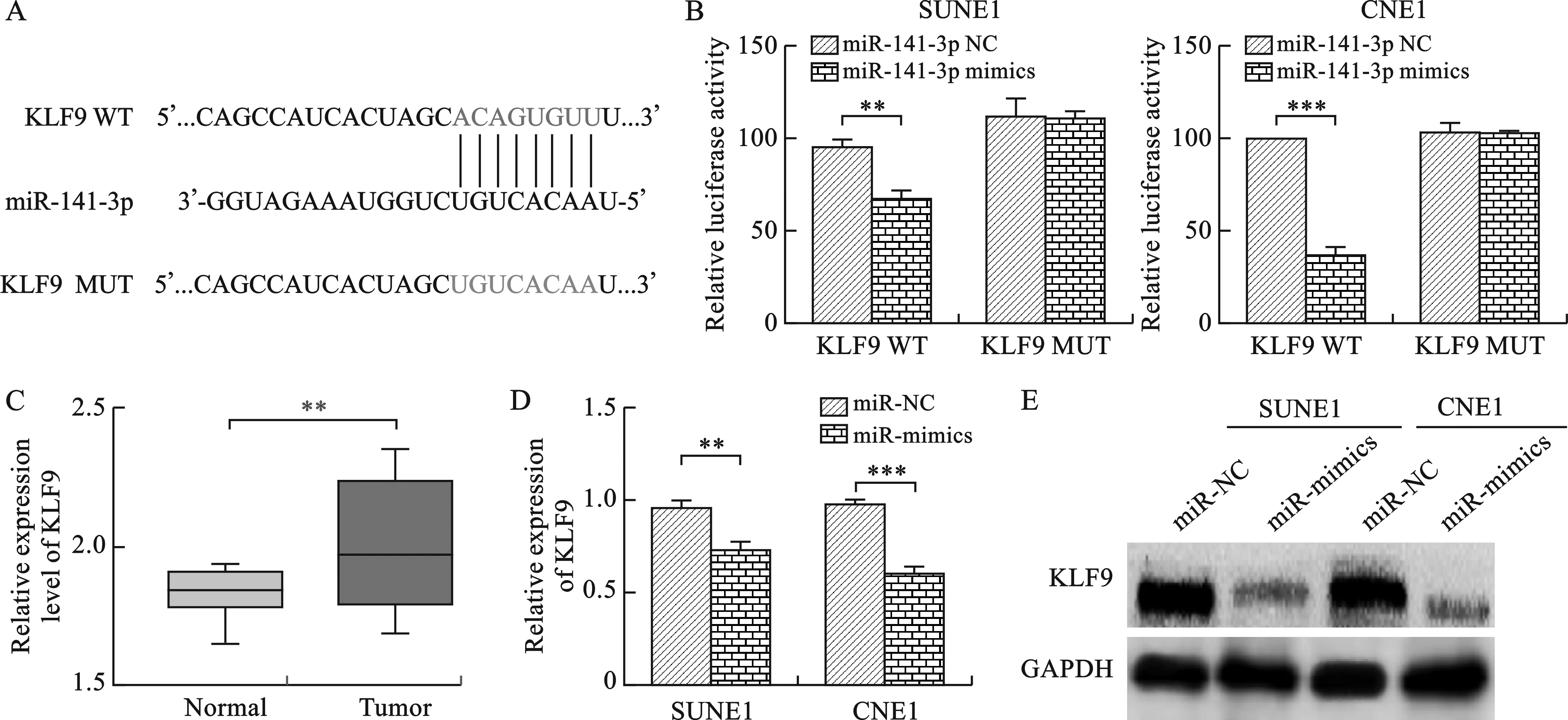
2.4 miR-141-3p靶向抑制KLF9 见图4。我们通过Target Scan预测了miR-141-3p可能结合的结合分数较高的基因,通过功能分析选择了KLF9进行后续研究。双荧光素酶报告基因实验发现,miR-141-3p能够靶向结合KLF9。qRT-PCR检测发现,KLF9在鼻咽癌组织中的表达明显增高。在SUNE1和CNE1转染miR-141-3p NC及miR-141-3p mimics后通过qRT-PCR及Western blot实验检测KLF9的表达情况,结果显示与阴性对照组相比,在鼻咽癌细胞中过表达miR-141-3p能够显著抑制KLF9 mRNA及蛋白的表达。

注:C图中,与阴性对照组相比,**P<0.01,***P<0.001;D图中,与正常组织相比,***P<0.001;F图中,与阴性对照组相比,**P<0.01,***P<0.001
注:B图中,与阴性对照组相比,**P<0.01,***P<0.001;C图中,与正常组织相比,**P<0.001;D图中,与阴性对照组相比,**P<0.01,***P<0.001
3 讨 论
鼻咽癌是我国常见的头颈部恶性肿瘤之一,同步放化疗作为标准治疗手段取得了令人满意的疗效[6-7]。然而,仍然有近30%的患者在经过放化疗后出现局部复发或远处转移而导致治疗失败[8]。因此,探究鼻咽癌侵袭转移机制并寻找鼻咽癌治疗新靶点很有必要。研究[9]发现,多种lncRNA通过促进上皮间质转化、肿瘤新生血管形成等多种机制参与鼻咽癌侵袭与转移,其中lncRNA SNHG家族被发现与鼻咽癌发生与发展关系密切。lncRNA SNHG15是目前SNHG家族研究的热点,被发现与多种肿瘤的恶性增殖及分化相关[10]。但较少有研究探究SNHG15在鼻咽癌中的表达情况及调控机制。本研究发现SNHG15在鼻咽癌中的表达显著增高,同时高表达的SNHG15也预示着鼻咽癌患者的不良预后。在鼻咽癌细胞SUNE1和CNE1中抑制SNHG15后细胞的增殖能力明显减弱,同时细胞凋亡比例显著增高,提示SNHG15可能参与了鼻咽癌细胞的恶性增殖及转移。
lncRNA的亚细胞定位决定着它们可能的生物学效应。我们通过核质分离实验发现SNHG15大多数分布于SUNE1和CNE1细胞的胞质中,显示SNHG15可能在转录后水平发挥调控作用。研究[11]发现,lncRNA常通过竞争性结合并抑制microRNA而影响microRNA下游基因的表达调控而发挥作用。microRNA表达水平失调与多种恶性肿瘤的发生与发展相关[12]。苏建淳等[13]发现,microRNA miR-124与鼻咽癌的增殖、侵袭及预后有显著相关性。本研究中,我们发现鼻咽癌组织中SNHG15的表达与miR-141-3p的表达呈显著负相关关系,而干扰SNHG15后能够显著促进鼻咽癌细胞中miR-141-3p的表达,提示SNHG15能够结合miR-141-3p并抑制其表达,SNHG15可能是通过抑制miR-141-3p而发挥作用的。
为了进一步探究miR-141-3p下游靶点,我们通过TargetScan选择了KLF9进行后续研究。KLF9是一种与分化相关的转录因子,广泛参与神经发育、B细胞分化、增殖、凋亡等过程[14]。研究[15]发现,KLF9是细胞发生氧化应激的关键因子,可能通过上调细胞内的活性氧(ROS)增强细胞氧化应激,促进肿瘤的发生。本研究中发现,miR-141-3p能够靶向结合KLF9,在鼻咽癌细胞中过表达miR-141-3p能抑制KLF9 mRNA及蛋白的表达。这些结果表明SNHG15可能结合并抑制miR-141-3p的表达,从而促进miR-141-3p下游靶点KLF9的表达,参与鼻咽癌细胞的发生与发展。
综上所述,SNHG15在鼻咽癌中异常高表达,可能竞争性结合miR-141-3p并影响其下游靶基因KLF9的表达,从而促进鼻咽癌细胞增殖。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
