血管内皮生长因子多效性及其机制的探讨
2021-01-15胡丽娜
胡 玥,胡丽娜
(桂林医学院,广西 桂林 541199)
血管内皮生长因子(VEGF)的发现改变了我们对血管生成以及生理稳态的认知。在短短的二十年里,我们对VEGF协调血管内环境平衡的分子机制的理解逐渐清晰,VEGF在多种新生血管性疾病的发病机制中的中心作用也已变得非常明显。阐明
VEGF的分子调控以及直接或间接靶向VEGF的多种治疗途径的变革性发展显得愈发重要。本文将重点介绍VEGF生物学的关键节点,包括新生血管性疾病的多靶点治疗方法。
1 VEGF概述
1.1 VEGF家族
VEGF(现称为VEGF-A)家族由多个成员组成:VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F和胎盘生长因子(PlGF)。最近,这个家族又增加了一个新成员,命名为内分泌腺源性血管内皮生长因子(EG-VEGF)。VEGF经历选择性外显子剪接,产生多种亚型,包括VEGF121、VEGF165、VEGF189和VEGF206,其中VEGF165是组织中最常表达的亚型,也是最具生理相关性的亚型。VEGF的几种抑制亚型近年来也被描述,包括VEGF165b和VEGF-Ax,但关于抑制机制存在一些争议,目前已证明VEGF-Ax实际上具有促血管生成和促进通透性特征[1]。
1.2 VEGF受体及受体表达
VEGF受体(VEGFR)主要包括VEGFR-1(Flt-1)、VEGFR-(KDR)和VEGFR-3(Flt-4),均为受体酪氨酸激酶。VEGF与VEGFR-1和VEGFR-2结合,VEGF-B和PlGF与VEGFR-1结合(涉及VEGF诱导的趋化性和炎症反应以及竞争性抑制VEGFR-2的生物学效应),VEGF-C和VEGF-D与VEGFR-3结合(涉及淋巴管生成)。此外,内皮细胞也表达VEGFR共受体,如神经纤维蛋白-1(NRP-1)和神经纤维蛋白-2(NRP-2),它们调节酪氨酸激酶受体的活性,可以增强VEGF和VEGFR的结合以及信号传导[2]。VEGFR-2是主要的信号受体,酪氨酸激酶活性高于VEGFR-1,介导与血管生成和神经保护作用有关的细胞内信号传导。
2 VEGF与心血管系统
2.1 VEGF促进血管新生的正调节作用
VEGF是一种具有重要促血管生成活性的生长因子,通过维护血管内皮细胞形态,调节血管内皮张力,维持血管正常功能,积极参与调节正常和病理性血管生成过程,在心血管疾病中起重要作用。《中国心血管病报告2018》指出,我国心血管疾病(CVD)死亡率占居民疾病死亡构成的40%以上。在动脉粥样硬化中,VEGF通过增加抗凋亡蛋白的表达水平和NO的合成来保护血管内皮细胞。有研究表明,冠心病患者血清和血浆中VEGF水平升高,且与IL-18浓度相关[3]。这种增加说明当冠状动脉损伤严重时,VEGF可被视为血运重建的标志物。因此,治疗性血管生成可以改善冠心病患者的心肌缺血再灌注。一项在大鼠模型上进行的实验显示,血清VEGF水平与梗死区微血管密度增加呈正相关,表明VEGF在心肌重塑和血管生成中起作用[4]。我们先前的研究揭示了组织蛋白酶K(CatK)在缺血诱导的新生血管形成中起作用, CatK缺乏可降低缺血肌肉VEGF、Flt-1和磷酸化Akt蛋白的水平[5]。我们还观察到慢性应激降低了腹股沟脂肪组织中胰岛素受体底物1和葡萄糖转运蛋白4基因的表达,与对照组小鼠相比,应激小鼠缺血肌肉中p-AMPKa、VEGF、PPAR-c和PGC-1a蛋白水平较低,提示在新生血管形成过程中,脂肪1/AMPKa信号和PPAR-c/PGC-1a轴的慢性应激相关失活。此外,心肌梗死后血浆中也检测到VEGF水平的改变,并且与高炎症细胞因子浓度相关,这表明VEGF水平的增加是持续炎症活动的一部分。
2.2 VEGF对血管新生的负调节作用
越来越多的证据表明,VEGF和VEGFR剪接在各种病理条件下都能产生抗血管生成作用[6]。可溶性VEGFR1(sFlt1)也被称为VEGF拮抗剂,可引起内皮功能障碍、抑制血管生成、减少毛细血管修复和增加蛋白尿。此外,非典型Wnt-sFlt1信号通路已被证明是对髓细胞血管生成的负调节通路[7]。
VEGF165b具有抗血管生成和抑制癌细胞发生发展的作用,而wnt5a能够上调VEGF165b的表达,在这种条件下,加强了抑制血管再生恢复的作用。VEGF165b可能代表了一种新的药理学靶点来治疗外周动脉疾病患者的肢体缺血。相应的,肥胖状态下的系统代谢功能失调,肌肉组织中的wnt5a浸润增加,缺血再灌注、毛细血管再生功能会受到抑制。同时,代谢功能障碍导致了促血管增生的VEGF表达减少,抑制其促进毛细血管内皮再生作用。2014年的一项血管生物学研究也表明,Wnt5/SC35的激活可导致人和动物外周动脉疾病血管化受损。
2017年,我们的实验研究了与衰老相关的 sFlt1 变化及其对缺血诱导新生血管的影响[8]。衰老已经被证明会削弱哺乳动物身体在缺血性病理条件下形成新血管的能力, 导致新生血管生长减慢,组织再生能力降低。在缺血性压力时,老化会引起过度的炎症反应,低氧诱导下,激活的老年巨噬细胞中Wnt5a/SC35轴可促进sFlt1释放,抑制VEGFR-2/AKt信号通路,影响新生血管生成。与衰老相关的新生血管损伤的机制可能是血管内皮细胞(ECs)功能的下降和内皮祖细胞(EPCs)数量的减少。详见图1。
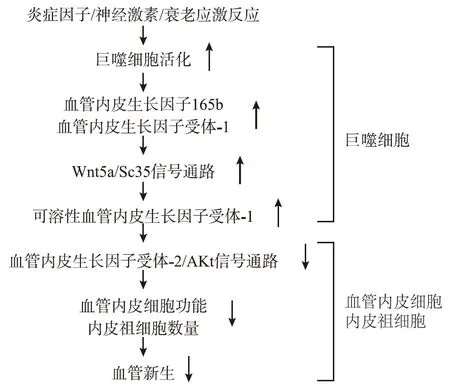
图1 VEGF对血管新生负调节作用的细胞及分子机制
3 VEGF与神经系统
过去二十年的研究已经确定了VEGF在脑功能和病理学中的多重作用。VEGF通过对神经细胞的直接作用和对脑灌注的间接作用来促进应激环境(如缺血、缺氧、氧化应激等)条件下神经细胞的存活,进而起到神经保护作用[9]。此外,VEGF还可通过增加血管的灌注促进血管内皮细胞存活,刺激内皮细胞分泌神经源性生长因子以及维持血-脑屏障的完整性等来发挥神经保护作用[10]。但在某些应激情况下,病理性升高的VEGF水平会增加血管的通透性和渗漏,破坏血-脑屏障的完整性,影响神经系统的稳态[11]。有研究表明,VEGF165通过与VEGFR-2以及NRP-1共受体结合诱导血管通透性增高和血管渗漏,造成相关组织水肿[12]。VEGF还可通过刺激神经干细胞的增生和分化以及影响其血管微环境来诱导神经再生[13]。脑出血损伤后的血管生成可以有效减轻脑损伤并改善神经功能,HIF-2α是重要的血管生成调节剂,在多种神经系统疾病中显示保护作用。2020年最新发表的一项研究探讨了HIF-2α是否通过促进血管生成而减轻脑出血损伤,结果表明,HIF-2α可以通过VEGF / Notch1途径促进血管生成,从而减轻ICH损伤[14]。COVID-19大流行对全球公共卫生构成了巨大威胁,越来越多的证据表明COVID-19患者发生神经系统症状。最新的一项研究表明,细胞因子导致脑部炎症,并随后在COVID-19爆发期间触发神经系统。在大脑中广泛分布的VEGF可能通过促进炎症细胞的募集和调节血管生成素Ⅱ的水平在脑部炎症中起关键作用。因此,VEGF被认为是抑制COVID-19感染伴有神经系统症状期间炎症的治疗靶标[15]。
4 VEGF与肿瘤免疫
VEGF mRNA在大多数人类肿瘤中过度表达,与肿瘤细胞的增殖、侵袭、转移、复发和预后相关。VEGF可直接作用于多种参与免疫的细胞,如树突状细胞、T细胞[16],肿瘤微环境中高水平的VEGF可进一步刺激髓源性抑制细胞和调节性T细胞的增殖,这两种细胞都表达VEGFR[17]。VEGF与VEGFR-2在淋巴管中结合,促进肿瘤组织新淋巴管的形成,增加癌细胞淋巴转移的可能性。因此,阻断VEGF和VEGFR可以抑制肿瘤组织新生血管的形成,对有效抑制肿瘤的发展和抗血管治疗起到靶向作用。1997年,为创造一种适合临床试验的抗体,小鼠抗人单克隆抗体被人源化,由此产生的重组抗体即今天所知的贝伐单抗,于2004年被美国食品药品管理局批准用于先前未经治疗的转移性结直肠癌,随后被扩展到其他恶性肿瘤的治疗中,如肾细胞癌、卵巢癌和宫颈癌。贝伐单抗的批准为其他VEGF途径抑制剂的开发铺平了道路,包括小分子VEGF受体酪氨酸激酶抑制剂(TKIs)、靶向VEGFR2的抗体(主要信号VEGF受体)和嵌合可溶性VEGF受体[18]。近年来,免疫检查点抑制剂与TKIs的结合已成为未接受治疗的晚期肾细胞癌患者的新治疗标准[19]。近期的临床研究也进一步支持了VEGF在抗癌免疫中的作用[20]。此外,单克隆抗体和纳米抗体是治疗癌症的有效药物之一,由于成本高昂,研究人员近年来正在考虑设计和生产肽作为替代方法。最近,有实验室设计了一种针对VEGF的模拟表位,并评估了其对HUVEC细胞系中细胞增殖和管形成的影响。结果表明,该肽能够通过抑制VEGF来抑制HUVEC细胞增殖和管形成[21]。
5 VEGF与骨组织
骨组织是一个高度血管化的器官,骨组织的生长发育和骨折后的愈合与血管形成密切相关,调节骨骼中的VEGF水平是治疗受损骨修复和改善骨再生的潜在策略。成骨细胞中VEGF水平降低的小鼠在出生后表现为骨质疏松症。据报道,包括间充质祖细胞在内的骨系细胞中的VEGF水平随着年龄增长或在某些合成代谢紊乱中降低,这种降低可能与骨折风险增加或对骨再生过程无效有关。因此,提高成骨细胞中VEGF水平的方法可能对老年性骨质疏松症或骨愈合不良有积极作用。由于成骨细胞在代谢上高度活跃,已知能上调成骨细胞中VEGF水平的药物(如他汀类药物)[22],可能对研究此类疾病具有一定价值。
综上所述,VEGF作为特异性最强的促血管生成因子,在对心血管疾病、神经系统疾病、肿瘤疾病等各种疾病中血管及淋巴管生成和生长中起到重要调节作用。在这篇综述中,我们整理了有关VEGF家族及其受体的最新资料,以及它在血管新生过程中发挥的作用及其机制。我们认为,通过适当设计和进行临床试验,治疗性血管生成可以提高相关患者生活质量。此外,VEGF还有一些常见的副作用,例如VEGF通过激活蛋白激酶Akt促进内皮细胞存活和血管生成,其又激活内皮NO合成酶并增加NO产生,引起短暂性低血压[23]。因此,靶向VEGF的抗血管生成治疗,其安全性还需要未来做进一步研究。
