NLRP1及NLRP3在溃疡性结肠炎患者结肠组织中的表达及其临床意义
2021-01-14宋亚华赵菊辉陈芬荣史海涛
李 潇,刘 欣,宋亚华,赵菊辉,陈芬荣,赵 刚,王 燕,李 晗,史海涛
(西安交通大学第二附属医院消化内科,陕西省胃肠动力疾病研究重点实验室,陕西省胃肠疾病临床研究中心,陕西西安 710004)
溃疡性结肠炎(ulcerative colitis, UC)是发生在直肠与结肠的可能与自身免疫有关的炎症性肠病(inflammatory bowel disease, IBD),其病因及发病机制尚不十分明确。目前的研究表明其与免疫失调、肠道菌群及环境因素等有关[1]。临床表现为腹痛、腹泻及黏液脓血便,其慢性进展、易复发,且发病率逐年上升,目前尚无根治方法[2]。因此,提供新的IBD的诊疗防治策略显得尤为重要。
炎性小体是一种蛋白质复合物,其功能主要是识别不同的损伤信号。NLRPs是炎症小体的关键组成部分[3]。NLRP蛋白家族包括NLRP1、NLRP3、NLRP6、NLRP10等。目前研究最多的是NLRP3炎性小体,由NLRP3、凋亡相关斑点样蛋白(ASC)及caspase-1组成,其在炎症、纤维化、肿瘤等发生发展中具有重要作用[4-5],可作为炎症反应的调节中枢。NLRP3炎性小体的激活因素包括低密度脂蛋白、高血糖、胆固醇结晶、尿酸、游离脂肪酸等,其激活后可促进IL-1β、IL-18等炎性因子的成熟和分泌,引起炎症级联反应及组织损伤[6-9]。NLRP1炎性小体与NLRP3炎性小体作用类似,其活化后可促进IL-1β、IL-18、IL-33等炎症因子的成熟和释放。研究表明,NLRP1基因中rs2175827、rs11656977和rs12150220基因与IBD的发病密切相关[10]。但未见有关NLRP1在IBD尤其是UC中的研究报道。有关NLRP3在IBD中的研究结果尚不一致。有研究显示,患有急性或慢性结肠炎小鼠的结肠组织中存在NLRP3的高表达。BAUER等[11]研究发现,用葡聚糖硫酸钠(DSS)造模诱导正常小鼠与NLRP3缺失小鼠结肠炎,观察发现NLRP3缺失小鼠的肠道损伤较正常小鼠严重程度明显下降,提示NLRP3可能作为炎症反应指标或促炎症发生介质存在;但ALLEN[12]的实验证实,NLRP3的缺失可使DSS诱导的结肠炎的肠黏膜损伤加重,又提示NLPR3可作为一个保护性因子存在。本实验旨在明确UC患者结肠组织中NLRP1、NLRP3的表达情况,分析其表达与UC病情严重程度、内镜评分及实验室指标的相关性,为UC病情严重程度、疗效的评判以及探索新的治疗靶标提供实验依据。
1 资料与方法
1.1 研究对象收集西安交通大学第二附属医院2018年6月-2019年4月进行结肠镜检查的UC患者46例。UC入组标准:①经过知情同意;②参照《炎症性肠病诊断与治疗的共识意见(2018年,北京)》,经临床、影像、内镜、实验室检查及病理组织学检查等诊断手段,符合UC。排除标准:①有严重并发症,如肠梗阻、局部狭窄、肠穿孔、中毒性巨结肠等;②有癌变可能者;③合并有神经、循环、呼吸、内分泌、血液系统等严重的原发性疾病者;④合并有系统性红斑狼疮、硬皮病、类风湿性关节炎等自身免疫性疾病者;⑤哺乳或妊娠期妇女;⑥严重认知障碍、精神病和终末期患者;⑦病情危重无法耐受活检检查者。
采用改良Mayo评分系统对UC活动度进行判定,即轻度活动(≤5分)及中重度活动(≥6分),本组UC组患者轻度22例,男14例,女8例,平均年龄(43.1±3.3)岁;中重度24例,男11例,女13例,平均年龄(46.3±2.8)岁。同时选取20例健康对照者作为对照组,其中男10例,女10例,平均年龄(49.7±3.3)岁,各组在性别及年龄上无统计学差异。所有UC患者在服用聚乙二醇电解质散行肠道清洁准备并签署知情同意。Mayo评分系统Mayo内镜评分参考《炎症性肠病诊断与治疗共识(2018年,北京)》。UC肠镜下病变范围亦参考《炎症性肠病诊断与治疗共识(2018年,北京)》,采用蒙特利尔分型,分为直肠组(11例)、左半结肠组(23例)及全结肠组(12例)。
1.2 主要试剂及器材兔抗人NLRP3-DF7438多克隆抗体购自Affinity抗体公司,兔抗人NLRP1多克隆抗体购自Proteintech公司,伊红染色液、苏木精染色液购自碧云天生物技术公司,SP试剂盒、DAB显色试剂盒购自北京中杉金桥生物技术有限公司,RNAfast1000试剂盒购自陕西先锋生物公司,K1622逆转录试剂盒购自Ferments Themo,Real-time PCR Master Mix试剂购自陕西先锋生物公司。采用Beacondesigner 4.0软件进行引物设计,引物合成由北京奥科生物科技有限公司进行。实时定量PCR仪(型号TL988)购自Tianglong(天隆生物,中国)。
1.3 免疫组化法检测NLRP1及NLRP3表达UC组和正常对照组的结肠黏膜组织标本经40 g/L的多聚甲醛固定后,脱水、透明、石蜡包埋连续切片,HE染色证实组织结构及病变程度。严格按操作说明进行免疫组化染色:常规脱蜡至水,置于0.1 mol/L枸橼酸钠缓冲液中,微波加热进行抗原修复,自然冷却后PBS(pH 7.4)洗涤5 min×3次。30 mL/L H2O2避光孵育20 min灭活内源性酶,PBS洗涤5 min×3次。NLRP3(1∶100)及NLRP1(1∶100)一抗工作液4 ℃过夜,自然复温后PBS洗涤5 min×3次。滴加二抗室温孵育40 min,PBS洗涤5 min×3次。DAB室温显色、苏木素轻度复染,盐酸乙醇分化,逐级脱水、透明、中性树胶封片。以PBS代替一抗作为阴性对照。采用Image-pro plus 6.0图像分析软件,分析测定积分吸光度(integrated optical density, IA)值,以其平均值代表蛋白表达水平。
1.4 Real-time PCR检测NLRP1及NLRP3 mRNA表达按照RNAfast 1000试剂盒、K1622试剂盒操作说明书提取组织mRNA及合成cDNA,PCR反应按照Real-time PCR Master Mix试剂说明书,NLRP1上游5′-TCTGAGTGATGAGATGAG-3′,下游5′-GTGAGGATGTGCTATTAC-3′;NLRP3上游5′-CTCGGTGACTTCGGAATC-3′,下游5′-ATGGC-TGGTGCTCAATAC-3′;β-actin上游5′-ATCGTGCGTGACATTAAGGAGAAG-3′,下游5′-AGGA-AGGAAGGCTGGAAGAGTG-3′。反应总体积为20 μL:SYBR®Green Real-time PCR Master Mix 10 μL,上游、下游引物(10 μmol/L)各0.5 μL,模板(cDNA)1 μL,双蒸水8 μL。以β-Action为内参。计算2-ΔΔCT获得目的基因的相对表达量,其中CT(cycle threshold)表示循环阈值。
1.5 实验室指标采用血液细胞分析仪、生化分析仪检测血小板、血尿酸、低密度脂蛋白胆固醇、胆固醇、C-反应蛋白、血沉水平。
1.6 统计学分析应用SPSS 18.0统计软件进行数据分析。计量资料结果以均数±标准差表示,多组间比较采用方差分析,两组间比较采用LSD;当数据不服从正态分布时,配对两组间的比较采用Wilcoxon秩检验,多组间的比较采用Kruskal—wal1is H秩和检验。计数资料间比较采用卡方检验,两组计量资料间的相关性分析根据是否符合正态分布选用Person或Spearman相关分析的一种。P<0.05为差异有统计学意义。
2 结 果
2.1 正常对照组及UC组结肠黏膜组织的HE染色显微镜下见对照组结肠黏膜完整,腺体排列规则,结构清晰,上皮细胞连续,未见大量淋巴细胞、浆细胞等炎症细胞的浸润。UC组结肠黏膜可见上皮破坏,腺体破坏,固有层可见大量的淋巴细胞及浆细胞浸润,部分可见隐窝脓肿、隐窝破坏及分支状隐窝,黏膜层及黏膜下层出现血管扩张(图1)。

图1 正常对照组及UC组结肠黏膜组织的HE染色
2.2 NLRP1和NLRP3的表达情况免疫组化结果显示,NLRP1和NLRP3在UC组和对照组结肠黏膜组织中均有表达(图2),主要表达在胞质和胞膜,呈弥漫性分布。与正常对照组相比,轻度UC及中重度UC患者的NLRP1及NLRP3均升高,差异有统计学意义(P<0.05);与轻度UC相比,中重度UC患者的结肠黏膜组织中NLRP1明显升高(P<0.05),而NLPR3无统计学差异(表1)。

图2 免疫组化法检测正常对照组及UC组结肠黏膜组织NLRP1、NLRP3表达
表1 正常对照组及UC组结肠黏膜组织中NLRP1与NLRP3蛋白表达的比较Tab.1 Protein expression levels of NLRP1 and NLRP3 in colonic mucosal tissues of normal control group and UC group
肠镜下不同病变范围(直肠、左半结肠、全结肠)的UC患者的结肠黏膜组织中NLRP1及NLRP3表达无明显差异(表2)。Real-time PCR结果与免疫组化结果一致,与正常对照组相比,轻度UC及中重度UC患者的结肠黏膜组织中NLRP1 mRNA及NLRP3 mRNA均升高,差异有统计学意义(P<0.05);与轻度UC相比,中重度UC患者的结肠黏膜组织中NLRP1 mRNA明显升高(P<0.05),而NLPR3 mRNA无统计学差异(图3)。
表2 不同病变范围下结肠黏膜组织中NLRP1与NLRP3的蛋白表达的比较Tab.2 Protein expressions of NLRP1 and NLRP3 in different colonic lesion ranges

图3 UC患者结肠黏膜组织中NLRP1与NLRP3 mRNA表达的比较
2.3 NLRP1和NLRP3的表达与病情严重程度的相关性分析与轻度UC组相比,中重度UC组Mayo总体评分、肠镜评分、血沉、C反应蛋白水平均明显增加(P<0.05,表3)。UC患者结肠黏膜组织中NLRP1的表达与Mayo总体评分、内镜评分、血沉、C反应蛋白水平呈正相关(P<0.05);而NLRP3的表达与C反应蛋白水平呈正相关(P<0.05),但与Mayo总体评分、Mayo内镜评分、血沉变化无相关性(P>0.05,表4)。
2.4 NLRP1和NLRP3的表达与激活因素的相关性分析与轻度UC组相比,中重度UC组血小板明显增加(P<0.05),而血尿酸、胆固醇、低密度脂蛋白胆固醇差异无统计学意义(P>0.05,表5)。UC患者结肠黏膜组织中NLRP1的表达与低密度脂蛋白、胆固醇、血小板呈正相关(P<0.05),与血尿酸、胆固醇不呈相关性(P>0.05);UC患者结肠黏膜组织中NLRP3的表达与血尿酸、胆固醇、低密度脂蛋白胆固醇均呈正相关(P<0.05),与血小板不具有相关性(P>0.05,表6)。
表3 不同程度UC患者临床指标的比较Tab.3 Comparison of clinical indicators of UC patients
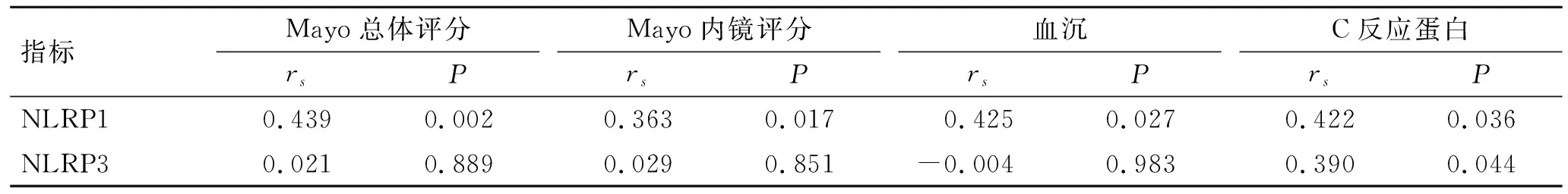
表4 UC患者结肠黏膜组织中NLRP1、NLRP3表达与Mayo总体评分、内镜评分、血沉、C反应蛋白的相关性Tab.4 Correlation of NLRP1 and NLRP3 expressions with Mayo overall score, endoscopic score, erythrocyte sedimentation rate, and C-reactive protein in colonic mucosal tissues of UC patients
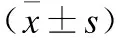
表5 不同程度UC患者临床生化指标的比较Tab.5 Comparison of clinical indicators of UC patients

表6 UC患者结肠黏膜组织中NLRP1、NLRP3表达与临床生化指标的相关性Tab.6 Correlation of NLRP1 and NLRP3 expressions with uric acid, cholesterol, low-density lipoprotein and platelet in colonic mucosal tissues of UC patients
3 讨 论
炎症小体可诱导caspase-1的自我剪切,caspase-1能够调控IL-1β、IL-18的产生,调控机体的自身免疫应答反应。NLRP3炎症小体是目前研究最多的炎症小体,主要存在于中性粒细胞、树突状细胞和巨噬细胞[11,13],由NLRP3、ASC和caspase-1结合而成。研究发现,NLRP3对IBD的调控具有双向调节作用[14]。敲除小鼠NLRP3基因后,给予其口服30 g/L DSS和2,4,6-三硝基苯磺酸(TNBS)后出现肠上皮完整性破坏、死亡率增加。该研究还发现,NLRP3炎症小体可通过增加IL-18分泌,以抑制由DSS所诱导的结肠炎的发生。以上研究均提示NLRP3炎症小体对实验性结肠炎有保护作用。但同时也有相反的实验结果,NLRP3基因敲除小鼠对口服20 g/L DSS所诱导的结肠炎的发生率明显下降,DSS可致溶酶体破坏,并可通过向胞质释放其内容物而激活NLRP3炎症小体,致caspase-1活化和IL-1β释放,从而促进炎性反应发生。还有研究显示,使用NLRP3依赖的pro-caspase-1、IL-1β和IL-18的抑制剂治疗,能够减轻小鼠急性结肠炎。此外,还发现NLRP3炎症小体对TNF-α、TGF-β、肠道菌群等均有影响[1],而这些因素的变化均可影响结肠炎的发生发展。由此可见,NLRP3参与结肠炎的机制十分复杂,但具体的作用机制及如何利用其指导临床实践仍需进一步研究。NLRP1广泛存在于T细胞、B细胞、单核细胞、巨噬细胞等细胞中。NLRP1炎性小体的过度激活是肠炎的一个重要原因[10],但其在IBD中的具体作用尚不清楚。
本研究发现,NLRP1与NLRP3在UC患者结肠组织中的表达明显高于正常对照组,且随着疾病活动度的增加,表达增加,提示其可能在UC发病中发挥作用,也可能作为病情严重程度的评价指标。相关性分析表明,NLRP1与Mayo总体评分、Mayo内镜评分均具有相关性,评分越高,NLRP1表达越高,而NLRP3与Mayo总体评分、Mayo内镜评分无相关性,提示NLRP1可能还可作为病情严重程度及组织炎症程度判断的指标,有望用来评估黏膜愈合。血沉、C反应蛋白是临床中常用的反映UC炎症活动及严重程度的指标,本研究也证实中重度UC组血沉、C反应蛋白均较轻度UC明显增加,且与Mayo总体评分、Mayo内镜评分均具有明显相关性。进一步分析,NLRP1与血沉及C反应蛋白均具有相关性,NLRP3与C反应蛋白具有相关性,而与血沉不具有相关性。提示在反映UC严重程度及炎症活动度中,NLRP1及NLRP3与血沉、C反应蛋白具有一致性。
在炎症疾病中,NLRP1的激活因素有很多,其中包括胞壁酰二肽、寄生虫以及炭疽芽孢杆菌的致死毒素等。NLRP3的激活因素既有细菌、病毒、真菌等微生物及其产物,也可以是ATP、胆固醇、尿酸单钠等分子[1]。激活机制主要有胞内钾离子外流、微生物毒素、活性氧、结晶或微粒物质等激活剂等[8]。研究表明,尿酸可以激活NLRP3引起炎症,且尿酸和UC具有相关性;胆固醇、低密度脂蛋白可以激活NLRP3引起炎症,低密度脂蛋白也可以激活NLRP1引起炎症;此外,有文献报道,在UC的发病进展中,血小板明显活化,与钾通道及NLRP3炎症小体活化有关[14-15]。本研究提示NLRP1与低密度脂蛋白、血小板具有相关性(P<0.05),NLRP3与尿酸、胆固醇、低密度脂蛋白胆固醇均具有相关性,提示在UC发病中,NLRP1的激活可能与血小板活化、低密度脂蛋白胆固醇有关,而NLRP3的激活可能与尿酸、胆固醇、低密度脂蛋白胆固醇有关。
综上所述,本研究发现,NLRP1及NLRP3在UC患者结肠黏膜组织中的表达明显升高,且与Mayo总体评分、内镜评分、血沉及C反应蛋白均具有相关性,NLRP1的激活可能与血小板活化、低密度脂蛋白胆固醇有关,NLRP3的激活可能与血尿酸、胆固醇、低密度脂蛋白有关。以上结果提示,NLRP1及NLRP3在UC发病中可能具有重要作用,同时可能作为评价疾病严重程度、判断疾病恢复的重要指标。但其在发病中具体的作用机制以及是否可作为黏膜愈合甚至组织愈合的指标,仍需扩大样本量及后续进一步研究。
