基于单苯环荧光团的荧光变色墨水
2021-01-12毛海香丁彬彬郭敏杰李盛华
毛海香, 王 飚, 丁彬彬, 郭敏杰, 樊 志, 李盛华*, 崔 晶
(1. 天津科技大学 化工与材料学院, 天津 300457; 2. 中国石化上海石油化工研究院, 上海 201208)
1 引 言
有机固体发光材料在发光器件[1-5]、有机固体激光器[6-8]、生物、化学与力学传感器[9-12]、数据记录与储存[13-14]、保密与防伪[14-16]等方面有着广泛的应用价值。然而,传统有机染料多为共轭大π结构,容易发生H-聚集造成发光猝灭,导致材料在固态下的量子产率较低[17]。为了提高有机材料在固态下的发光效率,化学家们采用各种方法来减少分子的H-聚集,如在发色团上引入大位阻基团以减少π-π堆积[18]、形成错位堆积(J-聚集)[19]或者交叉堆积(X-聚集)[ 20-21]、聚集诱导发光[22-24]和形成超分子包合物[23-29]等。
其中,减少分子的π共轭结构,如采用单芳环体系是减少分子间π-聚集、避免荧光猝灭的有效方法。同时,通过一定的化学修饰,如在苯环上连接推拉电子基团可以增加分子的Stokes位移,使发射波长处于可见光区[30]。Shimizu等在苯环上修饰4个取代基团,其中两个取代基包含碳-碳双键,扩展了共轭体系,这一分子在可见光区实现了非常高效的荧光发射[31]。而Katagiri等设计合成了另一种四取代苯——2,5-双甲砜基-1,4-二氨基苯。该分子在水中具有较强的绿色荧光,与其他绿色荧光染料相比有更高的稳定性[32]。近年来,张红雨教授等发现2,5-二氨基对苯二甲酸酯类晶体可用作红光激光染料,具有放大的自发辐射现象[33-35],其相关衍生物的晶体兼具柔性和发光性能,在柔性光学器件方面有潜在的应用价值[36-37]。
综上,单取代苯环分子均连有氨基给电子基团和拉电子基团,这种推拉电子体系使分子的Stokes位移增大,实现了单苯环分子在可见光区的荧光发射[30]。而当这类分子中的氨基连有拉电子基团时会导致分子荧光发射蓝移[38-39],若这一转变可以在纸张基底上实现原位转化,将会在数据加密和防伪中发挥重要作用[40-42]。因此,我们设计合成了2,5-二氨基-1,4-苯二甲酸丁酯2a及其单酰胺衍生物2b与双酰胺衍生物2c,分别研究了它们在溶液和固态下的发光行为。发现化合物2a、2b和2c均可以在固态下发光,其最大发射波长分别为558,495,467 nm。此时,化合物2a、2b和2c具有较高的量子产率。我们将化合物2a的溶液书写于本色纸上,并通过在原有印记上涂写相应的酰化试剂,在纸张上原位反应生成化合物2b和化合物2c,实现了荧光从黄光到绿光进而到蓝光的转变。
2 实 验
2.1 实验仪器与材料
实验仪器:核磁共振波谱仪(Bruker AVⅢ,德国布鲁克拜厄斯宾有限公司),紫外分光光度计(F-7100,岛津实验器材有限公司),荧光分光光度计(F-4600,日本日立公司),熔点测定仪(PY-1G,天光新光学仪器科技公司),傅里叶红外光谱分析仪(VECTORN22,Bruker公司),液质联用仪(XevoG2-S QTof,美国沃特世公司),稳态瞬态荧光光谱仪(FLS1000,英国爱丁堡仪器公司),绝对量子产率测量仪(C9920-02,日本HAMAMATSU)。实验材料:氢化钠(梯希爱化成工业发展有限公司),丁二酸二丁酯(上海笛柏化学品技术有限公司),磷酸、盐酸(天津市福晨化学试剂厂),乙酸铵(福晨化学试剂有限公司),单质硫(天津市赢达稀贵化学试剂厂),N,N-二异丙基乙胺(DIPEA,天津希恩思生化科技有限公司),氯甲酸-2,2,2-三氯乙酯(TrocCl罗恩试剂)。所用溶剂均为分析纯,实验用水均为二次蒸馏水。
2.2 合成路线及方法
化合物2a、2b和2c的合成路线如图1所示。
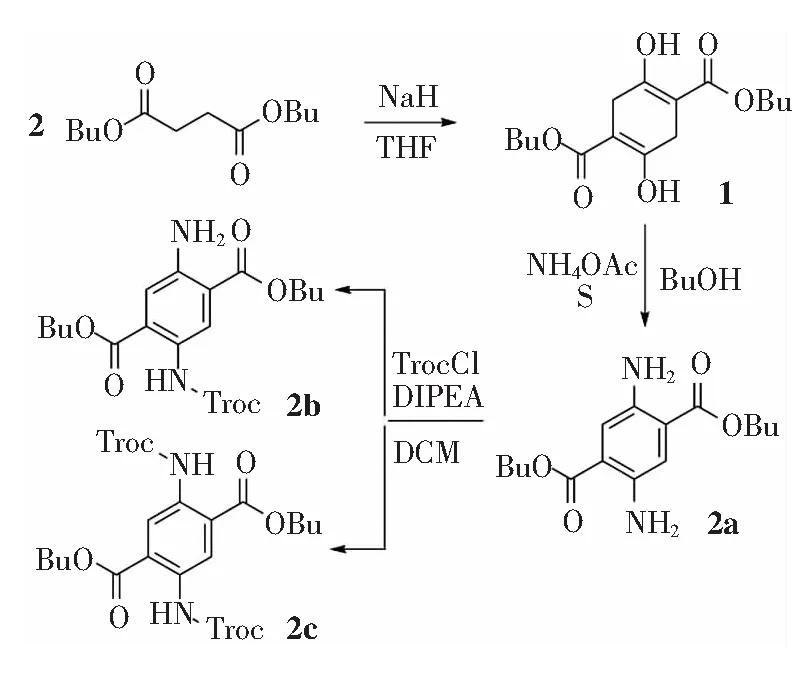
图1 化合物2a、2b和2c的合成路线。
2.2.1琥珀酰琥珀酸二丁酯1的合成
称取氢化钠(2.50 g,63 mmol)于烧瓶中,依次加入四氢呋喃(THF,25 mL)、正丁醇(0.5 mL)、丁二酸二丁酯(5.80 g,25 mmol),回流加热反应10 h后冷却至室温。配制水(20 mL)与磷酸(3 mL)的混合液,在冰水浴下将反应液倒入如上磷酸溶液中,抽滤,得到白色粉末状固体产物,收率89%。m.p. 97~99 ℃,1H-NMR(400 MHz,DCCl3)δ12.21(s,1H,H-1),4.19(t,J=6.6 Hz,2H,H-3),3.18(s,2H,H-2),1.66(dq,J=8.2,6.6 Hz,2H,H-4),1.47~1.35(m,2H,H-5),0.95(t,J=7.4 Hz,3H,H-6)。
2.2.2 2,5-二氨基-1,4-苯二甲酸丁酯2a的合成
将琥珀酰琥珀酸二丁酯1(1.56 g,5 mmol)和乙酸铵(1.93 g,25 mmol)溶于正丁醇(10 mL)中,在110 ℃下搅拌6 h,随后冷却到90 ℃加入单质硫(0.176 g,5.5 mmol),反应过夜后结束冷却后抽滤,所得产物经柱色谱分离得到橙色粉末状固体,收率72%。m.p.124~126 ℃,1H-NMR(400 MHz,DCCl3) (见图2(a))δ7.28(s,1H,H-2),5.07(s,2H,H-1),4.28(t,J=6.6 Hz,2H,H-3),1.74(dq,J=8.6,6.7 Hz,2H,H-4),1.52~1.42(m,2H,H-5),0.98(t,J=7.4 Hz,3H,H-6)。IR(KBr)νmax3 461,3 361,2 957,2 866,1 693,1 598,1 500,1 282,1 205,1 102,942,878,801,736,588,506,442 cm-1。LCMS-ESI,m/z实测值(理论值)[M+H]+:309.181 4(309.180 9)。
2.2.3 单酰胺衍生物2b的合成
将2,5-二氨基-1,4-苯二甲酸丁酯2a(0.308 g,1 mmol)溶于二氯甲烷(20 mL)中,加入DIPEA(0.3 g,2.3 mmol),冰水浴下搅拌。将5 mL TrocCl(0.21 g,1 mmol)的二氯甲烷溶液缓慢滴加到上述溶液中,室温下搅拌0.5 h后,反应液体依次用等量的水、0.1 mol/L的盐酸溶液、饱和碳酸氢钠溶液、饱和氯化钠溶液各洗两次,无水硫酸钠干燥,旋蒸后所得产物经柱色谱分离后得到黄绿色粉末状固体,产率72%。m.p.79~81 ℃,1H-NMR(400 MHz,DCCl3)(见图2(b))δ10.06(s,1H,H-2),8.83(s,1H,H-3),7.36(s,1H,H-9),5.59(s,2H,H-8),4.83(s,2H,H-1),4.37~4.33(m,2H,H-4),4.33~4.28(m,2H,H-10),1.78(qd,J=7.4,3.6 Hz,4H,H-5,H-11),1.47(dtd,J=16.6,7.4,1.9 Hz,4H,H-6,H-12),0.99(td,J=7.4,4.0 Hz,6H,H-7,H-13)。IR(KBr)νmax3 463,3 360,2 962,2 866,1 692,1 587,1 485,1 295,1 098,961,884,794,734,603,493,438 cm-1。LCMS-ESI,m/z实测值(理论值) [M+H]+: 483.085 6
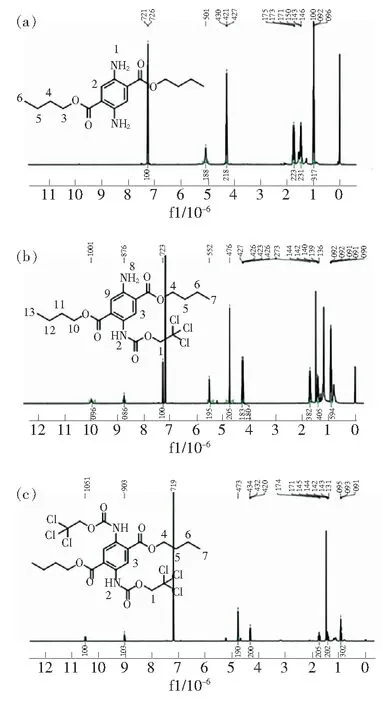
图2 化合物2a(a)、2b(b)和2c(c)的1H核磁共振谱图。
2.2.4 双酰胺衍生物2c的合成
将2,5-二氨基-1,4-苯二甲酸丁酯2a(0.308 g,1 mmol)溶于二氯甲烷(20 mL)中,加入DIPEA(0.30 g,2.3 mmol),冰水浴搅拌。将5 mL TrocCl(0.42 g,2 mmol)的二氯甲烷溶液缓慢滴加到上述溶液中,室温下搅拌0.5 h。反应液体依次用等量的水、0.1 mol/L的盐酸、饱和的碳酸氢钠溶液、饱和的氯化钠溶液各洗两次,无水硫酸钠干燥。旋蒸后所得产物经柱色谱分离得到白色固体粉末,产率88%。m.p.167~169 ℃,1H-NMR(400 MHz,DCCl3) (见图2(c))δ10.56(s,1H, H-2),9.10(s,1H,H-3),4.85(s,2H,H-1),4.39(t,J=6.8 Hz,2H,H-4),1.81(dd,J=8.5,6.3 Hz,2H,H-5),1.54~1.46(m,2H,H-6),1.00(t,J=7.4 Hz,3H,H-7)。IR(KBr)νmax3 463,3 360,2 956,2 869,1 896,1 589,1 487,1 288,1 198,1 096,955,890,801,597,493,436 cm-1。LCMS-ESI,m/z实测值(理论值) [M+H]+:658.987 1(658.986 4)。
2.2.5 溶液配制
配制浓度为4×10-5mol·L-1的2,5-二氨基-1,4-苯二甲酸丁酯2a的二氯甲烷(DCM)、三氯甲烷(Chloroform)、丙酮(Acetone)、乙腈(MeCN)、甲醇(MeOH)、正己烷(n-Hexane)、乙二醇(Glycol)、二甲基亚砜(DMSO)溶液用于测定化合物2a的紫外光谱和荧光光谱;配制浓度为4×10-5mol·L-1的单酰胺衍生物2b和双酰胺衍生物2c的二氯甲烷(DCM)溶液用于测定紫外光谱和荧光光谱;配制浓度为1×10-3mol·L-1化合物2a的丙酮溶液、浓度为2×10-3mol·L-1TrocCl的正己烷溶液、浓度为8×10-3mol·L-1TrocCl的正己烷溶液用于书写。
3 结果与讨论
3.1 2,5-二氨基-1,4-苯二甲酸丁酯2a在不同溶剂中的发光行为
2,5-二氨基-1,4-苯二甲酸丁酯2a的吸收和发射光谱在不同的溶剂中有着明显的区别。如图3(a)、(b)所示,化合物2a的紫外吸收波长总体上随着溶剂的极性增大而增大,如在正己烷中最大吸收波长为438 nm,而在DMSO中最大吸收波长为457 nm。这种正的溶剂效应(最大吸收波长随着溶剂的极性增大而增加)说明分子化合物2a激发态的偶极矩大于基态的偶极矩[43]。
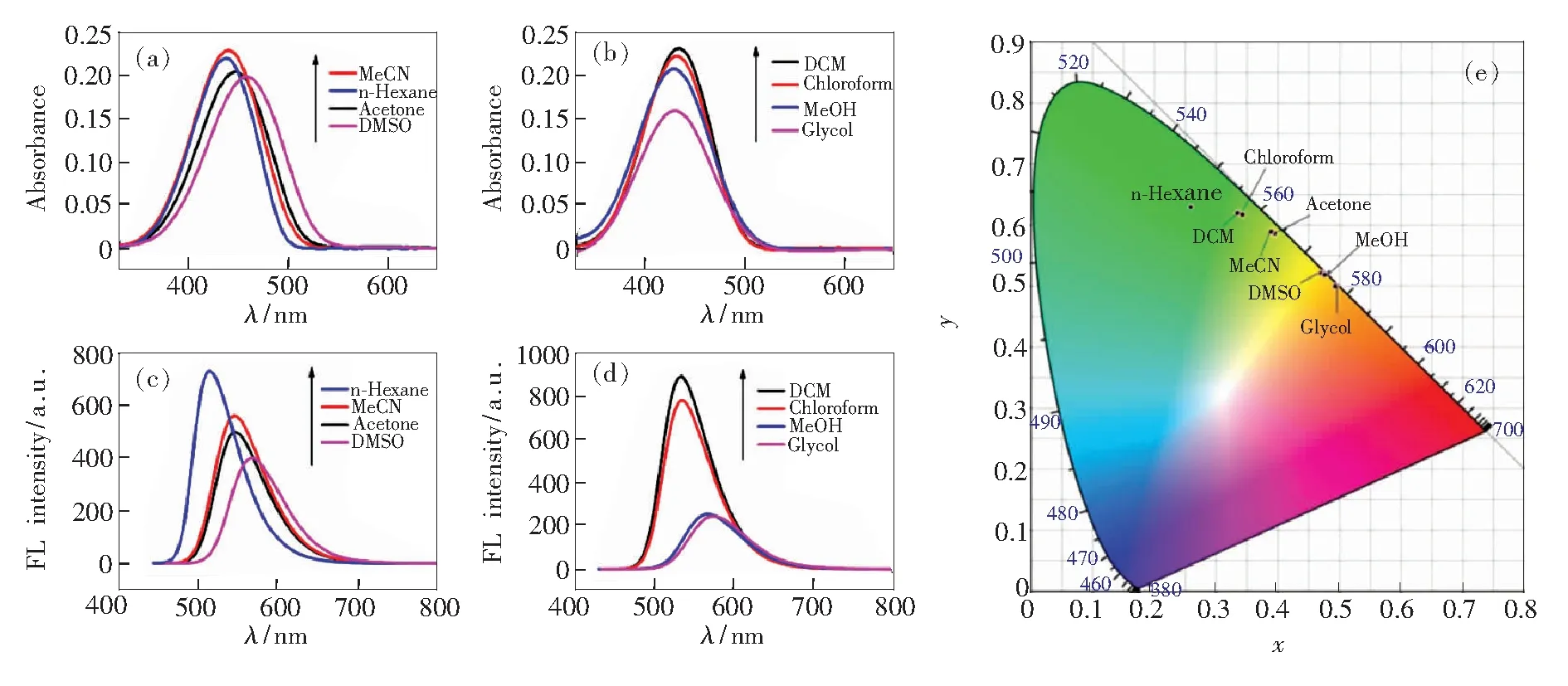
图3 2,5-二氨基-1,4-苯二甲酸丁酯2a(4×10-5 mol·L-1)的紫外光谱((a)~(b))、荧光光谱(激发波长为440 nm)((c)~(d))和CIE色度图(e)。
如图4所示,根据化合物2a电荷离域的不同状态,其分子结构至少有两种共振极限式[33]。其中烯醇亚胺型化合物2a-ⅱ共振式,因其分子内正负电荷分离而具有更大偶极矩,所以这一状态在化合物2a分子的激发态中占有较大贡献。而化合物2a在强极性质子溶剂中的最大吸收波长比正己烷还要小(如表1所示,其在甲醇中的最大吸收波长仅为429 nm),我们猜测溶剂中的活泼氢和化合物2a-ⅱ结构中的烯醇氧负离子有一定的相互作用,导致其最大吸收波长较为反常。综上可见,化合物2a在不同溶剂中的最大吸收波长相差28 nm(从429 nm到457 nm),与2,5-双甲砜基-1,4-二氨基苯(17 nm)[32]和2,5-二氨基对苯二甲酸脂类(8 nm)[33]相比其吸收光谱受溶剂的极性影响较大,这预示其发射光谱也会具有较大差异。
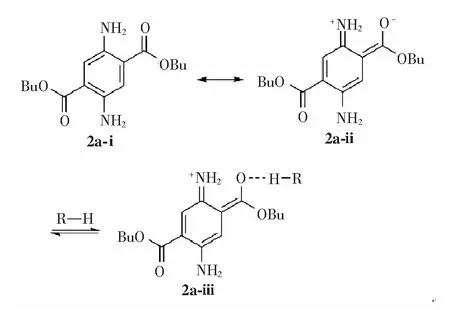
图4 化合物2a的共振模型,并推测其与质子溶剂的相互作用。
图3(c)、(d)为化合物2a在不同溶剂中的荧光光谱。化合物2a在正己烷中为绿色荧光,其最大发射波长为514 nm,Stokes位移为76 nm且荧光强度较大;在DMSO中为橙黄色荧光,其最大发射波长为567 nm,Stokes位移为110 nm且荧光强度有所减小;而在乙二醇中为橙色荧光,其最大发射波长为574 nm,Stokes位移为144 nm且荧光强度进一步变小。这一现象与我们从紫外光谱中所推测的分子机制相一致,即在强极性溶剂和质子性溶剂中,激发态会采取电荷分离的共振结构,这一分子弛豫过程导致了荧光光谱红移,同时激发态的溶剂化作用致使其荧光强度进一步降低。
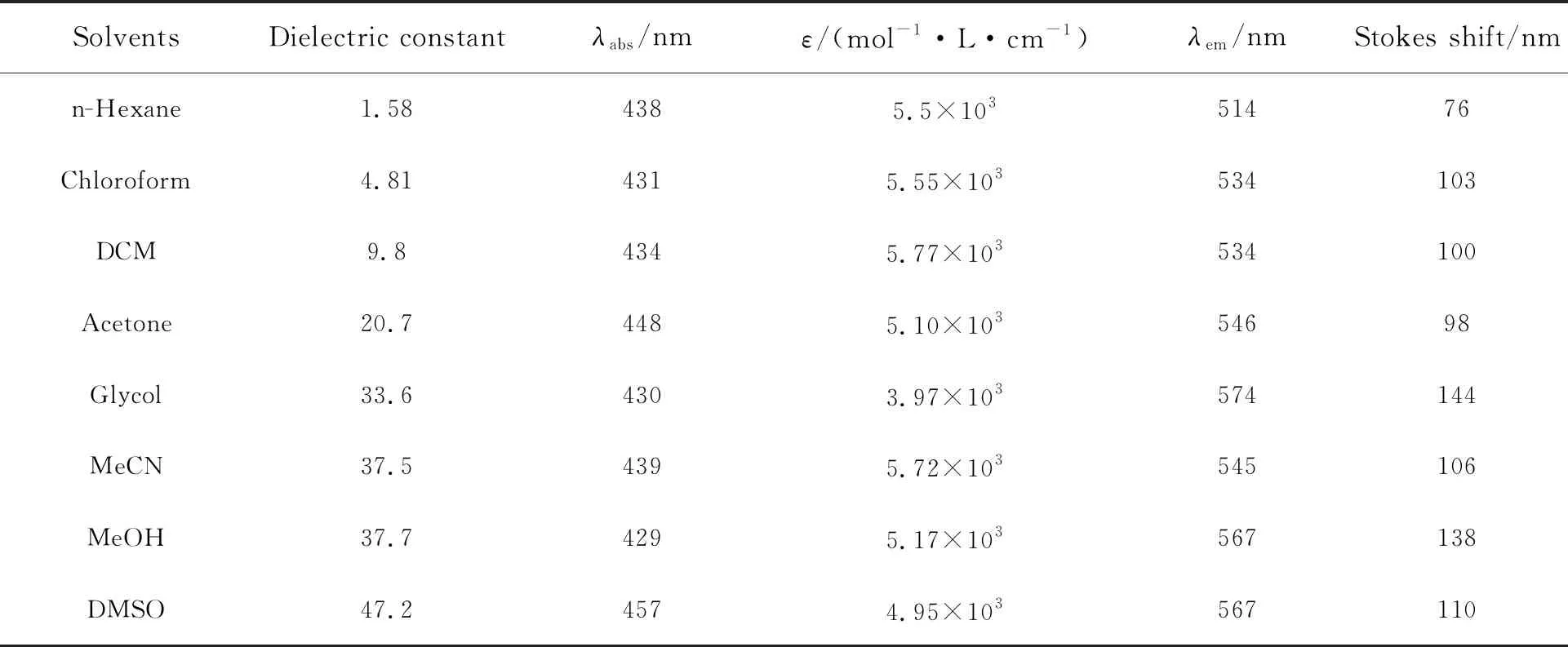
表1 2,5-二氨基-1,4-苯二甲酸丁酯2a在不同溶剂中的光谱数据
综上,如表1所示,化合物2a的荧光发光行为受溶剂影响较大,其最大发射波长变化了60 nm,即从正己烷中的514 nm 到乙二醇中的574 nm;其在不同溶剂中均具有较大Stokes位移,即从正己烷中的76 nm 到乙二醇中的144 nm。CIE图(图3(e))中显示其发光具有较大的变色范围,覆盖了绿色、黄绿、橙黄等多种颜色。尝试将不同溶剂的化合物2a涂写于本色纸上,但当溶剂挥发后在365 nm紫外灯下只能激发出黄色荧光。因此,获取2,5-二氨基-1,4-苯二甲酸丁酯的荧光变色行为要考虑其他途径。
3.2 2,5-二氨基-1,4-苯二甲酸丁酯2a及其单酰胺衍生物2b和双酰胺衍生物2c在溶剂及固态的发光行为
考虑化合物2a分子中有两个氨基为给电子基团,若将其衍生化为酰胺,即改变其官能团为拉电子基团,可以在很大程度上改变分子的发光行为,并且其单衍生化和双衍生化产物也应具有不同的发光行为。经过系列尝试,综合考虑了随后其在纸张上的变色行为,最终选用氯甲酸——2,2,2-三氯乙酯(TrocCl)并取得了较好的结果。
如图1所示,采用不同化学计量的TrocCl与化合物2a反应得到了单酰胺化合物2b和双酰胺产物2c。如图5(a)、(b)所示,我们首先研究了它们在溶液下的光谱行为,在二氯甲烷溶液中,它们的紫外最大吸收波长依次为434,400,367 nm,显示出较大蓝移的现象;而其荧光最大发射波长依次为534,473,434 nm,同样显示出蓝移的现象,并且荧光强度呈现增强的趋势。这种明显的颜色差异鼓舞我们继续研究其固态发光行为。如图6(b)所示,化合物2a、2b和2c分别为橙色、黄色和白色粉末状固体,对应在紫外光照射下可以发射出较为强烈的黄色、绿色和蓝色荧光,其最大发射波长分别为558 nm(CIE坐标:0.377,0.475)、495 nm(CIE坐标:0.189,0.432)和467 nm(CIE坐标:0.155,0.177) (如表2和图6(c)所示)。
随后测定了它们在固态下的荧光量子产率(Ф)和荧光寿命(τ)。如表2所示,化合物2a的τ=9.09 ns,Ф=0.28,比2,5-双甲砜基-1,4-二氨基苯(Ф=0.69)[32]和2,5-二氨基对苯二甲酸脂类(Ф=0.40)[33]的量子产率要低;单酰胺2b的τ=6.79 ns,Ф=0.13,其量子产率与化合物2a相比有所降低;而双酰胺2c的τ=17.21 ns,量子产率则大大增加,为0.79。
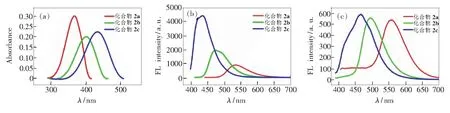
图5 化合物2a、2b、2c在CH2Cl2(4×10-5 mol·L-1)中的紫外光谱(a)与荧光光谱(b);(c)化合物2a、2b、2c的固态荧光光谱(激发波长分别为440,396,366 nm)。
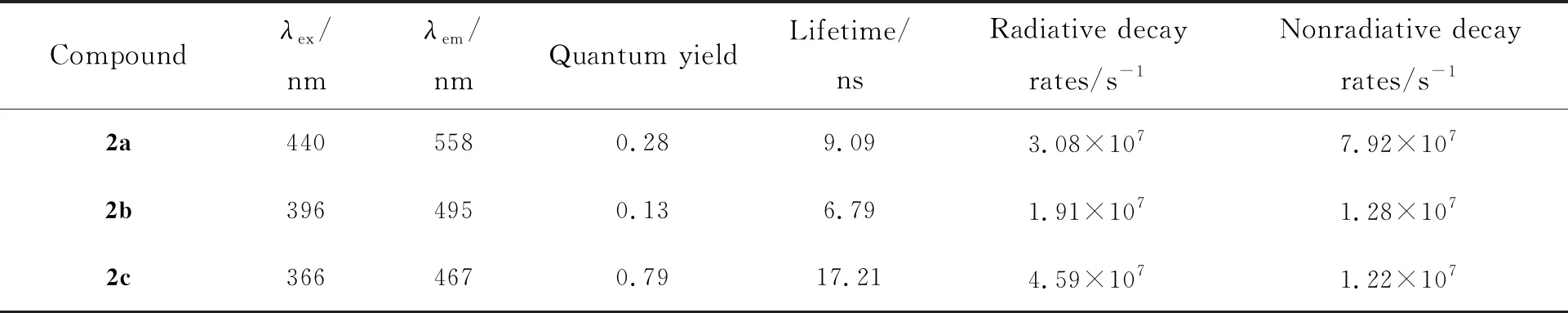
表2 化合物2a、2b和2c在固态下的光谱性质
采用如下公式,可以计算化合物2a、2b和2c的荧光辐射速率常数(Γ)与非辐射速率常数(Knr):
(1)
(2)
如表2所示,对于辐射速率常数,具有对称结构的化合物2c和2a明显大于非对称化合物2b,分别是2b的1.6和2.4倍。化合物2b和2c的非辐射速率常数为1.28×107s-1和1.22×107s-1,只为化合物2a的15%~16%,说明三氯乙酰羰基这样大的基团引入可以抑制激发态的结构变形,增加了基态和激发态的能隙,从而减小非辐射速率常数。
3.3 基于化合物2a在纸张上原位酰化反应的荧光变色墨水体系
通过控制TrocCl的化学计量对化合物2a进行酰化可以选择性地生成2b和2c。我们期望这一反应可以在纸张上原位发生。即首先将一定浓度的化合物2a涂写于本色纸上可以发出黄色荧光,随后采用一定浓度的TrocCl将化合物2a酰化即可以实现荧光发光颜色的改变。经过系列尝试,最终确定了墨水组方为墨水A:1×10-3mol·L-1化合物2a的丙酮溶液、墨水B:2×10-3mol·L-1TrocCl的正己烷溶液、墨水C:8×10-3mol·L-1TrocCl的正己烷溶液。
如图6(e)所示,用毛笔蘸取墨水A涂在本色纸上写“TUST”字样,在自然光下字体为橙黄色,365 nm的紫外光照射下字体发出黄色荧光(如图6(e)ⅰ所示);取墨水B复描“UST”字样,则化合物2a原位酰化生成2b,自然光下字体很快由黄色变成绿色,紫外光照射下字体为绿色荧光(如图6(e)ⅱ所示);取墨水C复描“S”字样,2b进一步原位酰化生成2c,自然光下字体由绿色变成无色,在365 nm紫外光照射下字体发出蓝色荧光(如图6(e)ⅲ所示);而图6(e)ⅳ显示,进一步在“T”字样上涂写墨水A则可以遮盖原有字样的颜色。利用这样的原位化学反应,通过无荧光特征酰化试剂TrocCl将化合物2a不同程度地酰化,在纸张上实现了荧光发光颜色的三色转变,即由黄色变为绿色,进而变为蓝色。
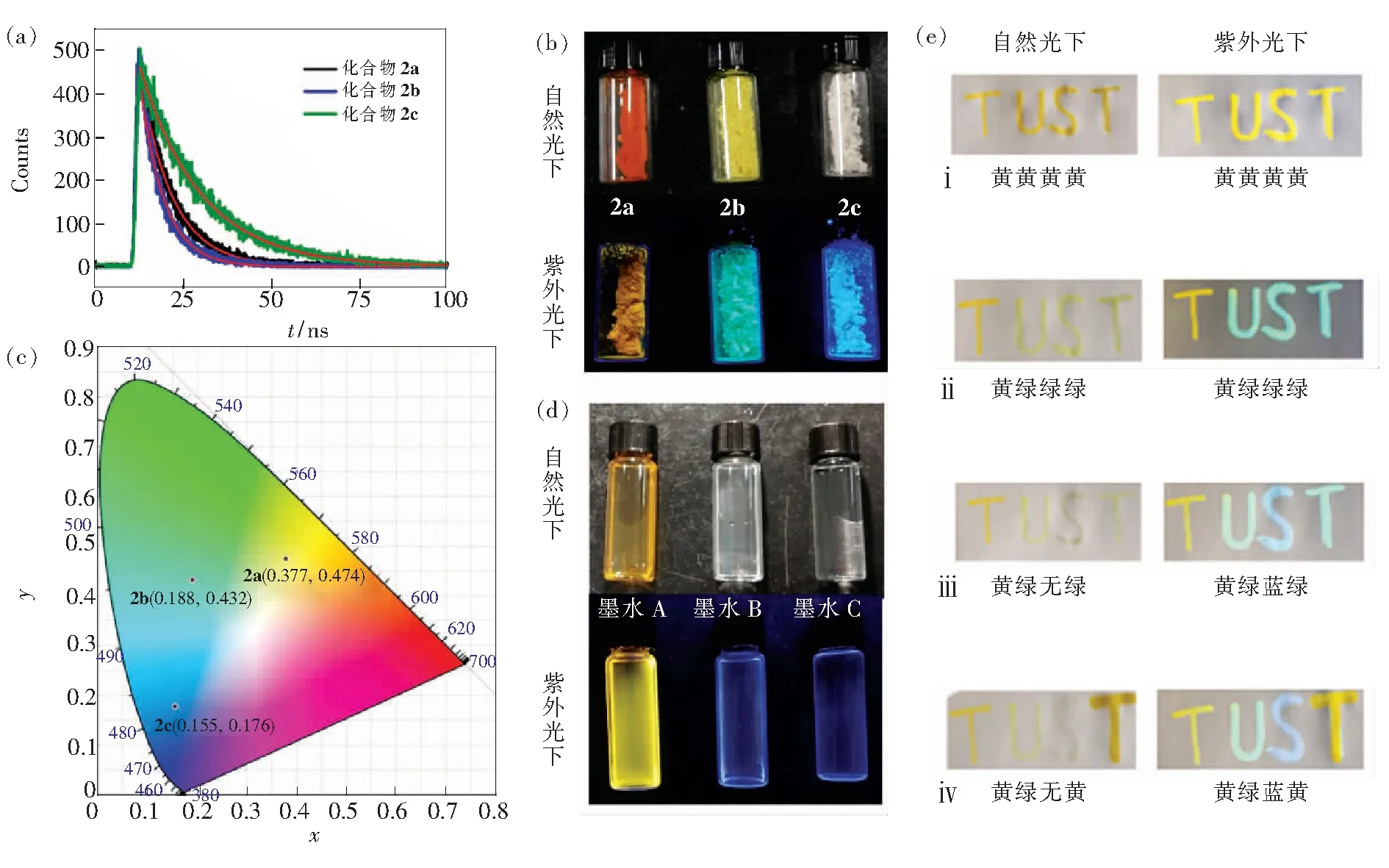
图6 (a)化合物2a、2b、2c的荧光寿命光谱;(b)化合物2a、2b、2c的图像;(c)CIE色度图;(d)墨水A、B、C;(e)荧光墨水的颜色变化图:ⅰ墨水A书写“TUST”,ⅱ墨水B复描“UST”,ⅲ墨水C复描“S”,ⅳ在“T”字样上复描墨水A,其中左侧一列为自然光照射,右侧一列为紫外光照射;图中的“黄”、“绿”、“蓝”、“无”分别代表“黄色”、“绿色”、“蓝色”、“无色”。
4 结 论
本文以丁二酸二丁酯为原料,设计合成了2,5-二氨基-1,4-苯二甲酸丁酯(化合物2a)。化合物2a具有明显的溶致荧光变色行为,在不同的溶剂中可发出绿色、黄绿、橙黄等多种颜色,并且具有较大的Stokes位移。化合物2a在固态下经紫外光照射可发出黄色荧光,采用不同当量的酰化试剂TrocCl将化合物2a的氨基酰化可得到单酰胺化产物化合物2b和双酰胺化产物化合物2c,在固态下分别可发出绿色和蓝色荧光,且具有较高的荧光量子产率。将化合物2a配制成荧光墨水,书写于纸张纸上可以获得黄色荧光字样,在其上涂写不同浓度的TrocCl溶液可将纸张上的化合物2a转化为化合物2b和化合物2c,字体发光颜色可变为绿色和蓝色。这一过程丰富了荧光变色调控墨水的种类,在数据加密和防伪中具有潜在的应用价值。
