鸭源致病性大肠杆菌的分离鉴定及辣木叶水提物抑菌效果分析
2021-01-09董雯雯张世栋王春玲艾洪新李峰
董雯雯 张世栋 王春玲 艾洪新 李峰



摘 要:大肠杆菌病是严重危害养鸭业的一类细菌性疾病,临床上多使用抗生素治疗,但耐药菌株的增多使抗生素的治疗效果大大下降,同时带来食品安全隐患。因此,筛选安全、天然抑菌药物成为研究热点。本试验从疑患大肠杆菌病死鸭无菌采集病料,分离出1株细菌,并对分离的细菌进行形态特征、生化试验、药敏试验、16SrDNA遗传分析,最终判定该分离菌为大肠杆菌。随后,选用本实验室提取的辣木叶水提物(MLHE)进行体外试验验证抑菌活性,利用微量肉汤稀释法检测MLHE最小抑菌浓度(MIC)、分光光度计测定OD630细菌生长曲线以及半固体培养基测定MLHE对分离大肠杆菌丛动能力的影响。结果表明,0.25 g/mL的MLHE可显著抑制大肠杆菌的增殖及丛动能力。该研究结果为指导鸭大肠杆菌临床用药及防控提供了理论依据。
关键词:鸭源大肠杆菌;分离鉴定;辣木叶水提物;丛动
禽大肠杆菌病是由埃希氏大肠杆菌引起禽类的一种以局部或全身性症状为特征的常见人畜共患细菌性疾病,各个日龄的禽类均可被感染,其血清型可能高达数千种[1]。该病常与其他病毒病(流感、新城疫、传染性支气管炎)及支原体病混合感染,增加患病禽的死亡率[2]。大肠杆菌的致病性通常与其所携带的毒力基因协同作用密切相关[3],致病菌侵入机体后,首先通过表达的多种黏附素定植于机体上皮细胞,继而释放各种毒素,造成各组织器官的炎症反应,严重时造成全身性败血症甚至死亡。致病菌进入宿主体内后,通过调控相关毒力基因的表达及相互作用而快速的适应宿主环境,顺利逃避宿主的防御系统,诱发宿主疾病甚至死亡。
目前,抗生素被广泛应用于动物性细菌性疾病的治疗,长期不合理使用抗生素致使大肠杆菌的耐药性不断扩大,给该病的防治带来巨大困难,严重影响我国养禽业的健康高效发展。中药具有低残留、抗炎、抗菌、抗损伤等作用,属于天然药物,在动物体内具有靶点多、作用范围广以及能加强机体免疫功能、改善内分泌系统、调节机体稳态的作用。因此,中药在禽源性大肠杆菌病的治疗上是一个较好的选择。辣木(Moringa oleifera Lam.)属被子门辣木科辣木属植物,其提取物具有高钙、高蛋白质、高纤维和低脂质的优点,且兼具降血糖、降血脂、抗炎、抗氧化、抑菌、抗肿瘤等功效,因此,近年来辣木作为一种“药食两用”天然植物备受关注[4]。我国在2012年特批辣木为新资源食品[5]。
本试验病料来自山东某养鸭场,该养鸭场发病鸭群主要表现为精神不振、采食量下降、呼吸困难、腹泻,部分雏鸭出现死亡。对分离得到的病原菌进行分离鉴定及生物学特性分析,最终确定引起鸭场雏鸭死亡的主要病原菌为大肠杆菌,而且本试验进一步分析病原菌的耐药性及毒力基因,并选用本实验室前期提取的辣木叶水提物(MLHE)进行体外试验验证抑菌活性,旨在找出针对大肠杆菌抑菌效果良好的药物,为养鸭场大肠杆菌病的诊断和高效防控提供理论依据。
1 材料与方法
1.1 病料
送检疑患大肠杆菌病料来自山东地区某养鸭场,经过无菌操作采集病死鸭脑、心、肝等器官备用。
1.2 主要试剂
革兰氏染色液,购自北京索莱宝科技有限公司;抗菌药物药敏试纸,购自北京艾博利德商贸有限公司;微量生化发酵管,购自杭州滨和微生物试剂有限公司;培养基及其他试剂,购自生工生物(上海)股份有限公司;细菌基因组DNA提取试剂盒、PCR扩增试剂盒、DNA胶回收试剂盒,购自Axygen公司;SPF鸭胚,购自山东昊泰实验动物繁育有限公司;辣木叶,购自西安金萃坊植物技术开发有限公司。
1.3 细菌分离培养与病毒检验
无菌采集病死鸭的脑、肝、心等组织器官,用接种环无菌蘸取病变部位,接种于麦康凯琼脂平板和LB琼脂平板,37 ℃恒温培养箱中培养18 h后,观察记录细菌生长状况及形态。随后,从平板上用接种环挑取状态良好的单菌落,进行革兰氏染色,并在光学显微镜下观察细菌形态及染色特性。
为验证是否有病毒感染的可能性,同时研磨病变组织制备悬液,反复冻融3次后接种于9日龄SPF鸭胚,144 h后观察是否有病毒感染,若传1代鸭胚无病变,则收获96 h鸭胚尿囊液继续传代2次,并观察病变。
1.4 細菌药敏及生化试验
分离菌株的药敏试验参照美国临床实验室标准化协会推荐的标准Kirby-Bauer(K-B)纸片法进行试验操作及结果判断[6]。对优势菌进行纯培养,参照伯杰氏手册,使用细菌微量生化管,按照说明书进行生化鉴定及结果判定[7]。
1.5 16S rDNA基因测定及进化树分析
挑取单个细菌菌落,接种于LB培养基中,37℃振荡培养18 h。用细菌基因组DNA提取试剂盒进行细菌基因组DNA的提取,产物-20℃保存备用。设计细菌通用16S rRNA引物,F:5’-AGAGTTTGATCCTGGCTCAG -3’;R:5’-GGTTACCTTGTTACGACTT -3’,并由上海生工生物工程有限公司合成。利用细菌基因组DNA为模板,按照以下比例配制PCR反应体系:模板 1 μL,上下游引物(10 mmol/L)各0.5 μL,2×Taq PCR Mix 10μL,补充ddH2O至20 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃ 45 s,72 ℃ 1 min,共30个循环;最后72 ℃延伸10 min。PCR产物进行胶回收后送往生工生物工程(上海)股份有限公司测序鉴定。
1.6 毒力基因检测
参照文献[8]合成大肠杆菌血清抗性蛋白(Iss)、溶血素F(HlyF)、温度敏感血凝素基因(Tsh)、毒素基因(Ast A)、铁离子摄取系统基因(IroN、IucD)引物,引物具体信息见表1。以提取的大肠杆菌DNA为模板进行PCR扩增,检测其携带的毒力基因,PCR产物用1%琼脂糖凝胶电泳并在凝胶成像系统进行观察并记录结果。
1.7 致病性试验
将分离纯化的菌株接种于LB培养基中,37℃振荡培养18 h。取培养液(菌量1×106 CFU/mL)0.5 mL肌肉注射于5只6日龄雏鸭,对照组注射0.5 mL生理盐水,观察症状,并无菌采集病死鸭心、肝、脾进行病原微生物分离和鉴定。
1.8 最小抑菌浓度(minimal inhibition concentration, MIC)测定
采用微量肉汤稀释法测定辣木叶水提物(MLHE)对菌株的MIC值。调整过夜培养的细菌含量至1×106 CFU/mL,将实验室前期提取的MLHE稀释至所需浓度,取0.1 mL至96孔板的第一孔,按2倍倍比稀释法稀释至第7孔,每孔加100 μL药样和100 μL菌液,第8孔加入100 μ
L LB培养液和100 μL菌液设为阳性对照,第9孔添加200 μL LB培养液设为阴性对照。置37 ℃培养24 h观察结果,以肉眼观察到能抑制80%细菌生长的最低药物浓度作为MIC。
1.9 MLHE对细菌生长曲线的影响
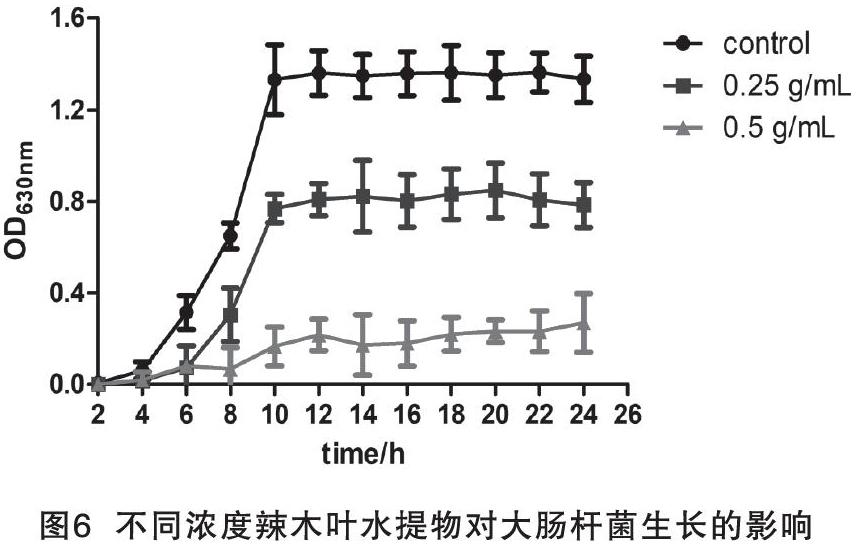
调整菌液浓度至1×106 CFU/mL,分别接种至等量的灭菌LB肉汤、含1/2 MIC浓度和MIC浓度MLHE的LB肉汤中,使最终细菌数量达到1×104 CFU/mL,设为对应的临床分离株组、1/2 MIC组和MIC组,每组设三个平行,放置37 ℃、180 r/min摇床上震荡培养,每组每隔2 h吸取等量菌液测定OD630,共培养24 h。以时间为横坐标,菌悬液吸光值为纵坐标,绘制生长曲线。
1.10 MLHE对细菌丛动的影响
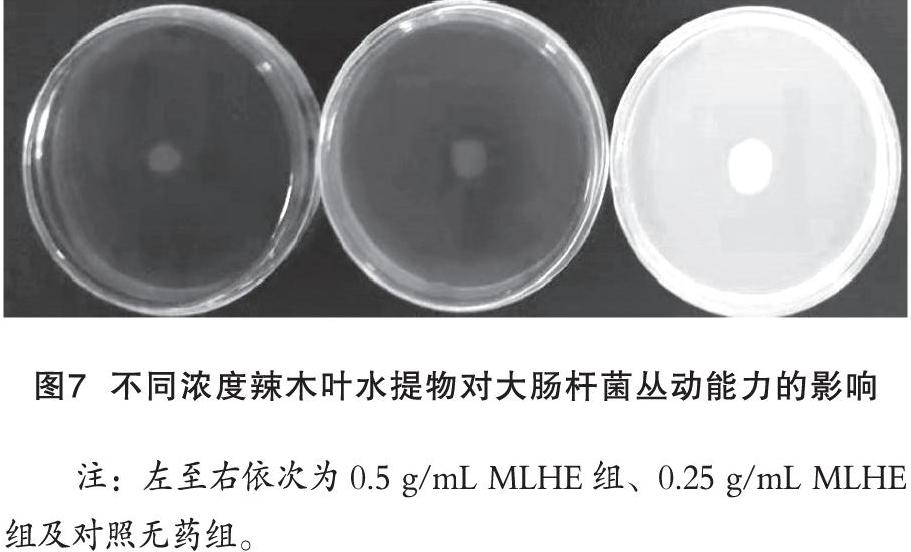
在添加不同浓度MLHE的丛动培养基(0.5%LB琼脂培养基)上,于中心滴加2 μL的过夜培养菌液,37 ℃静置培养18 h,观察结果并测量从接种点向周围扩散生长范围的直径。
2 结果
2.1 细菌分离及形态观察
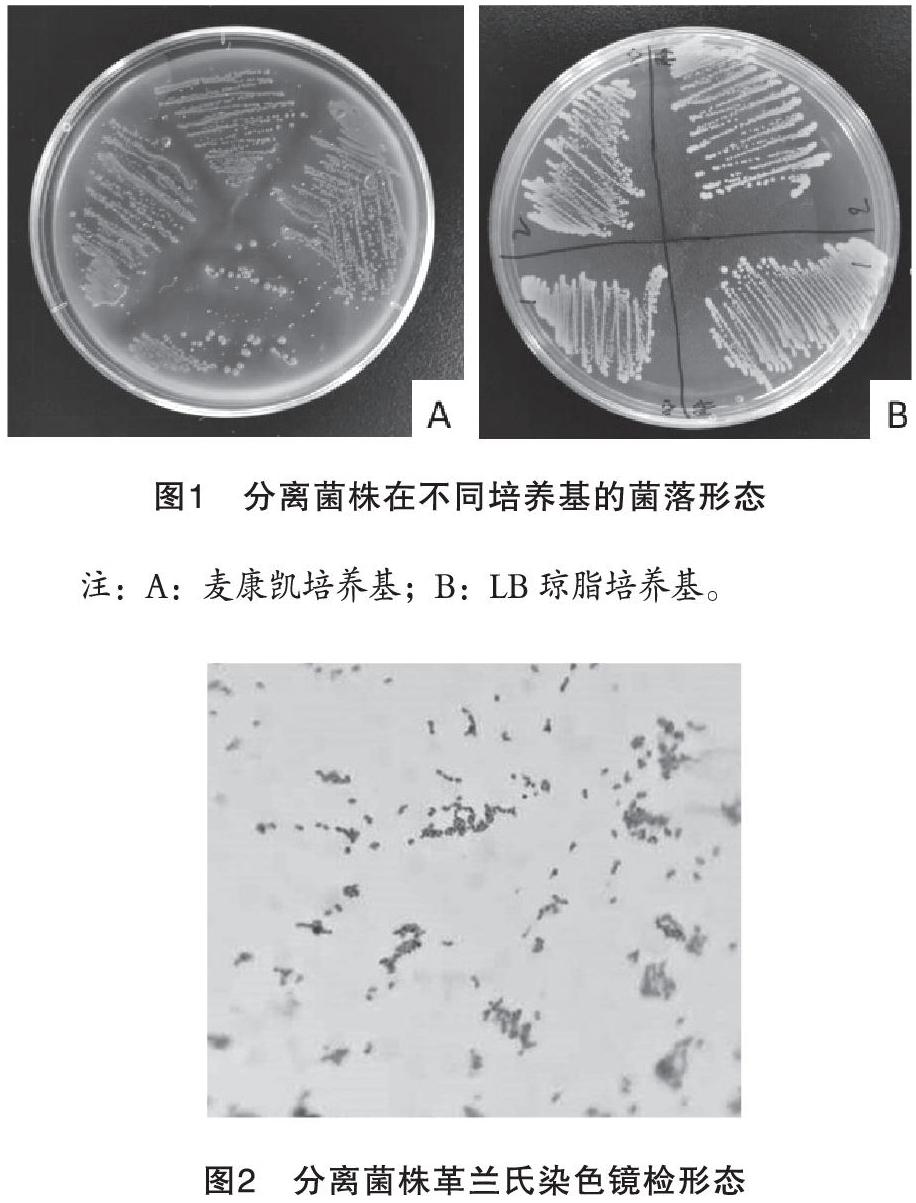
从病死鸭各脏器分离得到的细菌在麦康凯琼脂培养板上划线培养18 h,可见微红色、菌落中心呈深桃红色、圆形、扁平且边缘整齐、表面光滑的湿润菌落,直径约3 mm左右,呈现典型的大肠杆菌菌落特性(图1)。经革兰氏染色镜检后,发现菌体为细长、两短钝圆的长杆状革兰氏阴性菌,多呈单个存在(图2)。此外,组织研磨液连续3代接种SPF鸭胚144 h后均无病变,由此排除病毒感染的可能。
2.2 药敏试验结果
K-B纸片扩散法鉴定分离菌株药敏性,结果如表2所示:分离的菌株对头孢西叮、头孢吡肟、氨曲南3种药物高度敏感;对其他的7种药物低敏感或不敏感。
2.3 生化试验鉴定
分离株生化特性表现为:乳糖、麦芽糖、葡萄糖、甘露醇、山梨醇均为阳性,明胶、蔗糖、H2S、枸橼酸盐试验为阴性,基本符合大肠杆菌属特性。生化试验结果见表3。
2.4 16S rDNA基因测序及进化树分析
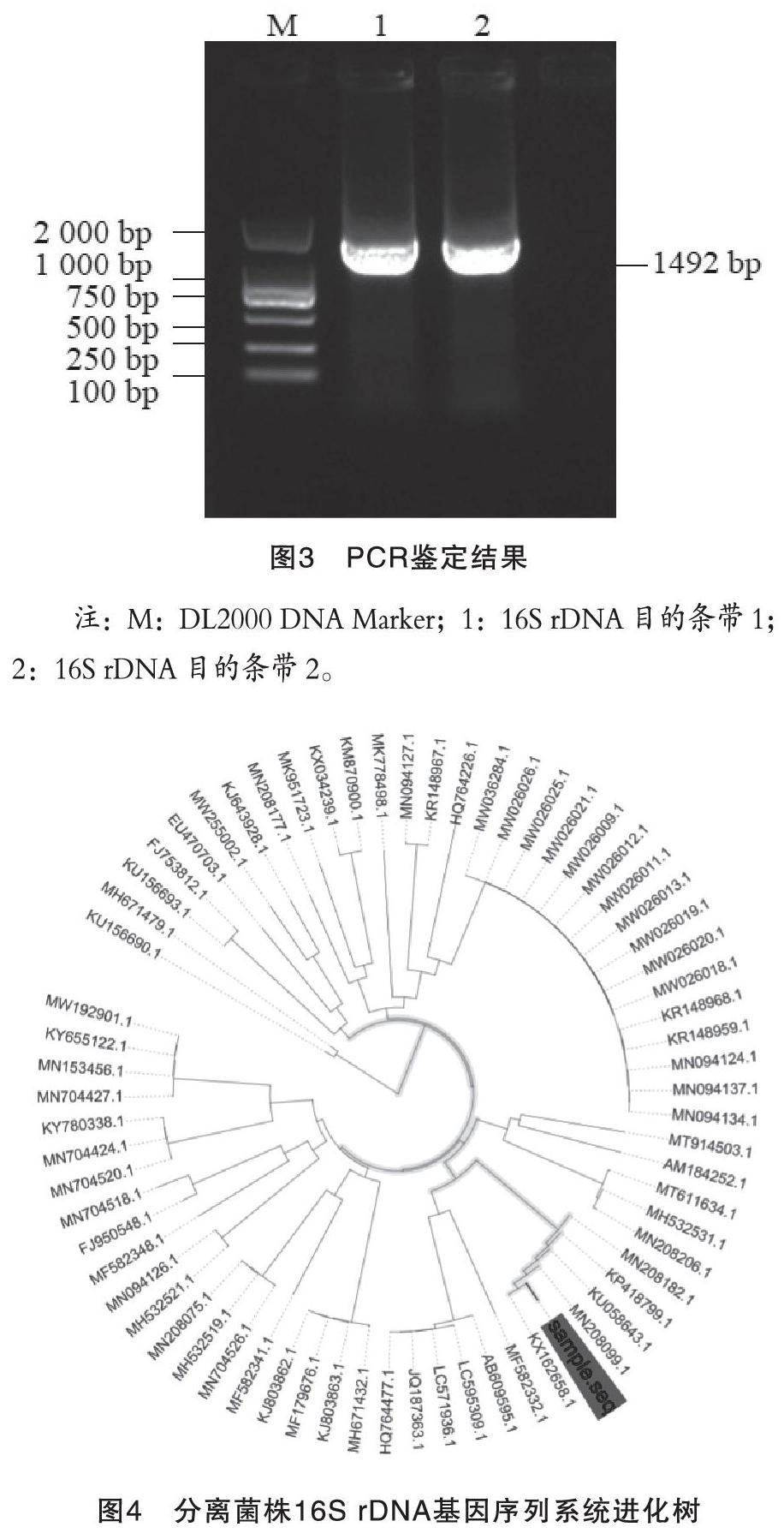
提取菌株基因组DNA,PCR扩增其16S rDNA序列。琼脂糖凝胶电泳结果显示,扩增出的目的基因条带大小约1 492 bp,与预期大小相符(图 3)。利用MegAlign软件对分离菌株的核苷酸序列与从NCBI中下载的相近菌株进行同源性分析,结果显示,本试验分离出的菌株与GenBank中收录的大肠杆菌16S rDNA序列同源性达99%以上;系统进化树分析发现,该分离株与中国TYN株、韩国PYK20株及日本S18株位于同一个分支上,属于统一亚群,与中国TYN株的进化关系最近(图4)。综合上述试验分析结果,可以确定该分离株为大肠杆菌。
2.5 毒力基因PCR检测结果
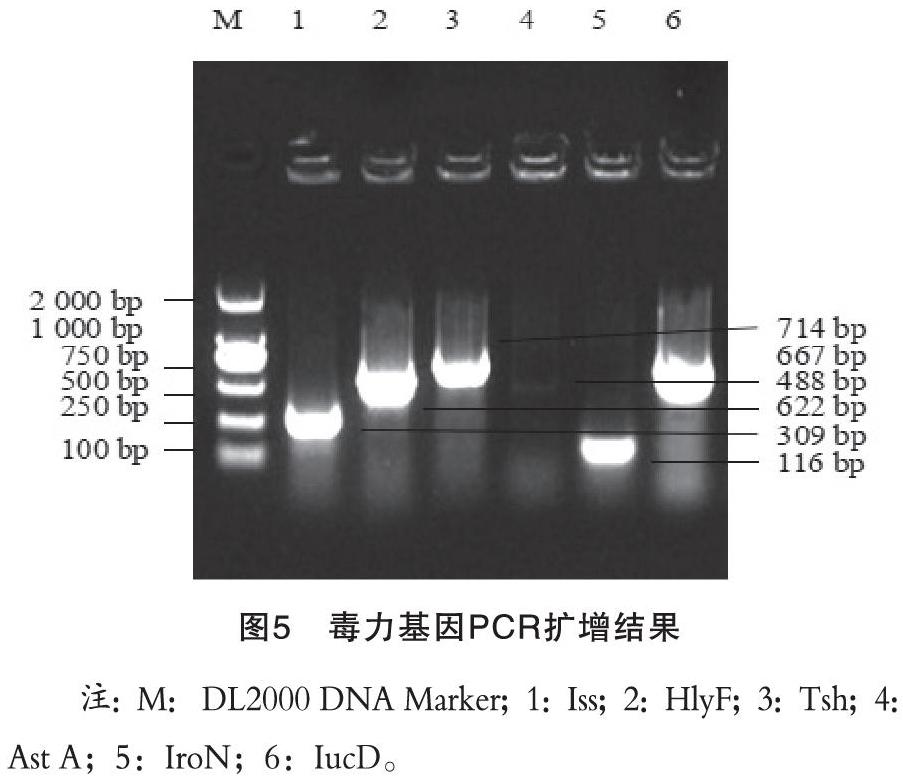
用设计合成的6种大肠杆菌毒力基因的特异性引物进行PCR鉴定,经1%琼脂糖凝胶电泳后结果显示,该分离株携带Iss(309 bp)、HlyF(622 bp)、Tsh(488 bp)、Ast A(116 bp)、IroN(667 bp)、IucD(714 bp)6种毒力基因,结果见图5。其中Ast A基因检测结果显示较弱,提示可能该毒力基因含量低。
2.6 致病性试验
将新鲜纯化后的分离株感染5日龄雏鸭12 h后,感染鸭只陆续出现临床症状,表现为精神沉郁、扎堆怕冷、采食量下降症状。24 h后出现死亡病例,对病死鸭只进行剖检发现:病死鸭肠道有出血,有粘性渗出,粪便稀薄,呈青绿色或灰白色,肛门周围污秽;心包有积液,心包膜混浊;肝脏肿大。空白对照组雏鸭均健康存活。采取死亡鸭病变组织器官,分离出的病原菌经实验室鉴定同接种菌一致,显示该分离菌具有很强的致病性。
2.7 MIC测定
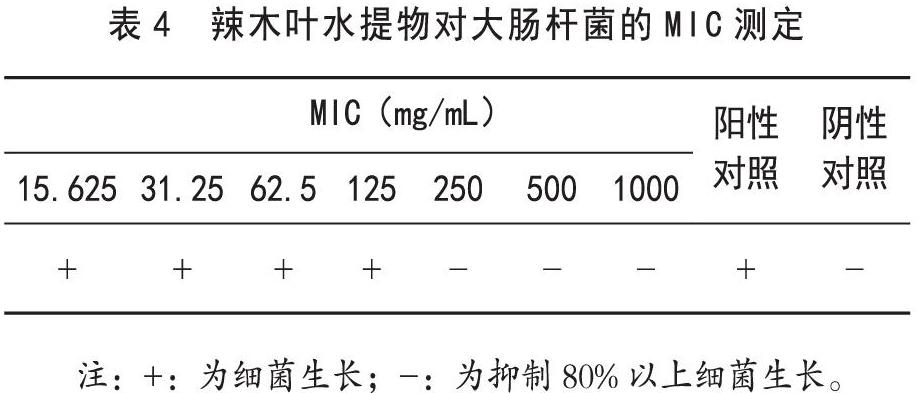
由表4可知,大肠杆菌分别在15.625、31.25、62.5、125、250、500、1000 mg/mL MLHE作用24 h后,结果显示培养基中细菌数量随MLHE浓度的增加而减少,说明MLHE可抑制大肠杆菌的生长,且抑制效果与药物浓度呈正相关。当MLHE浓度为250 mg/mL(即0.25 g/mL)时,可抑制约80%大肠杆菌临床分离株的生长,由此可判断MLHE对大肠杆菌临床分离株的MIC为0.25 g/mL。
2.8 MLHE对大肠杆菌生长曲线影响
由图6可知,细菌整体的生长曲线大致呈“S”型,具有明显的生长对数期和稳定生长期,符合大肠杆菌的生长规律。此外,MLHE在0.25~0.5 g/mL浓度时大肠杆菌的增殖較为缓慢,表现出明显的细菌抑制效果(P<0.05);浓度为0.5 g/mL的MLHE组细菌抑制效果最佳。MLHE对大肠杆菌生长曲线的影响见图6。
2.9 MLHE对大肠杆菌丛动能力的影响
在含有MLHE的丛动检测培养基中,辣木叶浓度越高,大肠杆菌生长范围越小,如图7所示。无药组扩散直径为(14.9±0.25)mm,0.5 g/mL MLHE组和0.25 g/mL MLHE组细菌扩散直径分别为(7.86±0.44)mm和(9.69±0.51)mm。
3 讨论
近年来,大肠杆菌耐药谱不断增加给养殖业带来巨大损失,耐药细菌借助基因水平转移等方式在人、动物、环境循环传播,增加了人类摄入耐药基因的风险,给公共卫生和食品安全造成了重大威胁。本研究从分离菌株药敏试验结果观察到,大肠杆菌对第3代头孢类药物及单环β-内酰胺类抗生素高度敏感,对多粘菌素、糖肽类、氨基糖苷类等抗生素均具有耐药性。多粘菌素通常被认为是治疗青霉烯类大肠杆菌感染的最后一道防线[9],其耐药基因可经质粒转移,本研究发现该大肠杆菌对多粘菌素呈现一定的耐药性,与朱琳清[10]的研究结果相一致,因此应该重视相关方面的调查,以控制耐药趋势的扩散。从药敏结果推测,该养殖场可能存在抗生素药物使用不规范的情况,导致大肠杆菌的多重耐药,因此要加强养殖场的精细化管理[11],同时可增加中兽药等无抗、减抗药物的临床应用和推广,以减少更多耐药菌株的出现。
大肠杆菌的致病性通常由多种毒力因子如黏附素、摄铁系统、毒素、脂多糖、侵袭素和血清抗性相关因子等相互协调发挥作用[12],调控自身毒力基因的表达在感染宿主中起着非常重要的作用。首先,细菌经过黏附素的作用率先定殖于宿主细胞,开启感染宿主的第一步,为了适应宿主环境,菌体内的一些毒力因子开始特异性表达[13],如:摄铁系统相关基因的表达可显著增强细菌的生存能力及致病力;血清抗性蛋白基因的异常表达增强细菌的血清抗性,逃逸宿主免疫反应。王俊丽[14]对聊城地区收集的212株禽源大肠杆菌进行毒力基因的检测,统计发现Tsh毒力基因的检出率高达76.5%。郭长明[15]对分离的21株鸭源大肠杆菌毒株毒力基因进行分析,发现同时含5种毒力基因的菌株占28.57%,含4种毒力基因的占23.81%。王怡平[16]研究推测,能检出Iss、CvaC、Irp2、IucD、IroN、Tsh 6种毒力基因中的3种及以上就可判定为该菌为致病性大肠杆菌。本研究对分离得到的大肠杆菌进行毒力基因检测,可同时检测出大肠杆菌抗血清存活因子相关基因、溶血素基因、黏附相关基因、温度敏感血凝素相关基因、毒素基因、铁转运相关基因这6种毒力基因,致病性试验结果显示与王怡平的推测结果一致。本试验结果表明,分离的鴨源大肠杆菌具有较强致病性。
辣木的抑菌活性已经获得了广泛的认可。使用不同提取溶剂提取的辣木叶有效成分不同,抑菌能力也有差别。由于成本低、容易获取、溶解能力强且相对安全,目前广泛应用于提取的溶剂主要是水和乙醇。目前的研究表明,辣木的各个部位提取物对致病菌具有非常强的抑制作用。Moyo B等[17]研究发现辣木叶的丙酮提取物中的活性成分对大肠杆菌、产气肠杆菌、普通变形杆菌、金黄色葡萄球菌和克氏微球菌都表现出了非常强的抗菌能力。魏宇清[18]研究了辣木叶和辣木茎对金黄色葡萄球菌、副溶血弧菌的抑制作用,发现辣木茎的醇提物的抑菌能力强于水提物,辣木叶水提物的抑菌能力强于醇提物。研究[19]发现,辣木叶提取物的抗菌活性与含有的单宁、黄酮类化合物、酚类化合物有关,且辣木叶中含有的辣木素可分解成两个异硫氰酸苄酯分子,也被证明有抗菌活性。本研究得到的结果与上述研究结果具有一致性,尽管使用了不同的提取溶剂,但辣木叶提取物都表现出比较好的抑菌能力,说明辣木的有效抗菌物质溶解性非常好,既可以溶解于水等无机溶剂,又可以溶解于乙醇、丙酮、乙酸乙酯等有机溶剂。
参考文献:
[1] Osman K M, Hessain A M, Abo-shama U H, et al. An alternative approach for evaluating the phenotypic virulence factors of pathogenic Escherichia coli[J].Saudi J Biol Sci., 2018, 25 (2):195-197.
[2] Swayne D E. DiseasesofPoultry[M]. 14th Edition. 111 River Street, Hoboken:John Wiley & Sons, Inc.,2020.
[3] Wooley R L, Gibbs P S, Brown T P, et al. Chicken embryo lethality assay for determining the virulence of avian Escherichia coliisolates[J].Avian Dis., 2000, 44(2):318-324.
[4] 刘思玉,葛武鹏,赵丽丽,等. 辣木籽提取物提取工艺优化及其对乳中蜡样芽孢杆菌的抑制作用[J].食品工业科技,2021,42(15): 110-118.
[5] 张彤.中华人民共和国食品安全法[J].新疆农垦科技,2015, 5: 82-83.
[6] 倪语星,王金良,徐英春. 抗微生物药物敏感性实验规范[M].北京:上海科学技术出版社,2002: 78-79.
[7] 姚火春. 兽医微生物实验指导[M].第2版.北京:中国农业出版社,2010.
[8] 张子越,赵鲁,赵巧雅,等. 山东地区鸡源致病性大肠杆菌的相关基因检测及药敏试验[J]. 家禽科学,2019 (6):12-16.
[9] YaoX, DoiY, ZengL, etal.Carbapenem-resistant and colistin-resistant Escherichiacolicoproducing NDM-9 and MCR-1[J]. Lancet Infect Dis., 2016, 16(3): 288-289.
[10] 朱琳清. 鸭源大肠杆菌的分离鉴定[D].成都:四川农业大学,2019.
[11] 岑道机,麦嘉琳,周毓源,等. 广东鹅场大肠杆菌耐药状况及blacCTX-M基因的传播特征[J].中国畜牧兽医,2020,47(5):1571-1582.
[12] Johnson J K, Russo T A. Molecular epidemiology of extraintestinal pathogenic (uropathogenic) Escherichia coli[J]. lnt J Med Microbiol, 2005, 295( 6):383-404.
[13] Abe A, Kenny B. Characterization of two virulence proteins secreted by rabit enteropathogenic Escherichia coli, EspA and EspB, whose maximal expression is sensitive to host body temperature[J]. Infect Immun., 1997, 65:3547-3555.
[14] 王俊丽,李玉保,赵哲萌,等.聊城地区鸡源大肠杆菌毒力基因分析[J].黑龙江畜牧兽医,2020(17):88-92+170.
[15] 郭长明,吴植,朱善元,等.江苏及周边地区鸭致病性大肠杆菌血清型、毒力因子及耐药研究[J].中国畜牧兽医,2020,47(12):4076-4084.
[16] 王怡平,孙畅,赵丽丽,等. 鉴别禽致病性大肠杆菌与禽非致病性大肠杆菌的多重PCR检测方法的建立及初步应[J].中国兽医科学, 2018, 48( 11) : 1358-1364.
[17] Moyo Busani M P J A. Antimicrobial activities of Moringa oleifera Lam leaf extracts[J]. Afr JBiotechnol., 2012,11(11):2797-2802.
[18] 魏宇清.几种香辛料提取物对常见食源性致病菌生物膜作用的研究[D]. 武汉:华南农业大学,2016.
[19] 王丽虹,刘阳,姜圆圆,等. 辣木叶醇提物不同极性部位抑菌活性研究[J].食品研究与开发,2020,41(10): 34-38.
