珊瑚藻多糖酶法提取工艺优化及其在卷烟中的应用
2021-01-09张峰谢全灵余志强操晓亮张怡评赵敏洪专郭洪辉陈晖洪祖灿
张峰 谢全灵 余志强 操晓亮 张怡评 赵敏 洪专 郭洪辉 陈晖 洪祖灿







摘 要:为了开发天然海藻多糖烟用保润剂,采用酶解法从珊瑚藻中提取多糖,首先考察5种酶对多糖提取量以及卷烟吸食品质的影响;在优选木聚糖酶的基础上,进一步通过单因素试验考察酶解温度、酶解时间、酶添加量、柠檬酸浓度等提取工艺条件对多糖提取量的影响;最后设计4因素3水平正交试验优化珊瑚藻多糖的酶法提取工艺。结果表明,最优酶法提取工艺条件为:木聚糖酶添加量为0.8%(m/m),酶解温度50 ℃,酶解时间3 h,柠檬酸浓度为0.062 5 g/L,珊瑚藻多糖提取量為(661.1±7.8) mg/g。感官分析评价结果表明,添加适量的珊瑚藻多糖具有显著改善卷烟吸食品质的效果。
关键词:珊瑚藻;酶法提取;木聚糖酶;多糖;卷烟
Abstract: The aim of this study was to develop natural polysaccharide humectant for cigarette. The method of enzymatic hydrolysis was used to extract polysaccharides from coralline algae. Firstly, the effects of five kinds of enzymes on the extraction amount of polysaccharides and their corresponding sensory evaluation of smoking quality were studied. After selecting xylanase as the optimal enzyme, the single-factor experiments were carried out to systematically investigate the influences of enzymolysis temperature, enzymolysis time, enzyme content, and citric acid concentration on the extraction amount of polysaccharides. Finally, four factors and three levels orthogonal experiments were designed to optimize the enzymatic extraction process. The results showed that the optimum conditions of the enzymatic extraction process were as follows: xylanase dosage 0.8% (m/m), enzymolysis temperature 50 ℃, enzymolysis time 3 h, citric acid concentration 0.062 5 g/L. Under the optimal enzymatic extraction process, the extraction amount of coralline polysaccharides reached (661.1±7.8) mg/g. The results of the sensory evaluation showed that the smoking qualities of cigarettes were significantly improved with the addition of an appropriate amount of coralline polysaccharides.
Keywords: coralline algae; enzymatic extraction; xylanase; polysaccharide; cigarette
烟草保润性能对卷烟品质有着重要影响,我国卷烟制品的保润性能较差,存在烟气干燥、辛辣、甜润度不够等诸多缺陷[1-2]。海藻多糖富含羟基等亲水性基团,具有很强的保水作用,是一类理想的天然烟用保润剂。开发特色海藻多糖烟用保润剂,对提高卷烟产品品质、彰显卷烟品牌风格特征、提高中式卷烟产品竞争力等都具有重要的意义[3]。
目前,海藻多糖的提取方法有热水提取法[4-5]、酸提法[6-7]、碱提法[8-9]、醇提法[5,10]、微波辅助提取法[11-12]、超声波辅助提取法[13-14]、酶解法[15-16]等。传统热水提取法操作简单,但耗时长、多糖得率低;酸、碱提取法可得到酸溶性、碱溶性不同种类多糖,但会降解部分多糖,对多糖的结构和活性影响较大;醇提法需使用大量有机溶剂,生产成本与生产要求较高;微波与超声波辅助提取法受设备限制难以实现规模化工业生产;酶解法的提取条件比较温和,具有多糖收率高、能耗低等优点。陈森林等[17]采用柠檬酸提取法分别从海带、紫菜、洋栖菜、麒麟菜等4种海藻中提取功能性多糖,发现海带多糖具有明显改善卷烟吸食品质的效果。卢茳虹[18]也采用柠檬酸提取法制备获得两种提高烟气细腻程度、减少刺激性、余味变干净的海带多糖样品。杨君等[19]采用微波辅助提取工艺从裂片石莼中提取多糖,发现将裂片石莼多糖添加到烟丝中能较好地改善吸食的口感。然而,鲜见酶解法提取海藻多糖及其在卷烟中应用的研究报道。
珊瑚藻(Coralline officinalis)含有多糖、水溶性膳食纤维、脂肪酸、核黄素等活性成分,其中多糖含量最为丰富[20-21]。为了开发珊瑚藻多糖的烟用保润功能,本文采用酶解法提取珊瑚藻多糖,系统研究酶种类、酶解温度、酶解时间、酶添加量、柠檬酸浓度等因素对多糖提取量的影响,通过正交试验优化酶解工艺条件,开发具有改善卷烟吸食品质的珊瑚藻多糖酶法提取工艺,为充分挖掘与利用海藻多糖资源提供技术支撑。
1 材料与方法
1.1 材料与仪器
试剂:纤维素酶(试剂级,上海阿拉丁公司),木聚糖酶和α-淀粉酶(食品级,西宝生物科技股份有限公司),果胶酶和木瓜蛋白酶(食品级,南宁庞博生物工程有限公司),一水合柠檬酸、盐酸、硫酸、甲基红、乙醇、溴甲酚绿、葡萄糖和苯酚(分析纯,西陇科学股份有限公司)。
仪器:高速离心机(HITACHI CR22N,日本)、紫外-可见分光光度计(HITACHI UH5300,日本)、数显恒温水浴鍋(HH-8,上海梅香仪器有限公司)、低温恒温反应浴(DFY-5L/20,巩义市予华仪器有限责任公司)、涡旋振荡器(QL-901,海门市其林贝尔仪器制造有限公司)、搅拌器(IKA RW 20,德国),实验室香精香料注射仪(Burghart CIJECTOR,德国)。
1.2 试验方法
1.2.1 酶法提取工艺 称取适量盐渍珊瑚藻,水洗、晾干、粉碎之后,再精确加入纯水、酶与柠檬酸,进行酶解处理,得到珊瑚藻酶解液;珊瑚藻酶解液进一步在90 ℃条件下加热2 h,实现高温灭酶;最后采用高速离心机,在10000 r/min条件下离心10 min取上清液,即为珊瑚藻酶解液。酶解工艺流程为:珊瑚藻→水洗→粉碎→酶解→灭酶→高速离心→多糖提取液。
1.2.2 单因素试验 在单因素试验过程中,固定料液比为1∶20,以酶种类、酶解温度、酶解时间、酶添加量、柠檬酸浓度作为考察因素,以多糖提取量为考查目标进行单因素试验。
1.2.3 正交试验 在单因素试验的基础上,选取酶解温度(A)、木聚糖酶添加量(B)、酶解时间(C)和柠檬酸浓度(D)4个因素设计正交试验L9(34),以多糖提取量为指标,筛选酶法提取多糖的最佳提取条件,正交试验因素及水平如表1所示。
1.3 多糖测定
1.3.1 葡萄糖标准曲线的绘制 参照国标GB/T 15672—2009《食用菌中总糖含量的测定》中葡萄糖标准曲线的制定方法,以葡萄糖含量为横坐标,对应吸光值为纵坐标,绘制标准曲线,回归方程为y=0.008 8x−0.099 9(R²=0.999 5)。
1.3.2 多糖提取量 本试验采用苯酚-硫酸法测定多糖提取量SC/T 3404—2012《岩藻多糖》。取适量多糖提取液,依次加入1 mL 5%苯酚水溶液和5 mL浓硫酸,加水补足至10 mL,涡旋混匀后,于30 ℃水浴反应20 min,后在490 nm 测定吸光度,代入葡萄糖标准曲线,求得提取液中多糖浓度,并计算多糖提取量。
1.4 多糖在卷烟中的感官评价
选择未加香加料的七匹狼(空白)卷烟为参试烟支。用香精注射仪将珊瑚藻多糖按0.05%的比例均匀添加入参试卷烟中,以不添加珊瑚藻多糖的参试烟支为参比烟支,于(22±1)℃和RH(60±2)%环境中平衡48 h,组织10名专业评吸人员依据YC/T 497—2014《卷烟 中式卷烟风格感官评价方法》对参比卷烟及添加珊瑚藻多糖的卷烟进行对比评吸。
1.5 数据处理
单因素试验结果使用Excel作图分析,正交实验设计及结果使用正交设计助手Ⅱ分析。
2 结 果
2.1 单因素试验
2.1.1 酶种类的筛选 首先考察纤维素酶、果胶酶、木聚糖酶、α-淀粉酶、木瓜蛋白酶等5种酶对珊瑚藻多糖提取量以及卷烟吸食品质感官评价的影响。从图1可知,当料液比为1∶20、柠檬酸溶液浓度为0.125 g/L、酶添加量为0.2%(m/m,全文同)、酶解温度为50 ℃、酶解时间为3 h时,多糖提取量按从大到小排序为:木聚糖酶>果胶酶>纤维素酶>α-淀粉酶>木瓜蛋白酶。
将各种酶法提取的珊瑚藻多糖用于卷烟保润加香并进行感官评价。从图2可以看出,在口味风格方面,添加珊瑚藻多糖对卷烟的酸味、苦味、凉味无影响,但均能明显提升卷烟烟气甜感,尤其是果胶酶与木聚糖酶的效果更加明显。从图3可以看出,在舒适感方面,珊瑚藻多糖能改善卷烟口腔刺激/舌部灼烧、口腔残留/干燥感、喉部刺激,尤其是木聚糖酶的提升效果最明显;但对卷烟收敛、喉部干燥、鼻腔刺激等指标均无影响。从图4可以看出,在香气特性方面,珊瑚藻多糖能改善卷烟的细腻/柔和/圆润,其中木聚糖酶的提升效果最明显;对香气、丰富性、烟气浓度、劲头等指标均无影响;纤维素酶、α-淀粉酶、木瓜蛋白酶处理具有明显的杂气。
综上,采用木聚糖酶解工艺的珊瑚藻多糖提取量最高,添加适量的木聚糖酶解工艺提取的珊瑚藻多糖能明显增加卷烟甜感,改善刺激、干燥感,圆润烟气。因此,优选木聚糖酶为酶法提取工艺的酶种类。
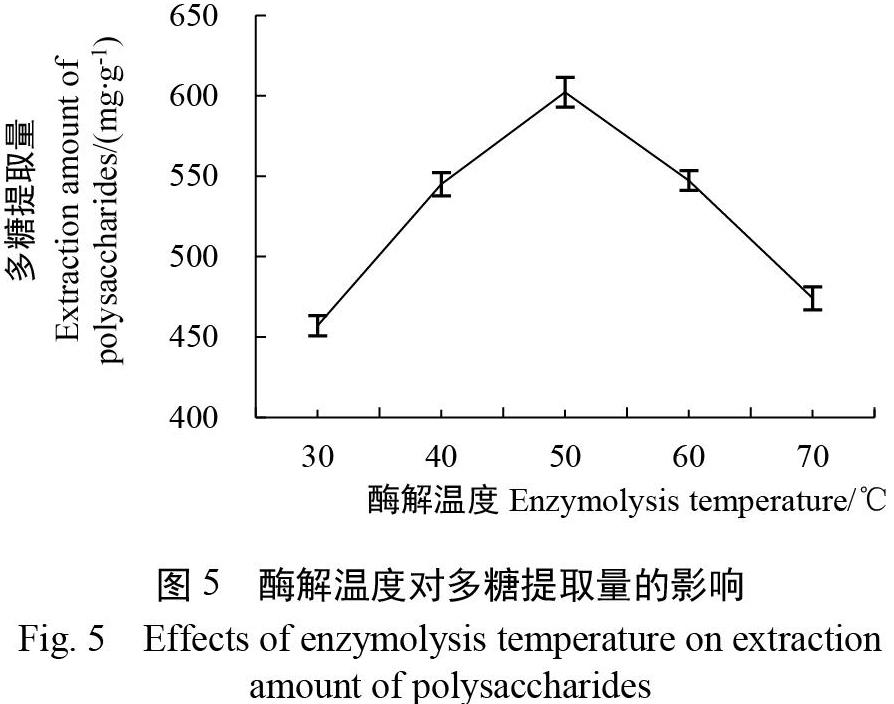
2.1.2 酶解温度对多糖提取量的影响 在优选木聚糖酶的基础上,进一步考察30、40、50、60、70 ℃等不同酶解温度对多糖提取量的影响。
当设定料液比为1∶20、柠檬酸溶液浓度为0.125 g/L、木聚糖酶添加量为0.2%、酶解时间为3 h时,由图5可知,当酶解温度从30 ℃升高到50 ℃时,多糖提取量随着酶解温度提高而显著增加,但当酶解温度从50 ℃进一步提高到70 ℃时,多糖提取量随着酶解温度的上升而不断降低。因此,优选的酶解温度为50 ℃,后续正交试验设计选择40、50、60 ℃作为酶解温度的3个水平。
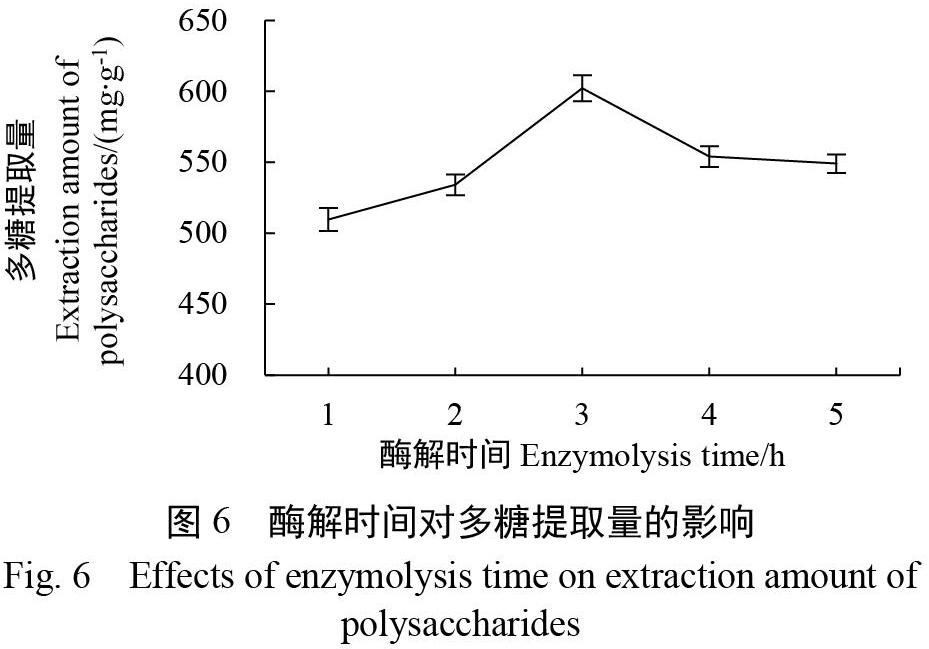
2.1.3 酶解时间对多糖提取量的影响 在优选木聚糖酶与酶解温度(50 ℃)的基础上,进一步考察1、2、3、4、5 h等不同酶解时间对多糖提取量的影响。
当设定料液比为1∶20、柠檬酸溶液浓度为0.125 g/L、木聚糖酶添加量为0.2%、酶解温度为50 ℃时,由图6可知,当酶解时间从1 h延长到3 h时,多糖提取量随着酶解时间的延长而显著增加,表明适当延长酶解时间有助于提高木聚糖酶的酶解效率,从而提高多糖提取量。但是,当酶解时间从3 h进一步延长到5 h时,多糖提取量随着酶解时间的延长反而降低。因此,优选的酶解时间为3 h,后续正交试验设计选择2、3、4 h作为酶解时间的3个水平。
2.1.4 酶添加量对多糖提取量的影响 在优选木聚糖酶、酶解温度(50 ℃)与酶解时间(3 h)的基础上,进一步考察0.05%、0.1%、0.2%、0.4%、0.8%等不同木聚糖酶添加量对多糖提取量的影响。
当设定料液比为1∶20、柠檬酸溶液浓度为0.125 g/L、酶解温度为50 ℃、酶解时间为3 h时,由图7可知,当木聚糖酶添加量从0.05%增加到0.4%时,多糖提取量随着酶添加量的增加而不断增加,但是,当木聚糖酶添加量从0.4%增加到0.8%时,多糖提取量没有明显变化。因此,优选的木聚糖酶添加量为0.4 %,后续正交试验设计选择0.2%、0.4%、0.8%作为木聚糖酶添加量的3个水平。
2.1.5 柠檬酸浓度对多糖提取量的影响 在优选木聚糖酶、酶解温度(50 ℃)、酶解时间(3 h)与木聚糖酶添加量为(0.4%)的基础上,进一步考察0.031 25、0.062 5、0.125、0.25、0.5 g/L等不同柠檬酸溶液浓度对多糖提取量的影响。
当设定料液比为1∶20、木聚糖酶添加量为0.4%、酶解时间为3 h、酶解温度为50 ℃时,由图8可见,当柠檬酸浓度从0.031 25增大到0.062 5 g/L时,多糖提取量随着柠檬酸浓度增大而增加,表明增大柠檬酸浓度有助于提高多糖提取量。但是,当柠檬酸浓度从0.062 5增大到0.5 g/L时,多糖提取量反而降低了。因此,优选的柠檬酸浓度为0.062 5 g/L,后续正交试验设计选择0.031 25、0.062 5、0.125 g/L作为柠檬酸浓度的3个水平。
2.2 正交试验
在单因素试验的基础上,选取酶解温度、木聚糖酶添加量、酶解时间和柠檬酸浓度4个因素设计正交试验L9(34),以多糖提取量为目的指标,筛选酶法提取多糖的最佳工艺条件,结果如表2所示。
通过表2结果直观分析可知,采用木聚糖酶法提取珊瑚藻多糖的工艺,多糖提取量的影响因素主次顺序依次为木聚糖酶添加量>酶解温度>酶解时间>柠檬酸浓度。根据极差分析得到珊瑚藻多糖酶法提取的最优方案为A2B3C2D2,所对应珊瑚藻多糖的最佳酶法提取工艺条件为:酶解温度50 ℃、木聚糖酶添加量为0.8%、酶解时间3 h、柠檬酸浓度为0.062 5 g/L。
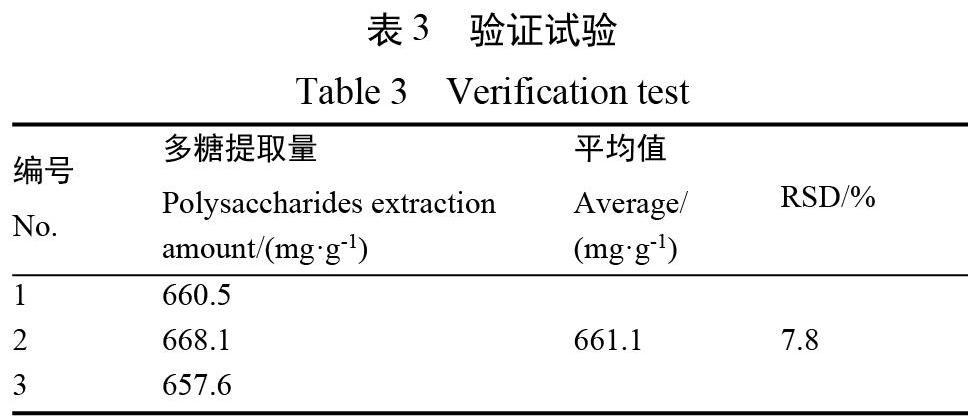
2.3 提取工艺验证
为验证正交试验筛选的最佳酶法提取工艺稳定性,进行3次平行试验。称取20 g珊瑚藻3份,在最佳酶法工艺条件下提取珊瑚藻多糖。由表3可知,3份珊瑚藻样品的平均多糖提取量为661.1 mg/g,RSD为7.8%,表明珊瑚藻多糖的木聚糖酶法提取工艺稳定可行。
3 讨 论
海藻多糖是存在于细胞间和细胞内的一类天然生物大分子物质。对细胞壁的破壁作用可以增加细胞的通透性,是提高海藻多糖提取率的有效手段。海藻细胞壁的主要成分包括纤维素、半纤维素和果胶等,而木聚糖又是半纤维素的主要组成成分。因此,本文全面考察了纤维素酶、果胶酶、木聚糖酶、α-淀粉酶、木瓜蛋白酶等5种酶的破壁作用对珊瑚藻多糖提取量的影响。研究发现,各种酶对多糖提取量的排序为:木聚糖酶>果胶酶>纤维素酶>α-淀粉酶>木瓜蛋白酶,表明木聚糖酶对多糖提取效果最好,这是因为加入木聚糖酶能够切开木聚糖的主链,得到低聚木糖、木糖和阿拉伯糖等降解产物[22],使得珊瑚藻的细胞壁发生分解,增加细胞的通透性,细胞内多糖更容易流出,从而显著提高珊瑚藻多糖的提取率。各种酶解法得到多糖提取液的卷烟感官综合评价排序与多糖提取量排序完全一致。一方面,海藻多糖含有大量的亲水基团,可以与外部水分子紧密结合,同时多糖分子链的交织网状结构加强吸湿和保湿作用,对卷烟起到很好的保润保湿作用[23]。另一方面,多糖提取液作为烟用添加剂加入到卷烟烟丝上,在燃吸卷烟时可能会热裂解产生特有的香气成分,从而改善卷烟的吸食品质[24-25]。
在优选木聚糖酶提取珊瑚藻多糖的基础上,通过单因素试验研究发现,多糖提取量与酶解温度、酶解时间、木聚糖酶添加量、柠檬酸浓度等酶解工艺条件密切相关。其中,多糖提取量随着酶解温度、酶解时间、柠檬酸浓度增加都呈先增大后降低趋势。因为适当提高酶解温度或柠檬酸浓度,或者延长酶解时间都有助于增强木聚糖酶的酶活力,从而提高多糖提取量。但是,酶解温度或柠檬酸浓度过高、或者酶解时间过长反而会抑制木聚糖酶的酶活力,导致多糖提取量减小。此外,多糖提取量随着木聚糖酶添加量呈先增大后趋缓趋势,表明适当加大酶添加量可以提升多糖提取量,但是酶添加量过大,不仅对多糖提取量的提升作用有限,而且还会增加生产成本、不利于规模化生产。
在单因素试验的基础上,通过设计四因素三水平的正交试验,进一步优化木聚糖酶法提取珊瑚藻多糖的工艺条件,研究发现因素的主效应关系为:木聚糖酶添加量>酶解温度>酶解时间>柠檬酸浓度,表明木聚糖酶添加量和酶解温度对珊瑚藻多糖的提取量影响较显著。基于正交试验得到的最佳酶法提取工艺条件为:木聚糖酶添加量为0.8%,酶解温度50 ℃,酶解时间3 h,柠檬酸浓度为0.062 5 g/L。通过3批次工艺稳定性验证试验结果表明,木聚糖酶法提取珊瑚藻多糖的工艺稳定可行。
4 结 论
本研究以珊瑚多藻多糖提取量和卷烟感官质量为评价指标,在单因素与正交试验设计的基础上,开发了基于木聚糖酶法提取珊瑚藻多糖的优化工艺条件。结果表明,當木聚糖酶添加量为0.8%、酶解温度50 ℃、酶解时间3 h、柠檬酸浓度为0.062 5 g/L时,珊瑚藻中多糖提取量为(661.1±7.8) mg/g。在卷烟中添加0.05%珊瑚藻多糖,卷烟烟气变得细柔、圆润、甜感明显,卷烟吸食品质明显改善。下一步将对珊瑚藻多糖的热裂解产物进行研究分析,以揭示珊瑚藻多糖对卷烟的保润增香机理。
参考文献
[1]雷聲,杨锡洪,张玲,等. 糖及糖衍生物在卷烟增香保润中的研究进展[J]. 农产品加工,2016,422(12):44-47.
LEI S, YANG X H, ZHANG L, et al. Research progress of sugar and sugar derivatives in the cigarette flavoring enhancement and moisturizing techniques[J]. Farm Products Processing, 2016, 422(12): 44-47.
[2]郭俊成,刘百战,程晓蕾,等. 保润剂对烟草叶表面微结构的影响[J]. 中国烟草科学,2014,35(1):67-71.
GUO J C, LIU B Z, CHEN X L, et al. Effects of humectants on the tobacco leaf surface microstructure[J]. Chinese Tobacco Science, 2014, 35(1): 67-71.
[3]李伟,黄芳芳,杨君,等. 海藻在卷烟添加剂中的应用研究进展[J]. 海洋科学,2011,35(7):96-100.
LI W, HUANG F F, YANG J, et al. Present status of seaweeds application in cigarette additives[J]. Marine Sciences, 2011, 35(7): 96-100.
[4]王文武,闵玉涛,陶敬,等. 水提法提取海藻多糖及其对α-淀粉酶的抑制活性研究[J]. 中州大学学报,2014,31(6):120-121.
WANG W W, MIN Y T, TAO J, et al. Study on water extraction of seaweed polysaccharide and its inhibitory activity on α-amylase[J]. Journal of Zhongzhou University, 2014, 31(6): 120-121.
[5]闵玉涛,宋彦显,陶敬,等. 海藻多糖的两种提取方法及其降糖活性比较[J]. 食品工业,2015,36(6):43-45.
MIN Y T, SONG Y X, TAO J, et al. Extraction and isolation of
seaweed polysaccharide and study on its hypoglycemic activity[J]. Food Industry, 2015, 36(6): 43-45.
[6]薛丁萍,魏玉西,刘淇,等. 浒苔多糖对羟自由基的清除作用研究[J]. 海洋科学,2010,34(1):44-47.
XUE D P, WEI Y X, LIU Q, et al. Study on the scavenging activity of polysaccharides from enteromorpha prolifera to hydroxyl radical[J]. Marine Sciences, 2010, 34(1): 44-47.
[7]卢茳虹,林宗毅,崔春,等. 柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J]. 食品工业科技,2012,33(23):93-96.
LU J H, LIN Z Y, CUI C, et al. The extraction of polysaccharide from laminaria japonica residue by citric acid and study on antioxidant activities and structural characteristics[J]. Science and Technology of Food Industry, 2012, 33(23): 93-96.
[8]孙士红. 碱提浒苔多糖降血糖、降血脂生物活性研究[D]. 长春:东北师范大学,2007.
SUN S H. Research on regulating blood sugar and blood lipid of alkali extracted polysaccharide from enteromorpha[D]. Changchun: Northeast Normal University, 2007.
[9]王薇. 三种蜈蚣藻多糖的提取分离及结构研究[D]. 青岛:中国海洋大学,2012.
WANG W. Research in separation and structure of sulfated polysaccharides from three kinds of grateloupia[D]. Qingdao: Ocean University of China, 2012.
[10]宋彦显,闵玉涛,陶敬,等. 醇提法提取海藻多糖及其α-淀粉酶的抑制活性研究[J]. 食品科技,2014,39(10):232-234.
SONG Y X, MIN Y T, TAO J, et al. Extraction of seaweed polysaccharide by ethanol and inhibitory activity of α-amylase[J]. Food Science and Technology, 2014, 39 (10): 232-234.
[11]陈小梅,甘纯玑,陈彩玲,等. 响应面法优化微波辅助提取浒苔多糖工艺[J]. 食品研究与开发,2011,32(4):44-48.
CHEN X M, GAN C J, CHEN C L, et al. Microwave-assisted extraction of polysaccharides from enteromorpha prolifera by response surface methodology[J]. Food Research and Development, 2011, 32(4): 44-48.
[12]杨华,庄陈丰. 响应面法优化微波辅助提取龙须菜多糖工艺及其抗氧化活性研究[J]. 食品科学,2011,32(20):79-83.
YANG H, ZHUANG C F. Gracilaria lamaneiformis polysaccharides: optimization of microwave-assisted extraction by response surface methodology and antioxidant properties[J]. Food Science, 2011, 32(20): 79-83.
[13]郭守军,杨永利,张正平,等. 超声波辅助提取蜈蚣藻多糖的工艺优化研究[J]. 食品与机械,2011,27(4):54-57.
GUO S J, YANG Y L, ZHANG Z P, et al. Optimizing for the technics of extracting polysaccharide from the grateloupia filicina with ultrasonic aiding[J]. Food&Machinery, 2011, 27(4): 54-57.
[14]王瑞芳,謝远红. 超声波辅助提取海带多糖及其脱色研究[J]. 江苏农业科学,2013,41(6):248-249.
WANG R F, XIE Y H. Ultrasonication-assisted extraction and decolorization of laminaria polysaccharide[J]. Jiangsu Agricultural Sciences, 2013, 41(6): 248-249.
[15]肖宝石,吕海涛. 酶法提取浒苔多糖工艺优化的研究[J]. 食品与机械,2010,26(5):125-127.
XIAO B S, LV H T. Optimization on enzymatic extraction of polysaccharides from enteromorpha [J]. Food & Machinery, 2010, 26(5): 125-127.
[16]杨仙凌,刘鑫,蒋亚奇. 响应面法优化海藻多糖的酶法提取工艺[J]. 中华中医药学刊,2013,31(8):1794-1796.
YANG X L, LIU X, JIANG Y Q. Optimization of enzymatic extraction technology of polysaccharides from seaweed by response surface methodology[J]. Chninese Archives of Traditional Chinese Medicine, 2013, 31(8): 1794-1796.
[17]陈森林,沈光林,卓浩廉,等. 几种海藻多糖在卷烟中的应用研究[J]. 现代食品科技,2013,29(5):1057-1060.
CHEN S L, SHEN G L, ZHUO H L, et al. Effect of polysaccharides from seaweeds by citric acid extraction in cigarette quality[J]. Modern Food Science and Technology, 2013, 29(5): 1057-1060.
[18]卢茳虹. 海带多糖的分离纯化、结构特性及在卷烟中应用研究[D]. 广州:华南理工大学,2013.
LU J H. Purification and structural characteristics of polysaccharide from laminaria japonica and its application in cigarette[D]. Guangzhou: South China University of Technology, 2013.
[19]杨君,黄芳芳,秦敏朴,等. 裂片石莼多糖微波辅助提取工艺优化及其卷烟保润应用[J]. 河南农业大学学报,2015,49(5):688-695.
YANG J, HUANG F F, QIN M P, et al. Microwave-assisted extraction of polysaccharides from ulva fasciata and its moisture retention[J]. Journal of Henan Agricultural University, 2015, 49(5): 688-695.
[20]杨玉玲. 珊瑚藻硫酸多糖的提取、分离纯化、结构鉴定及部分生物活性的研究[D]. 合肥:安徽大学,2012.
YANG Y L. The extraction, purification and structure as well as bio-activities of sulfated polysaccharide from corallina officinalis[D]. Hefei: Anhui University, 2012.
[21]胡艳南,于广利,吴建东,等. 珊瑚藻硫酸多糖的提取分离及其结构表征[J]. 中国海洋大学学报,2010,40(10):90-94.
HU Y N, YU G L, WU J D, et al. Extraction, isolation and structural characterization of sulfated polysaccharides from corallina officinalis[J]. Periodical of Ocean University of China, 2010, 40(10): 90-94.
[22]高雅君,丁長河. 木聚糖酶在食品工业中的应用研究进展[J]. 粮食与食品工业,2017,24(2):32-36.
GAO Y J, DING C H. Research progress on the application of xylanase in food industry[J]. Cereal and Food Industry, 2017, 24(2): 32-36.
[23]马晓静,宁敏,徐迎波,等. 天然新型烟草保润剂的开发应用研究进展[J]. 安徽农业科学,2015,43(19):260-263.
MA X J, NING M, XU Y B, et al. Research progress of new natural tobacco humectants development and application[J]. Journal of Anhui Agricultural Science, 2015, 43(19): 260-263.
[24]刘珊,张军涛,胡军,等. 裙带菜多糖的热裂解产物分析及卷烟应用研究[J]. 中国烟草学报,2013,19(5):10-15.
LIU S, ZHANF J T, HU J, et al. Analysis of pyrolysis products from undaria pinnatifida polysaccharides and their application in cigarette[J]. Acta Tabacaria Sinica, 2013, 19(5): 10-15.
[25]刘欢,楚桂林,何力,等. 多糖的热裂解性质分析及其在卷烟中的应用[J]. 食品与机械,2020,36(11):217-222.
LIU H, CHU G L, HE L, et al. Analysis of pyrolytic properties of polysaccharides and its application in cigarrette[J]. Food & Machinery, 2020, 36(11): 217-222.
