赤星病发生期不同成熟度烟叶叶际微生物代谢与群落结构
2021-01-09刘亭亭曾陨涛汪汉成蔡刘体张长青
刘亭亭 曾陨涛 汪汉成 蔡刘体 张长青
摘 要:为了解不同成熟度烟叶叶际微生物在代谢功能与群落组成上的差异,采用Biolog ECO代谢表型及高通量测序技术研究了赤星病发生期不同成熟度(成熟、适熟、未熟)烟叶叶际微生物代谢功能与群落结构。结果表明,3种成熟度烟叶叶际微生物在代谢功能上存在较大差异,成熟烟叶叶际微生物代谢活性最强,其次依次为适熟、未熟烟叶,其中均能高效代谢的碳源为L-天冬酰胺酸,均一般或弱代谢的碳源为2-羟基苯甲酸、L-苯基丙氨酸、α-環式糊精、γ-羟基丁酸和苯乙基胺。3种烟叶叶际优势真菌、细菌菌门均分别为子囊菌门和变形菌门,优势真菌属均为链格孢属、枝孢霉属、亚隔孢壳属和Symmetrospora,优势细菌属均为假单胞菌属和鞘氨醇单胞菌属。3种烟叶叶际真菌中,成熟烟叶叶际子囊菌门和担子菌门相对丰度最高,且均显著高于未熟烟叶;3种烟叶叶际细菌中,未熟烟叶的变形菌门相对丰度最高,且显著高于适熟烟叶。3种成熟度烟叶真菌群落和细菌群落在多样性(Shannon、Simpson)上均无显著性差异,但成熟烟叶叶际真菌群落丰富度(ACE)最高,其次依次为适熟、未熟烟叶,且成熟烟叶显著高于未熟烟叶。
关键词:成熟度;群落结构;代谢功能;Biolog ECO;高通量测序
Abstract: This study was conducted to investigate the differences of metabolic function and community composition in the phyllosphere of tobacco brown spot leaves at different maturity stages. The technologies of Biolog ECO metabolic phenotype and high-throughput sequencing were used to analyze three different maturity level tobacco leaves (mature, proper, immaturate) during brown spot occurring season. The results showed there were significant differences in the metabolic functions of tobacco phyllosphere microorganisms from three different maturity tobacco leaves. The highest metabolic activity was found in phyllosphere miroorganism from mature tobacco leaves, followed by the proper and immaturate tobacco leaves. L-Asparagine was the only carbon source that could be effectively metabolized in all three kinds leaf samples, while 2-Hydroxybenzoic Acid, L-Phenylalanine, α-Cyclodextrin, γ-Hydroxybutyric Acid and Phenylethylamine were all moderately or poorly metabolized in the three maturity leaves samples. The dominant phyla of fungi and bacterium of tobacco leaves at three maturity stages were Ascomycota and Proteobacteria, respectively. The dominant fungal genera were Alternaria, Cladosporium, Didymella and Symmetrospora, and the dominant bacterial genera were Pseudomonas and Sphingomonas. Among the three kinds of tobacco phyllosphere fungi, the relative abundance of Ascomycota and Basidiomycota in mature tobacco leaves was the highest, and the relative abundance of mature tobacco leaves was significantly higher than that of immature tobacco leaves. Among the three kinds of tobacco phyllosphere bacteria, the relative abundance of Proteobacteria in immature tobacco leaves was the highest and significantly higher than that in proper tobacco leaves. There were no significant differences in fungal community diversity and bacterial community diversity (Shannon, Simpson) for phyllosphere microorganisms between tobacco leaves at different maturity stages. However, the phyllosphere fungal community richness (ACE) of mature tobacco leaves was the highest, followed by that of proper and immaturate tobacco leaves, and the ACE of mature tobacco leaves was significantly higher than that of immature tobacco leaves.
Keywords: maturity; community structure; metabolic function; Biolog ECO; high-throughput sequencing
烟草(Nicotiana tabacum L.)是一种重要的经济作物,我国每年种植面积约100万hm2,产销量均约占世界总量的1/3[1-2]。该作物在烟叶成熟期分层落黄,下部叶片先成熟,其后为中部叶和上部叶,成熟烟叶在化学成分协调性、物理感官质量及烟叶品质上均优于适熟和未熟叶片[3]。生产上需要根据烟叶成熟度分次逐批采烤,整个采烤期可持续约50 d左右。在烟叶采烤期,常有多种真菌性和细菌性病害发生。其中,最普遍和严重的为烟草赤星病(Tobacco brown spot)。该病害在烟叶打顶前少有发生,主要发生于烟叶成熟期,常先侵染底部脚叶,再逐步向中上部叶片扩展,成熟期有多次侵染循环[4]。
烟叶叶际存在大量微生物[5],已有研究发现烟叶叶际真菌有链格孢属(Alternaria)、茎点霉属(Phoma)等菌属[6];叶际细菌有泛菌属(Pantoea)、假单孢菌属(Pseudomonas)等菌属[7]。然而,这些微生物在叶际的代谢功能和种群结构是否与烟叶成熟度及病害发生间存在联系,尚缺乏了解。Biolog ECO代谢表型技术和高通量测序技术是微生物生态学研究的主要技术,可揭示生态环境下微生物的代谢功能与群落结构,正被广泛用于包括土壤[8]、水体[9]等多个生态环境的研究,也曾被用于揭示烘烤期烟叶霉烂病的发生灾变机制[10]。因此,本文以赤星病发生期田间不同成熟度健康烟叶为研究对象,采用这2种技术,研究成熟、适熟及未熟烟叶叶际微生物代谢功能与群落结构特征,以期揭示大田赤星病发生流行季节烟叶叶际微生物生态学规律,为赤星病发生的微生态灾变机制提供参考依据。
1 材料与方法
1.1 材料
供试烟草品种为云烟87(赤星病中抗品种[11])。Biolog ECO代谢板(货号:#1056),购自美国Biolog公司(USA,CA,Hayward),GeneJET胶回收试剂盒和Ion Plus Fragment Library Kit 48 rxns建库试剂盒,均购自Thermo Scientific公司。
1.2 样品采集
于2020年7月15日,在贵州省晴隆县赤星病发病烟田取不同成熟度健康烟叶(肉眼可见无叶斑部分,但是植株有感赤星病)样品15 g,装入50 mL无菌离心管中,3组样品分别编号为QL1(成熟,从下向上第3叶位)、QL2(适熟,第6叶位)、QL3(未熟,第9叶位),每处理3次重复,成熟度的划分参照生产实践和文献[12-13]。成熟烟叶样品编号为QL11、QL12、QL13,适熟样品编号为QL21、QL22、QL23,未熟样品编号为QL31、QL32、QL33。样品采集后放入低温保存箱,并迅速带回实验室。5 g烟叶样品用于Biolog ECO代谢功能研究;10 g样品保藏于−80 ℃冰箱,用于叶际微生物群落结构和多样性研究。
1.3 不同成熟度烟叶叶际微生物代谢功能分析
分别取3种成熟度烟叶混合样1 g,置于盛有50 mL 0.8%无菌生理盐水的100 mL三角瓶中,28 ℃下180 r/min振荡摇培2 h,静置30 min,取100 µL上清液依次加入到ECO代谢板[14]。接菌后的ECO代谢板置于OmniLog恒温培养箱,28 ℃培养7 d,采用Biolog D5E_OKA_data.exe软件收集叶际微生物代谢孔内颜色变化值,根据颜色变化值,分析其代谢功能。
1.4 不同成熟度烟叶叶际微生物群落结构和多样性分析
采用CTAB法[15]进行微生物基因组DNA的提取,样品DNA纯度和浓度用琼脂糖凝胶电泳检测。将提取的DNA置于离心管中,并用无菌水稀释至浓度为1 ng/μL,以此为模板,使用引物ITS1-5F-F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)、ITS1-1F-R(5′-GCTGCGTTCTTCATCGATGC-3′)与515F(5′-GTGCCAGCMGCCGCGGTAA-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)分别对真菌ITS1区域与细菌V4区域进行扩增。参照文献[7,10]的方法进行多样性测序与分析,真菌和细菌分别通过Unit(7.2)和SILVA132的SSUrRNA数据库进行注释,分析在北京诺禾致源科技股份有限公司完成。
1.5 数据统计与分析
使用Excel 2019进行数据处理,采用DPS 7.5软件对试验数据进行单因素方差分析,应用LSD(Least Significant Difference)法进行差异显著性检验。
2 结 果
2.1 不同成熟度烟叶叶际微生物代谢功能
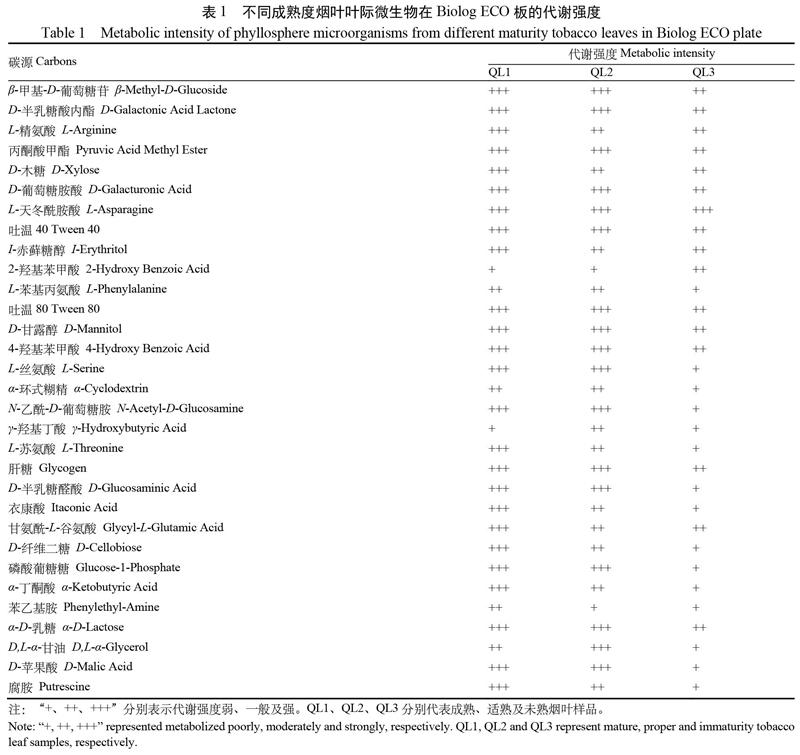
不同成熟度烟叶叶际微生物代谢活性间有較大差异,叶际微生物高效代谢碳源种类数量最多的为成熟烟叶(QL1,25种),其次依次为适熟烟叶(QL2,17种)和未熟烟叶(QL3,1种)(表1)。3种成熟度烟叶叶际微生物均能强代谢的碳源有1种,为氨基酸类的L-天冬酰胺酸(L-Asparagine);代谢活性一般或弱的碳源有5种,分别为酚类的2-羟基苯甲酸(2-Hydroxy Benzoic Acid)、氨基酸类的L-苯基丙氨酸(L-Phenylalanine)、聚合物类的α-环式糊精(α-Cyclodextrin)、羧酸类的γ-羟基丁酸(γ-Hydroxybutyric Acid)、胺类的苯乙基胺(Phenylethyl-Amine)。成熟烟叶(QL1)叶际微生物特有的代谢活性强的碳源有9种,包括L-精氨酸(L-Arginine)、D-木糖(D-Xylose)与I-赤藓糖醇(I-Erythritol)等;适熟烟叶(QL2)叶际微生物特有的代谢活性强的碳源有1种,为D,L-α-甘油(D,L-α-Glycerol);未熟烟叶(QL3)无特有代谢活性强的碳源。
2.2 不同成熟度烟叶叶际微生物群落结构与多样性
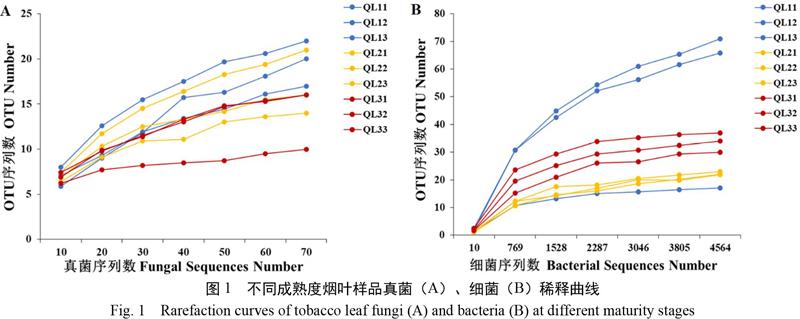
2.2.1 测序深度分析 采用隨机的方式抽取数据,以随机抽取的有效序列数(Sequences Number)为横坐标,以OTU数目(OTU Number)为纵坐标,构建稀释曲线,从图1中可以看出随着测序数目的增加,所有样品的稀释曲线渐渐趋于平缓,说明测序深度已充足,测序数可以覆盖样品里的大部分真菌、细菌。
2.2.2 数据质控分析 以97%一致性(Identity)将测序序列聚类成OTUs,分别与数据库Unit和数据库SSUrRNA比对,进行物种注释,能够注释到真菌数据库的OTUs数目为49(100.00%),注释到界、门、纲、目、科、属、种水平的比例分别为100.00%、55.10%、55.10%、55.10%、50.00%、46.90%、30.60%,共鉴定出真菌的2个门、21个属和15个种。能够注释到细菌数据库的OTUs数目为115(96.6%),注释到界、门、纲、目、科、属、种水平的比例分别为96.60%、81.50%、75.60%、71.40%、64.70%、58.00%、27.70%,共鉴定出细菌的10个门、47个属和33个种。
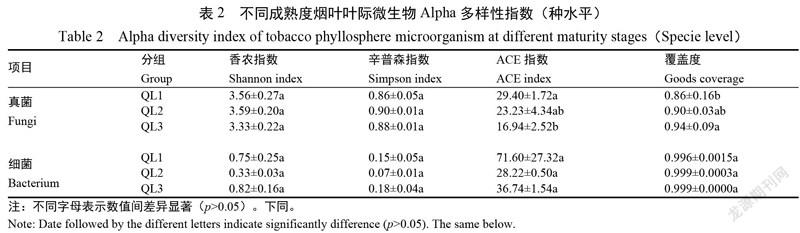
2.2.3 不同成熟度烟叶叶际微生物群落Alpha多样性 结果表明(表2),真菌和细菌群落的覆盖度指数均达到0.85以上,表明测序数据合理,可以真实、合理地反映微生物群落多样性。ACE指数反映群落丰富度,成熟烟叶(QL1)真菌群落ACE指数显著高于未熟烟叶(QL3)(p<0.05);不同成熟度烟叶细菌群落ACE指数间无显著性差异。Simpson和Shannon指数反映群落多样性,不同成熟度烟叶叶际真菌群落、细菌群落间均无显著性差异(p>0.05)。
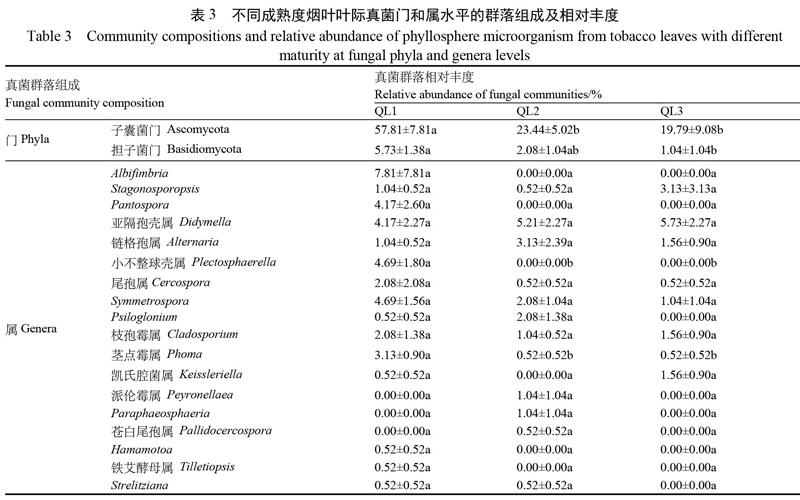
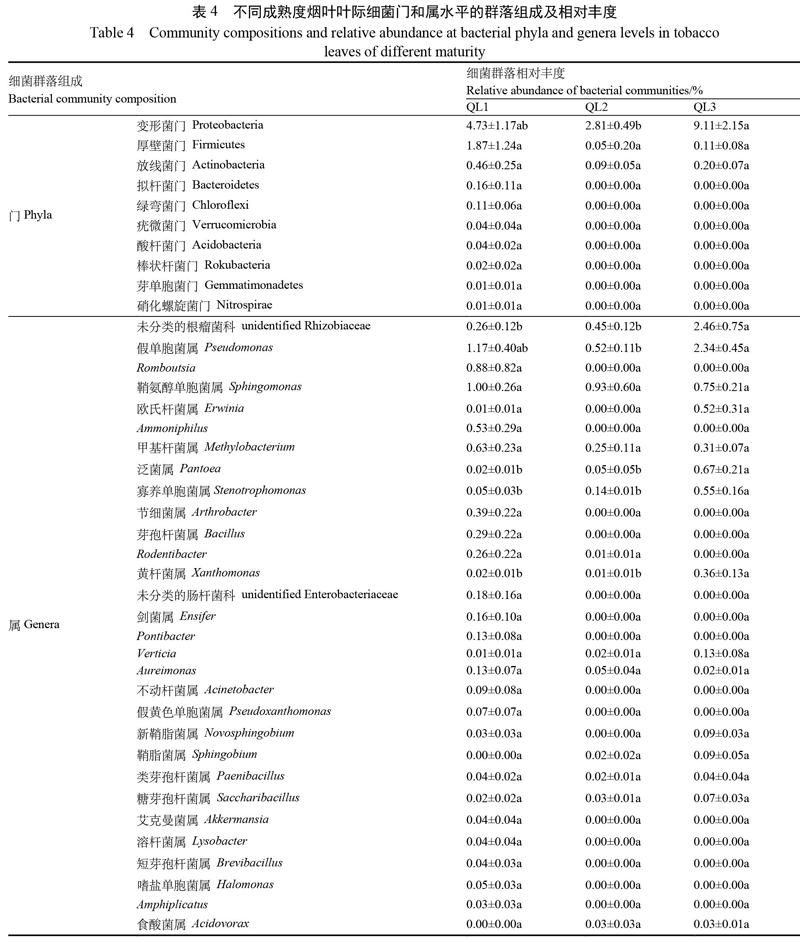
2.2.4 不同成熟度烟叶叶际微生物群落结构 在门水平,不同成熟度烟叶真菌的优势菌门均为子囊菌门(Ascomycota),其中成熟烟叶(QL1)的子囊菌门相对丰度显著高于适熟(QL2)与未熟烟叶(QL3),成熟烟叶(QL1)的担子菌门相对丰度显著高于未熟烟叶(QL3)(表3)。在属水平,3种成熟度烟叶均有的主要菌属有亚隔孢壳属(Didymella)、链格孢属、枝孢霉属(Cladosporium)及Symmetrospora。茎点霉属、尾孢属(Cercospora)及Symmetrospora,其丰度随着成熟度增加而增加。成熟烟叶优势真菌属(≥1.00%)有Albifimbria(7.81%)与小不整球壳属(4.69%)等10种菌属;适熟烟叶的优势菌属(≥1.00%)有亚隔孢壳属(5.21%)与链格孢属(3.13%)等7种菌属;未熟烟叶的优势菌属(≥1.00%)有亚隔孢壳属(5.73%)与链格孢属(1.56%)等6种菌属。成熟烟叶独有的菌属有Albifimbria(7.81%)与小不整球壳属(4.69%)等5种,适熟烟叶独有的菌属有派伦霉属(Peyronellaea,1.04%)、Paraphaeosphaeria(1.04%)、苍白尾孢属(Pallidocercospora,0.52%);未熟烟叶无特有菌属真菌。除茎点霉属、小不整球壳属(Plectosphaerella)外,其余菌属丰度在不同成熟度烟叶间无显著性差异。原始测序数据均上传至GenBank(BioProject ID:PRJNA783754;Biosample accession:SUB10724066)。
在门水平,不同成熟度烟叶细菌的优势菌门均为变形菌门(Proteobacteria),未熟烟叶(QL3)变形菌门相对丰度显著高于适熟烟叶(QL2)(表4)。成熟烟叶(QL1)样品特有菌门有7种,为拟杆菌门(Bacteroidetes,0.16%)、绿弯菌门(Chloroflexi,0.11%)等,适熟烟叶QL2和未熟烟叶QL3无特有菌门。在属水平,不同成熟度烟叶均有的优势菌属为假单胞菌属、鞘氨醇单胞菌属(Sphingomonas)。成熟烟叶QL1优势菌属(≥0.50%)为假单孢菌属(1.17%)、鞘氨醇单胞菌属(1.00%)和Romboutsia(0.88%)等5种菌属;适熟烟叶QL2优势菌属(≥0.50%)为鞘氨醇单胞菌属(0.93%)和假单孢菌属(0.52%);未熟烟叶QL3优势菌属(≥0.50%)为未分类的根瘤菌科(unidentified Rhizobiaceae,2.46%)与假单孢菌属(2.34%)等6种菌属。成熟烟叶特有菌属为Romboutsia(0.88%)、Ammoniphilus(0.53%)、节细菌属(Arthrobacter,0.39%)等14种菌属;适熟、未熟烟叶无特有菌属。在3种成熟度烟叶中,未熟烟叶(QL3)未分类的根瘤菌科、泛菌属、寡养单胞菌属(Stenotrophomonas)和黄杆菌属(Xanthomonas)的相对丰度显著高于适熟烟叶(QL2)和成熟烟叶(QL1),其中假单胞菌属相对丰度显著高于适熟烟叶(QL2)。原始测序数据均上传至GenBank(BioProject ID:PRJN697842;Biosample accession:SAMN17673832)。
3 讨 论
碳源是微生物生命活动的基础,利用Biolog ECO代谢表型技术可以反映生态环境中所有微生物对31种常见碳源的代谢能力,进而反映环境微生物定殖的营养需求特性。本文发现赤星病发生期不同成熟度健康烟叶叶际微生物均可高效代谢L-天冬酰胺酸,均较弱代谢2-羟基苯甲酸和L-苯基丙氨酸等碳源。有报道发现2-羟基苯甲酸可诱导植物激活抗病基因,提高植株的抗真菌、细菌能力[16]。为此,推测L-天冬酰胺酸为有利于健康烟叶叶际微生物定殖的有益碳源,2-羟基苯甲酸等碳源则与之相反,为非有益碳源。这些能被高效代谢的碳源是否存在于叶际,是否为烟叶叶际分泌物,与叶际微生物间定殖的关系如何,是否可以通过添加有益碳源或非有益碳源来调控烟叶叶际微生物菌群或减轻病害发生,等,有待下一步研究与验证。此外,不同成熟度烟叶叶际微生物代谢特征存在较大差异,叶际微生物高效代谢碳源种类数量为成熟烟叶(25种)>适熟烟叶(17种)>未熟烟叶(1种),可能为不同成熟度烟叶叶际的营养物质间存在差异所致;也可能为不同成熟度烟叶叶际微生物的种群和数量间的差异所致,均有待下一步深入研究。
了解病害发生和危害期叶际微生物群落结构是叶部病害灾变规律研究的基础,已有诸多关于赤星病煙叶组织叶际微生物群落结构的报道。刘畅等[6-7]报道了田间感赤星病烟叶组织的优势真菌有链格孢属、茎点霉属、枝孢霉属等;优势细菌有为泛菌属、假单胞菌属、鞘氨醇单胞菌属等。向立刚[17]等报道了赤星病感病和健康烤后烟叶组织的优势真菌有链格孢属、红酵母属(Rhodotorula)。相比而言,本文分析了赤星病发生期田间不同成熟度健康烟叶组织的微生物群落结构,虽然取样组织和时期不同,但均发现烟叶叶际优势真菌链格孢属及优势细菌假单胞菌属和鞘氨醇单胞菌属。为此,推测这些真菌及细菌为烟叶叶际优势微生物种群。同时,这些微生物中,链格孢属、茎点霉属、亚隔孢壳属均被报道能引起烟草叶斑类病害[18-20],推测它们为烟叶叶际核心病原菌种群,在赤星病发生后,这些病原菌因共生可引起复合侵染。本文烟叶样品采集期为赤星病发生期,发现链格孢属真菌(赤星病病原菌)丰度在3种成熟度烟叶上均较高且无显著差异,而成熟烟叶的茎点霉属和小不整球壳属相对丰度显著高于适熟和未熟烟叶,未熟烟叶上未分类的根瘤菌科、泛菌属、寡养单胞菌属等菌属的相对丰度显著高于适熟和成熟烟叶,结果进一步揭示了病害发生期叶际主要病原的空间分布规律。此外,本文发现成熟烟叶叶际真菌丰富度指数显著高于未熟烟叶,且成熟烟叶叶际特有真菌种类也高于适熟、未熟烟叶样品,如Albifimbria、Pantospora及小不整球壳属等。其差异原因,可能与不同成熟度烟叶在糖、烟碱、淀粉等化学成分含量上均存在差异[21]有关,成熟叶片的化学成分、叶片分泌物、叶片结构等可能更有利于更多微生物定殖的相关假说有待进一步验证。
4 结 论
本文基于Biolog ECO代谢表型技术及高通量测序技术研究了赤星病发生期不同成熟度(成熟、适熟、未熟)烟叶叶际微生物代谢功能与群落结构差异,发现成熟烟叶叶际微生物代谢功能和叶际真菌群落丰富度(ACE)最高,其次依次为适熟烟叶、未熟烟叶;烟叶真菌群落和细菌群落在多样性(Shannon、Simpson)上均无显著性差异。3种成熟度烟叶叶际优势真菌、细菌菌门均分别为子囊菌门和变形菌门;优势真菌属均为链格孢属、枝孢霉属、亚隔孢壳属和Symmetrospora,优势细菌属均为假单胞菌属和鞘氨醇单胞菌属。3种烟叶叶际真菌中,成熟烟叶叶际子囊菌门和担子菌门相对丰度最高,其次依次为适熟、未熟烟叶,且成熟烟叶均显著高于未熟烟叶;3种烟叶叶际细菌中,未熟烟叶的变形菌门相对丰度最高,且显著高于适熟烟叶。
参考文献
[1]孙纯泰. 牡丹江烟区赤星病和野火病病害发生影响因子及化学防治研究[D]. 长沙:湖南农业大学,2016.
SUN C T. Study on effect factors and chemical control of Alternaria alternata and wildfire disease on tobacco in Mudanjiang[D]. Changsha: Hunan Agricultural University, 2016.
[2]余展. 湖南烟草业外部成本综合评估[D]. 长沙:湖南农业大学,2012.
YU Z. Comprehensive evaluation of external costs of tobacco industry in Hunan province[D]. Changsha: Hunan Agricultural University, 2012.
[3]刘辉, 祖庆学, 王松峰,等. 不同成熟度对鲜烟素质和烤后烟叶质量的影响. 中国烟草科学,2020,41(2):66-71, 78.
LIU H, ZU Q, WANG S, et al. Effect of different maturity on the quality features of fresh and cured tobacco[J]. Chinese Tobacco Science, 2020, 41(2): 66-71, 78.
[4]STAVELY J R, SLANA L J. Relation of leaf age to the reaction of tobacco to Alternaria alternata[J]. Phytopatholog, 1971, 61(1): 73-78.
[5]AVIS T J, BELANGER R R. Mechanisms and means of detection of biocontrol activity of Pseudozyma yeasts against plant-pathogenic fungi[J]. FEMS Yeast Research, 2002, 2(1): 5-8.
[6]刘畅,汪汉成,谢红炼,等. 感赤星病烟叶的真菌群落结构分析[J]. 贵州农业科学,2019,47(7):54-59.
LIU C, WANG H C, XIE H L, et al. Fungal community structure analysis of tobacco leaf infected with brown spot disease[J]. Guizhou Agricultural Sciences, 2019, 47(7): 54-59.
[7]刘畅,汪汉成,谢红炼,等. 感染赤星病烟草叶际细菌的多样性分析[J]. 烟草科技,2020,53(2):8-14.
LIU C, WANG H C, XIE H L, et al. Biodiversity analysis of phyllosphere bacterial genus from tobacco leaves infected by brown spot disease[J]. Tobacco Science & Technology, 2020, 53(2): 8-14.
[8]黎妍妍, 王林, 彭五星, 李锡宏. 烟草青枯病不同发病阶段根际土壤微生物群落变化趋势分析[J]. 中国烟草科学,2020,41(5):73-78.
LI Y Y, WANG L, PENG W X, et al. Analysis of the changing trend of microbial community in rhizosphere soil during different stages of tobacco bacterial wilt infection[J]. Chinese Tobacco Science, 2020, 41(5): 73-78.
[9]MASSANA R, GOBET A, AUDIC S, et al. Marine protist diversity in European coastal waters and sediments as revealed by high-throughput sequencing[J]. Environmental Mmicrobiology, 2015, 17(10): 4035-4049.
[10]CHEN Q L, CAI L, WANG H C, et al. Fungal composition and diversity of the tobacco leaf phyllosphere during curing of leaves[J]. Frontiers in Microbiology, 2020, 11: 2136.
[11]曾超宁. 不同烟草品种对烟草赤星病的抗性比较[C]//中国烟草学会2016年度优秀论文汇编——烟草农业主题. 中国烟草学会,2016.
ZENG C N. Comparison of resistance of different tobacco varieties to tobacco brown spot[C]//Compilation of 2016 Excellent Papers of China Tobacco Society——Tobacco Agriculture Theme. China Tobacco Society, 2016.
[12]杨树勋. 准确判断烟叶采收成熟度初探[J]. 中国烟草科学,2003(4):34-36.
YANG S X. Preliminary study on accurately judging the harvest maturity of tobacco leaf[J]. Chinese Tobacco Science, 2003(4): 34-36.
[13]韩锦峰,宫长荣,黃海裳,等. 烤烟叶片成熟度的研究:Ⅰ.烤烟叶片成熟和衰老过程中某些生理生化变化的研究[J]. 中国烟草,1990(1):9-13.
HAN J F, GONG C R, HUANG H T, et al. Study on the maturity of flue-cured tobacco leaves: I. Study on some physiological and
biochemical changes of flue-cured tobacco leaves during maturation and senescence[J]. China Tobacco, 1990(1): 9-13.
[14]GROVE J A, KAUTOLA H, JAVADPOUR S, et al. Assessment of changes in the microorganism community in a biofilter[J]. Biochemical Engineering Journal, 2004, 18(2): 111-114.
[15]SAGHAI-MAROOF M A, SOLIMAN K M, JORGENSEN R A, et al. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics[J]. Proceedings of the National Academy of Sciences, 1984, 81(24): 8014-8018.
[16]程小龙. 外源水杨酸诱导烟草抗青枯病的作用及机理研究[D]. 重庆:西南大学,2014.
CHENG X L. Foreign salicylic acid induced resistance to bacterial wilt of tobacco in control efficiency and mechanism of action[D]. Chongqing: Southwest University, 2014.
[17]向立刚,汪汉成,郑苹,等. 赤星病烤后烟叶内生及叶际真菌分析[J]. 中国烟草学报,2020,26(4):93-100.
XIANG L G, WANG H C, ZHENG P, et al. Analysis of endophytic fungi and phyllosphere fungi of flue cured tobacco leaves with brown spot disease[J]. Acta Tabacaria Sinica, 2020, 26(4): 93-100.
[18]GUO Z, XIE H, WANG H, et al. Leaf spot caused by Didymella segeticola on tobacco in China[J]. Plant Disease, 2020, 104(5): 1559.
[19]SLAVOV S, MAYAMA S, ATANASSOV A. Toxin production of Alternaria alternata tobacco pathotype[J]. Biotechnology & Biotechnological Equipment, 2004, 18(3): 90-95.
[20]YUAN G Q, LIAO T, TANG H W, et al. First report of leaf spot caused by Phoma sorghina on tobacco in China[J]. Plant Disease, 2016, 100(8): 1790-1790.
[21]张明厚,张敬荣,贾文香,等. 烟叶成熟衰老程度与对赤星病感病性的关系[J]. 植物病理学报,1998,28(1):49-54.
ZHANG M H, ZHANG J R, JIA W X, et al. The relationship between maturity or senescence of tobacco leaves and brown spot[J]. Acta Phytopathologica Sinica, 1998, 28(1): 49-54.
